アルツハイマー病(Alzheimer's disease, AD)の主要病理の一つに、
「過剰にリン酸化したタウが凝集体を作り、それが脳内を広がっていく」
事はよく言われていますが、
タウは通常の脳でも、多くの部位がリン酸化しており、
他にも、ユビキチン化、アセチル化、メチル化、SUMO化、ニトロ化、糖化 etc. 様々な翻訳後修飾(post-translational modification, PTM)を認めます [1]。
ただ、健常人の脳内タウPTMとAD脳のPTMの部位や量が異なる事が、今までの研究で明らかにされており、そのうちのいくつかはADのバイオマーカーとしての研究が進んでいます。
また、それらのPTMの多く、特にリン酸化に関しては、死後急速に脱リン酸化されます。AD脳では、凝集構造をとるタウが多いせいか、そのスピードがかなり遅く、死後もリン酸化したままとなります [2]。
今回、アメリカ・ボストンこども病院のDr. Seenらの研究グループは、健常人とADの脳のPTMを比較し、ADに特徴的なPTMを調べました [3]。
ADタウの翻訳後修飾について網羅的に解析
タウPTMの同定と、AD vs コントロールでの比較
彼らは、
- AD n = 49
- コントロール n = 42
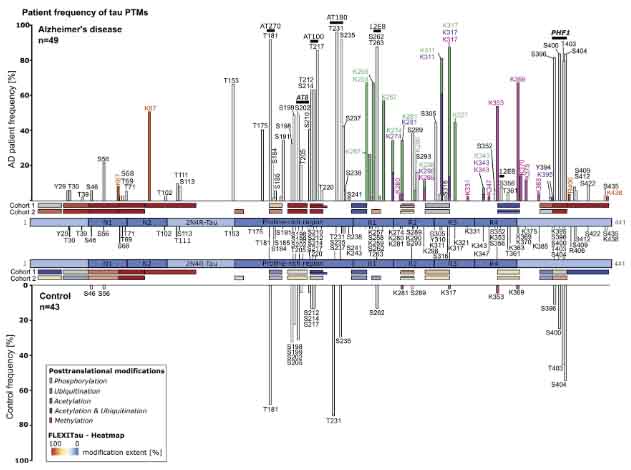
の死後脳の角回(一部の検体は前頭葉も)をサンプリングし、FLEXITau と呼ばれる mass spectrometry 法で、
PTM の有無、種類、場所 etc. を調べ、88のアミノ酸残基に95種類のPTMを同定した。
- リン酸化:55(ADタウ特異的:45)
- ユビキチン化:43(ADタウ特異的:17)
- アセチル化:19
- メチル化:4
タウをサルコシル可溶画分と不溶画分とに分けて調べると、
サルコシル可溶タウはコントロールで、サルコシル不溶タウはAD脳で上がっていた。
サルコシル不溶画分のタウをコントロールとADで比較すると、S199, S202, T205などのリン酸化がAD脳で顕著だった。
他、下記のような結果が得られた。
- アセチル化は微小管結合ドメイン(microtubule binding domain, MBD)のR4で多い(K353, K369, K375)
- ユビキチン化はR1-R3に多い
- R3のhexapeptide (VQIVYK) のK311はアセチル化とユビキチン化の両方がみられる
- リン酸化はproline-rich region (PRR) に多い
- 特にAD特異的なリン酸化部位は、
- 195-209aa (S198,S199,S202,T205)
- 212-224aa (S2112, S214, S217)
- 396-406aa (S396, S400, T403, S404)
- T181とT231のリン酸化はコントロール脳でも多い
- S198, S199, S292, T205のリン酸化はコントロールでも20-40%認め、AD病理の初期を反映している可能性がある。
ADの病態とタウPTMの関係
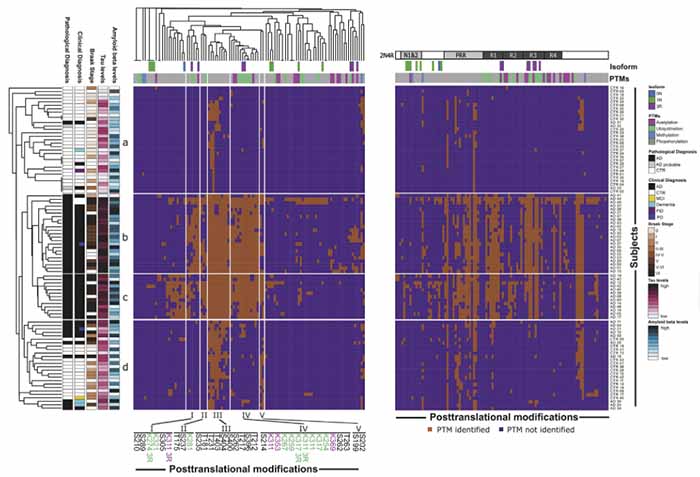
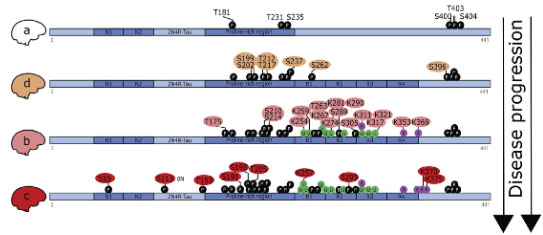
次に彼らは、PTMの特徴によって、a, b, c, dの4つのクラスターに分類し、
- 病理診断
- 臨床診断
- Braak Stage
- タウレベル
- アミロイドβ (Amyloid β, Aβ) レベル
との関連を調べた。
ADは b, c のクラスター、コントロールは a, d のクラスターに多く含まれた。
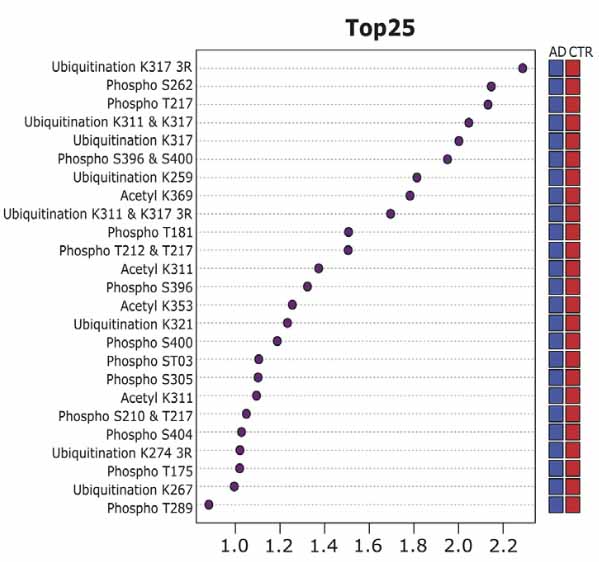
Partial least-squares discriminant analysis (PLS-DA) と呼ばれる方法で、ADの病態等と最も関連しているPTMを調べたところ、
TOP25は下記のようになった。
タウペプチド内でのPTMの解析
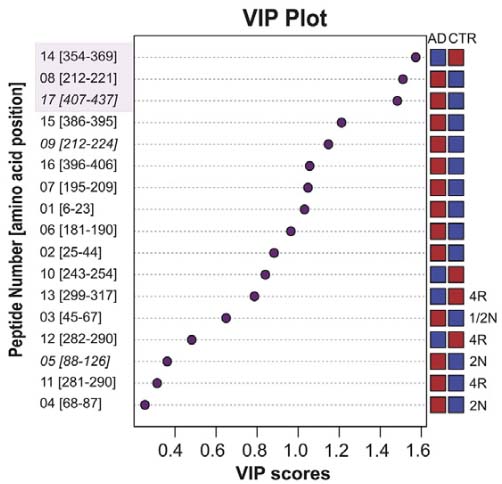
次に、タウペプチド内で、どの部分のPTMがADと関係が深いか調べた。
- PRR周囲 (aa195-224, p195-209; 212-221/224)
- R1-R4 (243-370)
- 特にR2-R3 (260-267, 281-290m 282-190, 299-317, 306-317)
N末やC末のタウは、コントロールとADであまり違いがなかった。
PLS-DAで、最もADに関連のあるPTMを順位付けしたところ、下記のようになった。
タウPTMとシード形成能
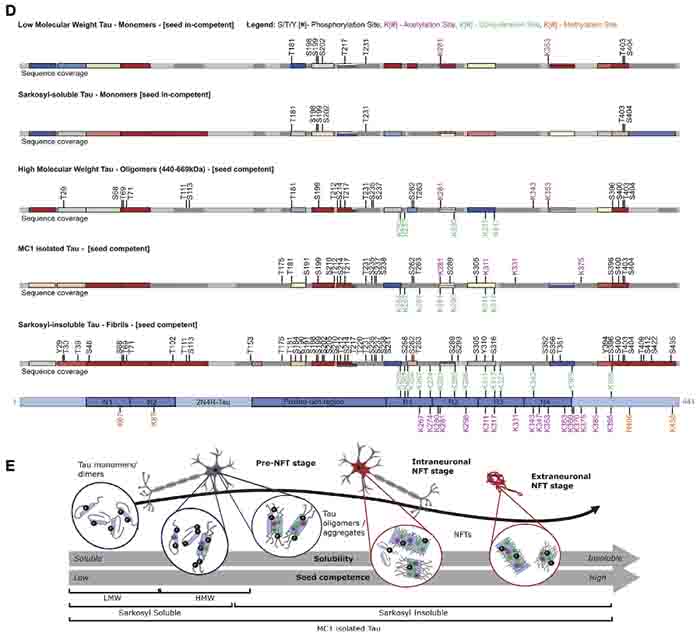
次に著者らは、タウのPTMが、フィブリルのシード形成能と関連があるかどうか調べた。
- サルコシル可溶画分 ("soluble")
- 可溶画分からMC1でIPしたタウ
- 可用性の低分子タウ (LMW)
- 可用性の高分子オリゴマータウ (HMW)
- 不溶性のタウフィブリル
上記のように分類されたタウのシード形成能を調べた著者らの過去の研究で、
- LMW タウはシード形成能がない
- HMW タウおよびサルコシル不溶性のタウフィブリルはシード形成能が高い
ということが明らかとなっている。
PTMで上記の画分同士を比較した所、N末のPTMはLMW, HMW ともにあり、シード形成能との関連が薄いと考えられた。
一方、MBD の PTM は、シード形成能の高いフィルリル画分のタウに多かった。
HMWはオリゴマーと考えられるが、20箇所のリン酸化 (N末6箇所、PRR 10箇所、C末4箇所)と、3箇所のアセチル化と4箇所のユビキチン化 (いずれもMBD) が見られた。
これらのPTMは、同じAD患者でも、患者間でかなりのばらつきが見られた。
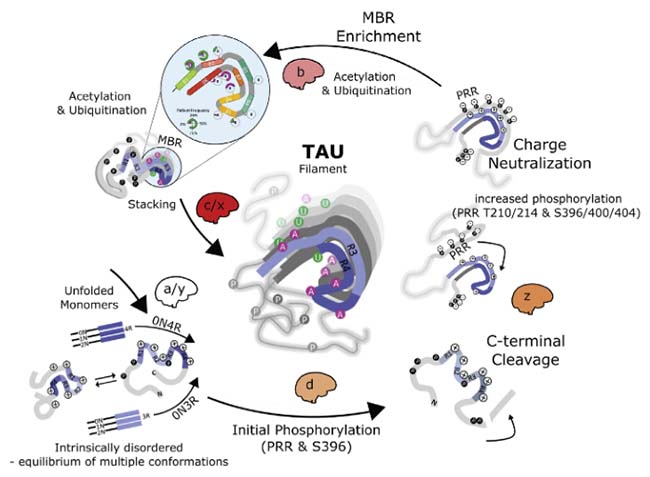
タウ病理の進展とタウのPTM
これまでの結果をクラスタリングすると、下記のようにいえる。
- Cluster a: 最初、Braak stage 0-I の脳内では、BA39、PRRに3箇所、aa400-404に3箇所にリン酸化がみられる。
- Cluster d: Braak Stage III-IV に進むと、PRRにさらに6箇所とC末の S396 にリン酸化が増える。
- Cluster b: Braak stage V or VI までくると、MBD の複数の箇所にアセチル化やユビキチン化がみられる。
- Cluster c: Graak Stage VI では、N末からC末にかけて、至るところでPTMが増えている。
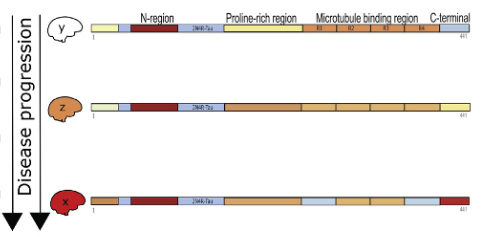
さらに、FLEXITauのデータをサマライズして、3ステップに分類した (y, z, x)。
- a/yステージでは、タウは凝集していない段階。T181, T281, S235, S400. T403, S404等がリン酸化している。
- dステージで、PRRとS396がリン酸化する
- C-terminalで切断がおこり、zステージへ移行する。ここでは、PRR T210/214, S396,/400/404のリン酸化が増える。
- MTBのアセチル化、ユビキチン化により、電化極性が中和される。
- MBR部位でのリン酸化が増える、bステージに移行する。
- さらにアセチル化、ユビキチン化が進み、MBRの凝集が固まっていく。
- c/xステージとなり、タウフィラメントが完成する。
My View
かなり包括的な内容ですが、多くの情報があり、タウの研究をするのであれば抑えておくべき内容だと思います。
ただ気をつけておくべきは、これらのPTMが、凝集の各過程と関連している事はたしかでも、原因かどうかはわからないという事です。
MBD周辺のアセチル化・ユビキチン化による極性の中和 → 凝集 というのは納得がいきますが、証明したわけではないので。
他の部位のリン酸化等も、凝集過程の各工程の原因なのか、結果なのかはわかりません。
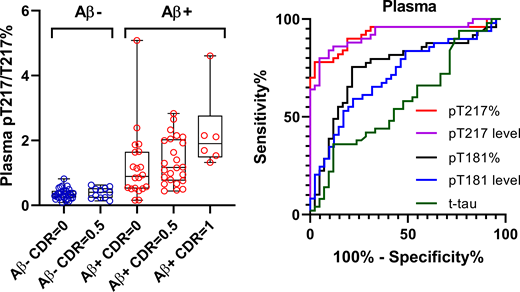
個人的に意外だったのは、T181のリン酸化が、コントロール脳でも多く、AD特異的とはいえない、という事。
昨年、髄液中および血漿中のp-181がADのバイオマーカーとして注目されたので、この部分のリン酸化はAD特異的なのかと思っていました。
先月のNature Medicineに抱き合わせで発表された、血漿P-tau181に関する報告を2報紹介します。 血漿中P-tau181はADの有望なマーカーとなり得る スウェーデン・Lund 大学からの報告 1つ目の論 …
T181は通常リン酸化しているけれども、AD(早期AD)では、その部分が露出する形で髄液/血漿中に出てくる、という事でしょうか?
でも、構造的には、通常の状態の方が露出してそうな気がするのですが……良い解釈があれば、誰か教えてください。
ちなみに、T217の方はAD早期からリン酸化される、ということで、バイオマーカー研究の結果とも一致する気がします。
アルツハイマー病(Alzheimer's disease, AD)のバイオマーカーとして、 血漿中のAβ/タウ/NfLの組み合わせの報告(こちら)、 血漿中のp-tau181の報告(こちら)等、 色々でてきていますが、 …
以前、p-tau181が血漿サンプルで測定可能で、かなりアルツハイマー病(Alzheimer's disease, AD)特異的なバイオマーカーになり得る [1, 2]、という話(こちら)をしました。 また、別のタウリン …
References
- Martin L, Latypova X, Terro F. Post-translational modifications of tau protein: implications for Alzheimer's disease. Neurochem Int. 2011 Mar;58(4):458-71. doi: 10.1016/j.neuint.2010.12.023. Epub 2011 Jan 6. PMID:21215781.
- Matsuo ES, Shin RW, Billingsley ML, Van deVoorde A, O'Connor M, Trojanowski JQ, Lee VM. Biopsy-derived adult human brain tau is phosphorylated at many of the same sites as Alzheimer's disease paired helical filament tau. Neuron. 1994 Oct;13(4):989-1002. doi: 10.1016/0896-6273(94)90264-x. PMID:7946342.
- Wesseling H, Mair W, Kumar M, Schlaffner CN, Tang S, Beerepoot P, Fatou B, Guise AJ, Cheng L, Takeda S, Muntel J, Rotunno MS, Dujardin S, Davies P, Kosik KS, Miller BL, Berretta S, Hedreen JC, Grinberg LT, Seeley WW, Hyman BT, Steen H, Steen JA. Tau PTM Profiles Identify Patient Heterogeneity and Stages of Alzheimer's Disease. Cell. 2020 Dec 10;183(6):1699-1713.e13. doi: 10.1016/j.cell.2020.10.029. Epub 2020 Nov 13. PMID:33188775.