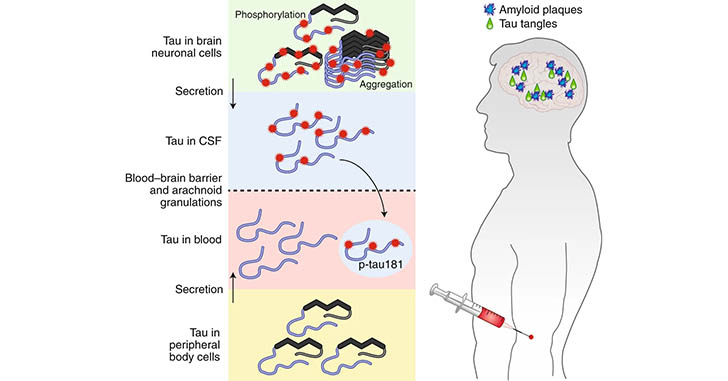
先月のNature Medicineに抱き合わせで発表された、血漿P-tau181に関する報告を2報紹介します。
血漿中P-tau181はADの有望なマーカーとなり得る
スウェーデン・Lund 大学からの報告
1つ目の論文はこちら
Plasma P-tau18 level increased with progression of Alzheimer’s disease (AD) and differentiated AD dementia from other neurodegenerative diseases, supporting its further development as a blood-based biomarker for AD.
(概要)
アルツハイマー病(Alzheimer's disease, AD)では、血漿中のタウ181のリン酸化が増加している模様。
スウェーデンのLund大学のHanelidze, Hanssonらのグループは、認知症無し、軽度認知機能障害(mild cognitive impairment, MCI)、アルツハイマー病(Alzheimer's disease, AD)の被験者589人を対象に、血漿中のP-tau181を測定した。
血漿中P-tau181は、プレクリニカルADで軽度上昇し、MCIや認知症群でさらに上昇した。
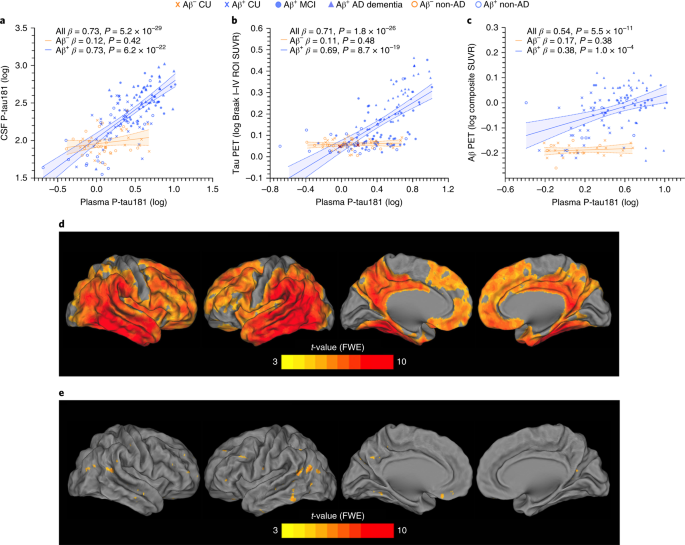
血漿中P-tau181の濃度は、脳脊髄液(cerebrospinal fluid, CSF)中のP-tau181の濃度、タウPETの陽性率、Braak stageと正の相関を示した。
アメリカ・カリフォルニア大学サンフランシスコ校からの報告
2つ目の論文はこちら
Plasma pTau181 concentrations are elevated specifically in patients diagnosed with Alzheimer’s disease compared to those diagnosed with frontotemporal lobar degeneration or elderly controls, supporting its further development as a blood-based biomarker for AD.
(概要)
血漿中のバイオマーカー測定は、最近承認された、CSF検査やアミロイドベータ(Amyloid beta, Aβ)PETよりも低侵襲である。
アメリカUCSFのBoxerら、Advancing Research and Treatment for Frontotemporal Lober Degeneration (AFTFL) investigatorsらは、AD/その他のタウオパチー/コントロール群の、血漿中P-tau181濃度を調べた。
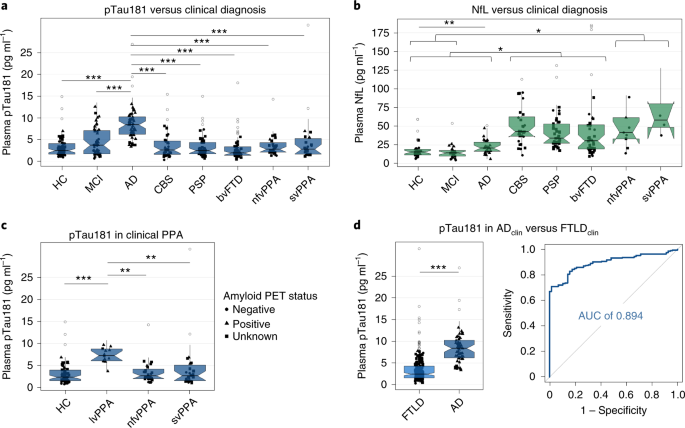
AD患者では、血漿中P-tau181がコントロール群に比べて3.5倍高く、他のタウオパチー(CBS, PSP, bvFTD, nfvPPA, svPPA)ではほとんど上がっていなかった。
特にADとFTLDは明確に区別できた。
一方、血漿中ニューロフィラメント軽鎖(Neurofilament light chain, NfL)は、
ADで上昇していたが、他のタウオパチーではもっと上昇しており、ADと他のタウオパチーとの区別はつけられなかった。
血漿中P-tau181は、Braak Stage、アミロイドPET、タウPETと正の相関があった。
My View
先日、血漿中のタウ/NfL/Aβの組み合わせがバイオマーカーとして有効、という報告を読みました(こちら)が、今回の報告を読むと、P-tau181をみれば万事OK、という事のよう。
こっちの方がよさそうだな。
このアッセイは、以前京都府立大の徳田先生たちのラボから報告がありました(Tatebe et al., Bol Neurodegen, 2017)。
Background There is still a substantial unmet need for less invasive and lower-cost blood-based biomarkers to detect brain Alzheimer’s disease (AD) pathology. This study is aimed to determine whether quantification of plasma tau phosphorylated at threonine 181 (p-tau181) is informative in the diagnosis of AD. Methods We have developed a novel ultrasensitive immunoassay to quantify plasma p-tau181, and measured the levels of plasma p-tau181 in three cohorts. Results In the first cohort composed of 20 AD patients and 15 age-matched controls, the plasma levels of p-tau181 were significantly higher in the AD patients than those in the controls (0.171 ± 0.166 pg/ml in AD versus 0.0405 ± 0.0756 pg/ml in controls, p = 0.0039). The percentage of the subjects whose levels of plasma p-tau181 exceeded the cut-off value (0.0921 pg/ml) was significantly higher in the AD group compared with the control group (60% in AD versus 16.7% in controls, p = 0.0090). In the second cohort composed of 20 patients with Down syndrome (DS) and 22 age-matched controls, the plasma concentrations of p-tau181 were significantly higher in the DS group (0.767 ± 1.26 pg/ml in DS versus 0.0415 ± 0.0710 pg/ml in controls, p = 0.0313). There was a significant correlation between the plasma levels of p-tau181 and age in the DS group (R2 = 0.4451, p = 0.0013). All of the DS individuals showing an extremely high concentration of plasma p-tau181 (> 1.0 pg/ml) were older than the age of 40. In the third cohort composed of 8 AD patients and 3 patients with other neurological diseases, the levels of plasma p-tau181 significantly correlated with those of CSF p-tau181 (R2 = 0.4525, p = 0.023). Conclusions We report for the first time quantitative data on the plasma levels of p-tau181 in controls and patients with AD and DS, and these data suggest that the plasma p-tau181 is a promising blood biomarker for brain AD pathology. This exploratory pilot study warrants further large-scale and well-controlled studies to validate the usefulness of plasma p-tau181 as an urgently needed surrogate marker for the diagnosis and disease progression of AD.
この時は、20人のADと15人のコントロール群の血漿中P-tau181を測定し、有意差をもってADで上がっていましたが、若干感度が悪かった様子。
今回は、さらに感度があがっており、他のタウオパチーとも識別可能ということで、かなり有用な印象。
普通に血液でADの診断ができる日がきそうだな。
References
- Janelidze, S., Mattsson, N., Palmqvist, S. et al. Plasma P-tau181 in Alzheimer’s disease: relationship to other biomarkers, differential diagnosis, neuropathology and longitudinal progression to Alzheimer’s dementia. Nat Med 26, 379–386 (2020). https://doi.org/10.1038/s41591-020-0755-1
- Thijssen, E.H., La Joie, R., Wolf, A. et al. Diagnostic value of plasma phosphorylated tau181 in Alzheimer’s disease and frontotemporal lobar degeneration. Nat Med 26, 387–397 (2020). https://doi.org/10.1038/s41591-020-0762-2
- Tatebe, H., Kasai, T., Ohmichi, T. et al. Quantification of plasma phosphorylated tau to use as a biomarker for brain Alzheimer pathology: pilot case-control studies including patients with Alzheimer’s disease and down syndrome. Mol Neurodegeneration 12, 63 (2017). https://doi.org/10.1186/s13024-017-0206-8