頭は停滞していても、Alzforumのチェックだけは欠かすべからず。
去年はこれをまとめるだけの気力がなかったですが、今年は挽回……とゆーことで。
Alzforumの2023年のまとめ記事。
治療
レケンビ(レカネマブ)
去年、最も世間を賑わせたのが、Leqembi(Lecanemab)ですね。
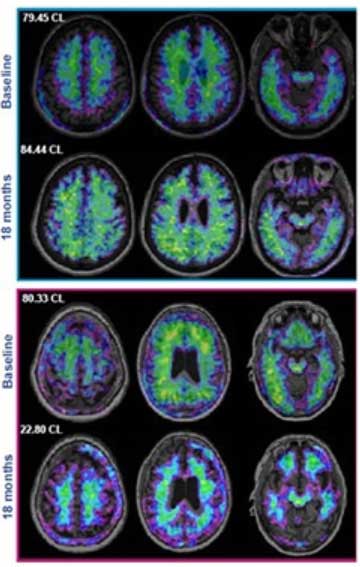
2023年7月に承認を受けてから、アメリカの複数の大学ですぐに実用化されました。
日本でも2023年9月に承認され、すでに臨床で使用されています……日本にしては早かったですね!
中国でも2024年1月に承認予定とのこと。一方、ヨーロッパではまだ未定だそうです。
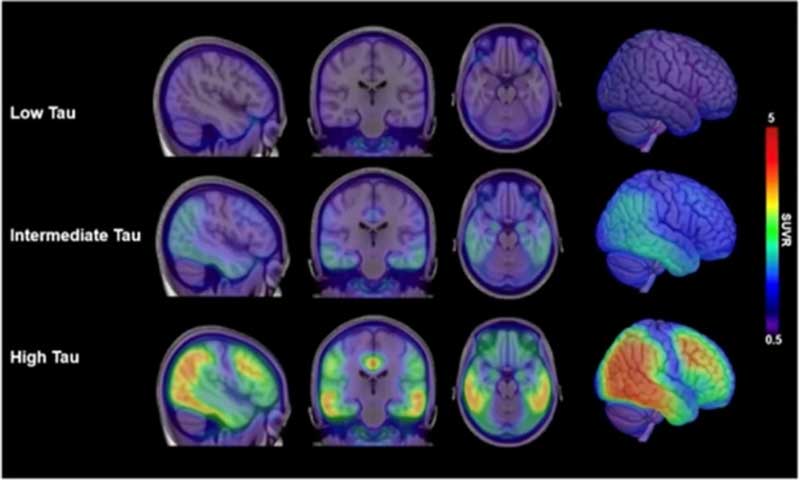
ドナネマブ
次に承認を待っている薬は「Donanemab」。
現在、Phase 3に入っています。タウPETで変化がないという一抹の不安は残りますが……。
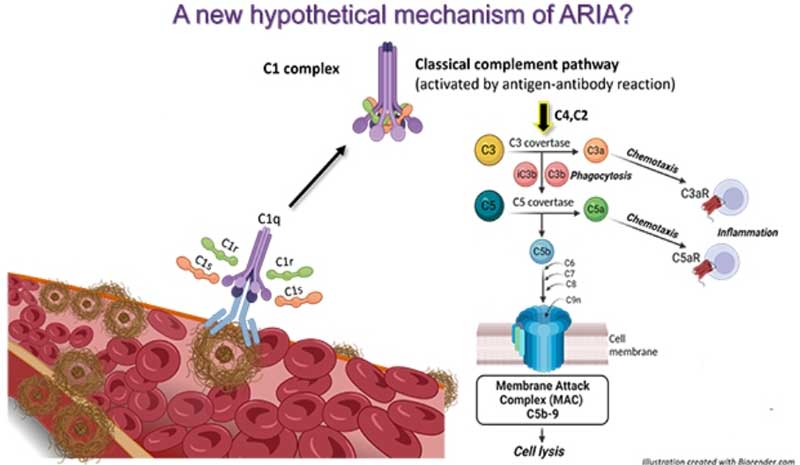
ARIA問題にも注目
Lecanemabもそうですが、多くの抗アミロイドβ抗体は、アミロイド関連画像異常(Amyloid-Related Imaging Abnormalities, ARIA)という副作用が大きな問題となります。
今後は、ARIAやCAAに関する研究も進むと思われます。
次世代の抗体療法
一方で、次世代の抗体療法の開発も進んでいます。
例えば、自己皮下注製剤や、ARIAが発生するとされる大きな血管を迂回し、毛細血管を介して脳実質に入る脳シャトルバージョンなど。
Leqembiの承認により、以前は行き詰まりとされていた抗アミロイドアプローチへの関心が再燃しました。
γ-セクレターゼモジュレーターはPhase 2に移行しました。低用量BACE阻害剤については話題になっていますが……まだ明確な動きはありません
抗SOD1 ASO治療
去年は、SOD1変異を持つ筋萎縮性側索硬化症(Amyotrophic lateral sclerosis, ALS)の患者さん達にとっても非常に意義深い年となりました。
FDAは抗SOD1アンチセンスオリゴヌクレオチド(antisense oligonucleotide, ASO)抗体「Qalsody(Tofersen)」の迅速承認(accelerated approval)を認めました。
Tofersenは、脳脊髄液(cerebrospinal fluid, CSF)中のSOD1だけでなく、ニューロフィラメント軽鎖(neurofilament light chain, NfL)の量も減らします。
これは神経変性を防いでいる可能性が示唆され、迅速承認の根拠となったのです。
これはかなり大きな事でして、抗FUS ASLの「ION363」もCSF中のNfLを減らします。
これを受けて、抗ataxin ASOのBIIB105の臨床試験でもNfLの測定が項目に追加されました。
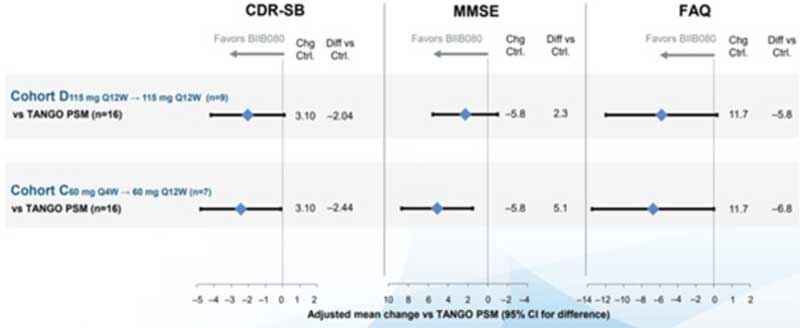
抗タウ ASOの「BIIB080」はPhase 1で、CSF中のタウやタウPETでのタウタングルの減少などが見られており、臨床症状の改善により俄然活気づいています。
酵素置換療法
さらに、2023年にはLamzede、Elfabrio、PombilitiがFDAの承認を受けました。
これらの酵素置換療法は、α-マンノシダーゼ欠損症、ファブリー病、ポンペ病という希少なリソソーム病の治療薬となります。
これらの薬は中枢神経系には到達しませんが、特定の酵素欠損を正すことが患者に役立つことを確認することで、アルツハイマー病とそれに関連する認知症(alzheimer's disease and related dementias;ADRD)の研究者たちに希望を与えています。
これを受けて今、脳内のリソソームターゲットを定義し、神経疾患において薬を届けるレースが始まっています。
2023年6月、Denaliはハンター症候群(小児期のリソソーム貯蔵病)の酵素代替療法であるDNL301が、オープンラベルのフェーズ1/2試験でCSF NfLを半減させたと報告しました。
臨床的な利益の兆しにより、DNL301はフェーズ2/3に進みました。
プログラニュリン代替療法の脳シャトルバージョンであるDNL593はCSFプログラニュリンを増加させたと報告されていますが、まだNfLや臨床データは報告されていません。
また、 前頭側頭型認知症(fronto-temporal dementia, FTD)の治療薬として、DNL593も開発されています。
合成ペプチド
合成ペプチドが成功することは稀ですが、2023年にはFDA承認を受けた合成ペプチドがあります。
FDAは、レット症候群に対してDaybue(trofinetide)を承認しました。
AD研究では、Aβオリゴマーに対する剛性ペプチドがPhase 2に進んでいます。
認知症患者の興奮を抑える薬
2023年5月に、認知症患者のagitation症状を抑える薬として、FDAはbrexpiprazoleを承認しました。
認知症患者の介護者にとって最も困るのは、患者の記憶が低下する事ではなく、精神症状が強くなる事です。
この薬は、そんな患者家族にとってとても大きな助けとなると思います。
バイオマーカー
バイオマーカーも躍進しました。
p-tau217
まずはp-Tau217。
かなり特異度高くADと健常者を区別できます。
また、p-tau217/217比を取ることで、よりプラークとタングルとの相関の精度をUPできます。
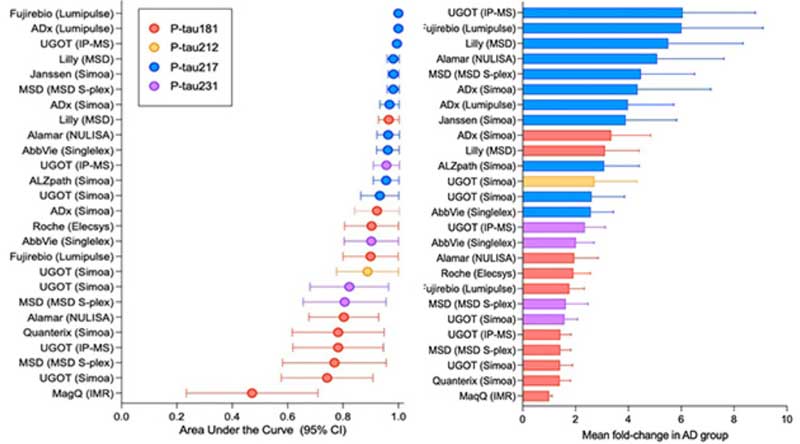
2023年、C2Nは、このp-tau217/217比とAβ42/40比を組み合わせた新しいプラズマテスト、PrecivityAD2の販売を開始しました。
このテストはまだFDAの承認を受けていませんが、RocheのAβ42/全体タウ脳脊髄液(CSF)テストは昨年6月にFDAの承認を得て、2022年に承認されたRocheのCSF Aβ42/p-tau 181のテストに加わりました。
ちょっと心配なのは、Quest Diagnostics。多くの専門家が懸念を表明する中、Quest Diagnosticsはピアレビューされたデータがないにも関わらず、直接消費者に対してAβ42/40血液検査を販売し始めました。
NIA-AAのAD診断基準の改定
去年7月、NIA-AAがADの診断基準を大幅に改定し、業界をわかせました。
NIA-AAはタウマーカーを二分することを提案しました。そのうちの一つは可溶性のリン酸化タウを測定するもので、アミロイド病理をよく反映します。
もう一つはタウフィブリルですが、これは現在、ロイシン243を含むタウの微小管結合ドメインの断片が最良の選択肢とされています。
その他のADバイオマーカー
プロテオミクス解析により、Aβやタウ以外にもバイオマーカーになりそうなタンパクが次々と見つかっています。
2023年には、48のタンパクがAD患者のCSF中で増加している事がわかりました。
常染色体顕性遺伝アルツハイマー病(autosomal-dominant Alzheimer's disease, ADAD)の患者CSF内では、症状が出る30年前からCSF中の細胞外マトリックスタンパクが上がっている事が報告されています。
また、孤発性ADと家族ADを区別するマーカーも報告され、
TREM2やプログラニューリンノックアウトマウスの研究から、ミクロぐらいの活性化などのマーカーも注目されています。
AD以外の神経変性疾患バイオマーカー
AD以外のバイオマーカーも良い兆しが見えてきています。
2023年は、α-シヌクレイン (α-synuclein, α-syn) のPETトレーサー「18F-ACI-12589」が開発されたという報告がありました。
若干物議を醸すデータではありましたが、続報に期待です。
他に、大脳皮質基底核変性症 (Corticobasal degeneration, CBD) などの4Rタウを主体とするタウオパチーのバイオマーカーの候補として、CSF中のMTBR-275とMTBR-282フラグメントが浮上しました。
また、患者CSF内で「cryptic peptides」も見つかっています。これはTDP-43プロテイノパチーの患者にとって朗報となりそうです。
TDP-43プロテイノパチーでは、RNA結合タンパクのTDP-43が核内での役割を放棄し、RNAをミススプライシングイベントにさらして「cryptic peptides」と呼ばれる翻訳可能な状態を作る事が分かっているからです。
脂質
中枢神経内にある、何千もの脂質と何百ものリポ蛋白の中から、科学者達は神経変性疾患のモジュレーターになりそうなものを見つけました。
ミクログリアのAβ貪食を妨げるトリグリセライドで満たされた脂肪滴、α-synの凝集を促進する長鎖脂肪酸、神経毒性脂肪酸の合成と放出を抑制するアストロサイト受容体TMEM164などが報告されました。
FTDやADに関与する膜貫通型タンパクのTMEM106bは軸索髄鞘を保護する役割がある事がわかりました。
ミクログリアもオリゴサイトの脂質代謝を制御することで、ミエリンを守っているようです。
コレステロールはミクログリアのAβ貪食を促進しますが、その代謝産物である25-hydroxycholesterolは炎症を惹起し、タウオパチーモデルの神経変性を悪化させます。
脂肪酸やコレステロールを超えて、炎症を調節するリポイドの領域が広がっています。
プロスタグランジンやロイコトリエンは急性炎症を引き起こすことができ、構造的に関連する「特殊な解決媒介物」はそれを鎮めることができます。
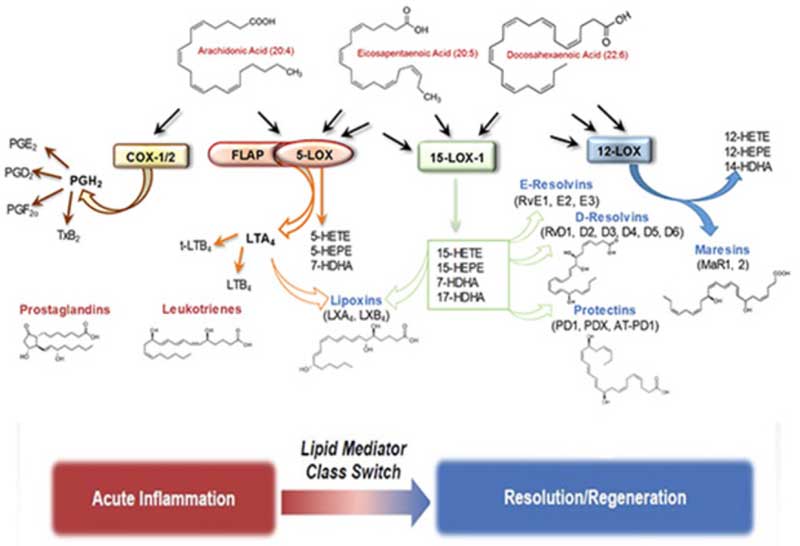
また、脳脊髄液に現れる数百のリポプロテインも研究の対象となっており、多くは炎症や免疫応答との関連が示唆されています。
去年、ADPDミーティングでは、初めて脂質の恒常性異常をテーマにしたシンポジウムを開催しました。
また、Lipids in Brain Diseasesというカンファレンスも隔年で開催される事になりました。
髄膜/免疫細胞
教科書的にはこれまで、脳を取り巻く膜は3つ(硬膜、くも膜、軟膜)だと言われてきました。
しかし2023年、これらの膜に加えて、クモ膜と軟膜の間に第四の膜と呼ばれる「クモ膜下リンパ様膜(SLYM)」が存在し、その空間を分けていると主張する論文が物議を醸しました。
論争の決着はついておらず、この第四の膜とされる細胞群が実際にはクモ膜の一部であると考える科学者もいます。
これらの膜の理解は重要で、脳を保護するだけでなく、脳脊髄液の流れやADに関与する特定の免疫細胞の生成に影響を与える可能性があります。
2023年には、マウスや三次元細胞モデルでのタウやAPP/PS1変異による神経変性をT細胞が加速させるという報告もありました。
フィブリル
プロテイノパチーを研究する科学者にとって、フィブリルの構造はそれらの研究の中心的役割を成す事になると思います。
これまで、cryo-EMでは、Aβ、タウ、α-syn、TMEM106bの構造を高解像度で明らかにしてきました。
2023年はこれに加えて、Aβ40、TDO-43、TAF15の構造が明らかとなりました。

脳アミロイド血管症(cerebral amyloid angiopathy, CAA)や2タイプのFTDの患者達CSF中から採取したこれらのタンパクの構造は、新しいPETリガンドや治療ターゲットとして多く活用されるでしょう。
実際、cryo-EMによって、MK6240が神経原線維変化の良いPETリガンドになることが証明されています。
たくさんのアミロイド繊維がcryo-EMで解析されており、現時点で261の構造が解明されているそうです。
けれども、これらのフィブリルは、脳内を伝播するのでしょうか?
2023年、科学者たちはタウが数十の繊維状中間体を形成し、最終的にADや慢性外傷性脳症で見られる共通のプロトファイブリル前駆体に変化することを発見しました。ただ、タウが他の疾患で同様の変化を遂げるかは不明です。
過去10年間、細胞ベースのセンサーがタウの繊維化を促す種を同定し定量化するのに役立ってきましたが、cryo-EMはこれらのアッセイを検証しました。
タウが繊維を形成する理由として、アセチル化、異常なユビキチン、RNA結合タンパク質が影響する可能性がありますが、2023年の脳イメージングでは、デフォルトモードネットワークのプラークが内側側頭葉でタウ繊維の拡散を加速させることが示されました。
また、エクソソームやシナプスに結合したタウが拡散を促進するとも言われています。
ミクログリア
タウの刺激が無くても、ミクログリアはcGAS-STING炎症反応を自発的に引き起こし、マウスが加齢するにつれてニューロンを損傷させる事がわかりました。
昨年明らかになったミクログリアの他の調節因子は、MS4A4AやPLCγ2遺伝子多型などです。
MS4A4Aは細胞の炎症状態への移行を促進し、PLCγ2はプラークの除去を調節します。
ADリスク遺伝子のclusterinとCD33は、ミクログリアによるAβの貪食を抑制することが共謀しており、22ヌクレオチドのmRNA miR155も同様の効果を持ちます。
他の研究では、ミクログリアが細胞外のAβを除去できることが示唆されました。
彼らはリソソームを細胞表面に送り、その器官が近くのプラークに消化液を吐き出します。
これらのリソソームは、Aβとタウの凝集の温床になる可能性があり、この混合物を細胞外空間に放出することで、病理を広げる可能性があり、残念ながらそれを抑制することはありません。
他の研究では、ミクログリアがプラークを除去しない場合、彼らは老化状態に入ることが示唆されています。
Aβプラークを取り囲んだり除去したりすることは、認知機能低下を防ぐ方向に働くと言われていますが、過剰に活動的なミクログリアは多くのシナプスを刈り取ることで逆の結果をもたらすかもしれません。
昨年、科学者たちは、周辺血管マクロファージが炎症性サイトカインを放出することでこの刈り取りを引き起こすと報告しました。
マクロファージは、血管を通じて除去されるAβに反応します。
一方で、この刈り取りはADで過活動となるネットワークを抑制することができるので、全て悪いわけではないかもしれません。
オミックス解析
single-cellオミックスは、健康な脳と病気の脳内で起こっている事を高解像度のスナップで提供しつづけています。
10月には、NIHの「脳研究を通じた革新的な神経技術の進展」イニシアティブ、通称「BRAIN」が、健康な人間の脳のこれまでで最も詳細な細胞アトラスを発表しました。
ここには、様々な技術を用いて、3300種類の細胞を数百万マッピングしています。
12月には、5300種類の細胞を特定したマウス脳のより高解像度のマップを発表しました。
ADでは、single-cellトランスクリプトミクスおよびエピゲノム解析により、死後前頭皮質でダメージを受けたDNAと崩壊した細胞アイデンティティが明らかになりました。
空間トランスクリプトミクスおよび組織病理学は、プラーク周辺の細胞反応のグラデーションを特定し、single-nucleusトランスクリプトミクス研究はAD血管系の異常細胞を指摘しました。
同じ細胞のトランスクリプトミクスとクロマチンアクセシビリティ解析は、ADニューロンおよびミクログリアにおける遺伝子発現の乱れを説明する可能性のある2つの転写因子、ZEB1およびMAFBを特定しました。
全体として、科学者たちはADにおけるsingle-cell病理学のより明確なイメージを得始めています。
また、一回限りの死後脳解析を超えた研究も進みました。
昨年、Alzforumでは、フィンランドのKuopioというところで行われている取り組みを特集しました。
そこでは、正常圧水頭症の症状の症状を緩和するため、毎週シャント術が行われますが、その時に切除した脳組織を、電気生理学、single-cell解析、ゲノミクス、空間トランスクリプトミクス、疾患モデリング、免疫染色、電子顕微鏡解析などに使います。
手術中及び術後に提供される、硬膜、脳室内CSF及び腰椎穿刺CSF、血液、皮膚、脂肪のサンプルは、このコホートにおいて前例のないデータ統合を可能にしています。
このコホートで、被検者のほぼ半数がAD病理を持ち、一部はADRDの突然変異を持っていました。
2023年、科学者たちは細胞の奥深くにまで掘り下げ、単一のシナプスでmRNAを分析する方法を開発し、アミロイドーシスのマウスモデルで、シナプス内で増加する炎症関連遺伝子と補体成分のトランスクリプトを特定しました。
集団レベルでは、昨年、異なるタウ病理学におけるsingle-cell解析の所見を比較する最初の研究も行われました。
ほとんどの場合、AD、行動変異型前頭側頭型認知症(bvFTD)、進行性核上性麻痺(PSP)では遺伝子発現が類似した変化だったようですが、ADではミクログリアの発現変化がより多く、bvFTDとPSPではニューロンとアストロサイトにより大きな変化がありました。
最後に、空間プロテオミクスの台頭について。技術的には複雑ですが、この最先端の方法で、色々な事が分かってきました。
Aβプラーク周辺のミクログリアのサブタイプや、タウ病理に抵抗性のあるニューロンの特定など。
また昨年は、Plasma Proteomics Projectからの最初の出版がありました。
このプロジェクトは、英国バイオバンクの50,000人以上の人々の遺伝的変異とプラズマプロテオームを照合しています。
この研究を後援する製薬会社は、新しいプラズママーカーや薬物標的を生み出すことを期待しています。
細胞生物学
APP, プレセニリン1、プレセニリン2に引き続き、2023年、SORL1が常染色体顕性遺伝ADの4番目の原因遺伝子と特定しました。
この遺伝子には500程の変異が見つかっており、タンパクのフォールディング、ダイマー形成、エンドソーム内でのトラフィッキングがおかしくなる変異は、ADのリスクを劇的に高めると言われています。
Alzforumのキュレーションチームは、この2,214アミノ酸の巨大分子上のすべての既知の変異をインターラクティブなマップにしました。
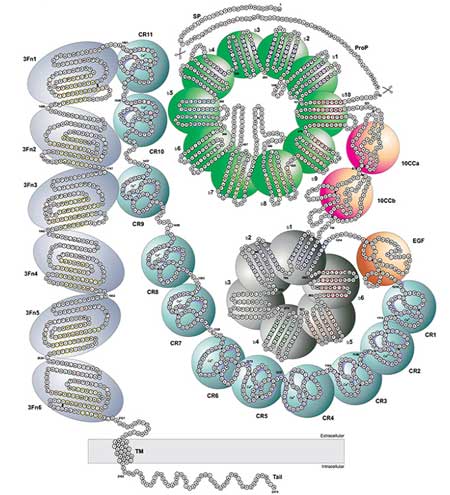
SORL1二量体がないと、APPを含んだリトロマーはエンドソーム内で動きが鈍くなり、Aβの生成が暴走します。
レトロマーはまた、リソソームのスムーズな運行を維持します。
SORL1がないと、これらのミニリサイクルプラントは、APPを含む消化されない貨物で膨らみます。
β-セクレターゼによって切断されたAPPのC末端フラグメントは、リソソームを酸性化するプロトンポンプをブロックし、さらにリソソームの機能を阻害することもわかりました。
全体として、2023年、エンドソーム-リソソーム-オートファジー系を通じた悪いリサイクルがADの病態に関わるという可能性が分かってきました。
役立つ可能性があるのは、オートファジーを遅らせるカルシウムを放出するRyanodine受容体を抑えることです。
また、AD細胞モデルで、成人の線維芽細胞から直接分化させたニューロンは、iPSCよりもAD脳のリソソーム機能不全をより適切に捉えるという報告もありました。
APOE
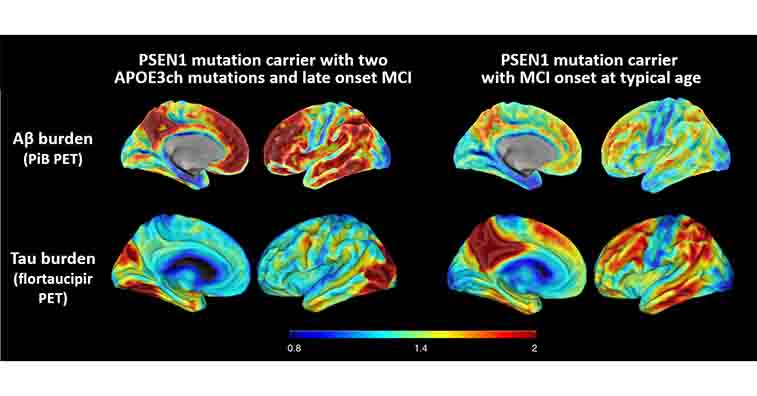
APOE4の悪者感は半端ないですが、2019年、APOE3のChristchurch変異のホモ接合体変異を持つ女性が、タウ病理から免れた、という報告がありました。
Presenilin1 E280A変異(PSEN1 E280A)は家族性アルツハイマー病(Familial Alzheimier's disease: FAD)の原因となる最も多い遺伝子変異である。 ハーバード大学のAr …
この女性はホモ接合体でしたが、ヘテロ接合体でも十分に効力を発揮するようです。
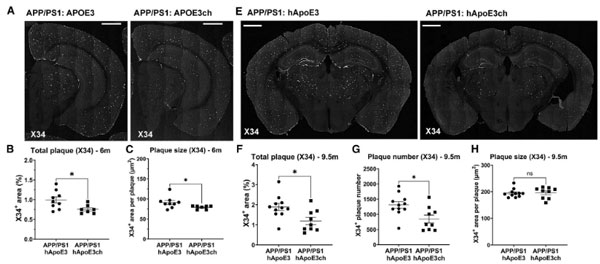
今年、2つの研究室から、このAPOE R136S変異についての研究報告がありました。
APOE3 R136Sは、APP/PS1とのかけあわせで、Aβやタウ病理を改善し、またAPOE4 R136S変異もまた、タウタングルやグリオーシス、神経変性を遅らせました。
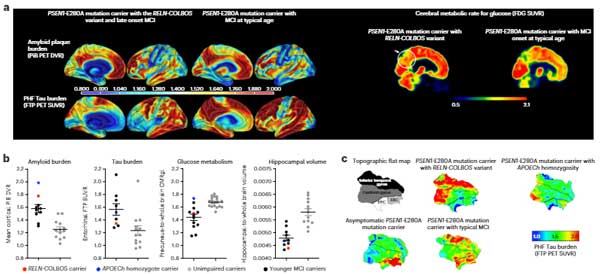
以前、PSEN1-E280A変異という強力な家族性アルツハイマー病(Alzheimer's disease, AD)の遺伝子変異を持ちながら、70歳まで認知症を発症しなかった、APOE3 R136S変異(Chistchu …
また、同じPS1変異の家系で、Reelin遺伝子のH3447R変異を持つ男性も、予想される症状発症後20年間認知症を避けました。ただ、彼がなぜ逃れることができたかはまだ明らかではありません。
以前、PSEN1-E280A変異という強力な家族性ADの遺伝子変異を持ちながら、70歳まで認知症を発症しなかった、APOE3 R136S変異(Chistchurch変異)の症例 [1] について取り上げましたが、 今回同 …
また、APOE4を持ちながら認知機能正常な79歳と90歳代の2人の男性の症例報告もありました。
彼らはAPOE3/4ですが、E4アレルにストップコドンを持っており、これが関係しているのではないかと考えられています。
この事象は、APOE4を減少させる事を治療ターゲットとしている研究者達にとって吉兆となるでしょう。
APOEの機能面としては、Aβプラークを除去するミクログリアとの関連が報告されています。
細胞接着因子のVCAM1を発現するグリアはAPOEを感知して、疾患関連フェのタイプへと変貌します。アポリポプロテインはAβプラークのシードになるかAβプラークの安定化につながるかと考えられていましたが、この研究によって、逆の現象の可能性が示唆されました。
だたし、APOE4に関してはそうではないようです。別の研究では、APOE4がミクログリアを非活性化状態にして、Aβプラークとタウタングルが妨げる事なく成長することを示唆しました。
同様に、APOE4を発現するニューロンは病理を悪化させますが、ニューロン特異的にAPOE4を欠失すると、タウモデルにおけるタウ病理、アストログリオーシス、ミクログリオーシス、神経変性が抑制される、という報告がありました。
また、APOE4は血管障害も悪くしますが、この現象に血管周囲マクロファージが関わっているという事も、去年んおADPDカンファレンスで報告されました。
・
・
・
どのニュースも、逃しちゃいけないモノばかりな感じで、去年は忙しかったですね。
今年も続々と報告があると思いますので、私も気がけていきたいと思います。