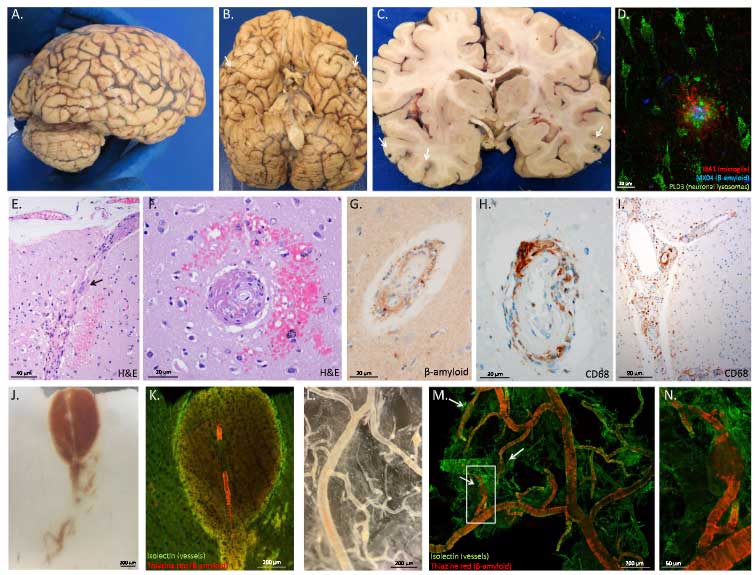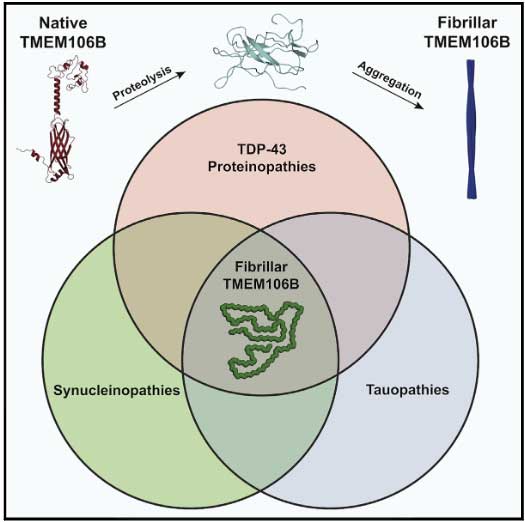
先日、TMEM106Bに関する驚きの論文がCellに1報、Natureに2報掲載されました。
Cellの論文は、アメリカ・コロンビア大学のDr.Fitzpatric、カナダ・英コロンビア大学のDr.Mackenzieらの研究グループからで、FTLD-TDP, PSP, DLBの患者さんの脳内でTMEM106Bの凝集体があることをcryo-EMとMSの解析から明らかになった、というもの [1]。
Cryo-EM structures of brain-derived TMEM106B fibrils from neurodegenerative diseases • Endolysosomal membrane protein TMEM106B C-terminal fragment forms amyloid fibrils • TMEM106B fibrillization is widespread among diverse neurodegenerative proteinopathies • Identification of fibrillization pathway potentially implicated in neurodegeneration
Natureの1報は、イギリス・MRC研究所のDr. Goedert、Dr. Scheresらの研究グループからで、色々な神経変性疾患の他、健常高齢者の脳内でもTMEM106Bの凝集体が観察された、というcryo-EMでの解析 [2]。
Many age-dependent neurodegenerative diseases, like Alzheimer’s and Parkinson’s, are characterised by abundant inclusions of amyloid filaments. Filamentous inclusions of the proteins tau, amyloid-β (Aβ), α-synuclein and TDP-43 are the most common1,2. Here, we used electron cryo-microscopy (cryo-EM) structure determination to show that residues 120-254 of the lysosomal type II transmembrane protein 106B (TMEM106B) also form amyloid filaments in human brains. We determined the cryo-EM structures of TMEM106B filaments from a number of brain regions of 22 individuals with abundant amyloid deposits, including sporadic and inherited tauopathies, Aβ-amyloidoses, synucleinopathies and TDP-43 proteinopathies, as well as from the frontal cortex of 3 neurologically normal individuals with no or only few amyloid deposits. We observed three TMEM106B folds, with no clear relationships between folds and diseases. TMEM106B filaments correlated with the presence of a 29 kDa sarkosyl-insoluble fragment and globular cytoplasmic inclusions, as detected by an antibody specific for the C-terminal region of TMEM106B. The identification of TMEM106B filaments in the brains of older, but not younger, neurologically normal individuals indicates that they form in an age-dependent manner.
もう1報は、アメリカ・UCLAのDr. Eisenbergらの研究グループからで、同じくcryo-EMでFTLD-TDPの脳内にTMEM106Bの凝集体が観察され、FTLD-TDPのアミロイドフィブリルの構成タンパクはTDP-43じゃないくてほとんどTMEM106Bだった、という内容の論文 [2] 。
Frontotemporal lobar degeneration (FTLD) is the third most common neurodegenerative condition, following only Alzheimer’s and Parkinson’s diseases1. FTLD typically presents in 45-64-year-olds with behavioral changes or progressive decline of language skills2. The subtype FTLD-TDP is characterized by certain clinical symptoms and pathological neuronal inclusions detected by TAR DNA-binding protein (TDP-43) immunoreactivity3. Here, we extracted amyloid fibrils from brains of four patients, representing four out of five FTLD-TDP subclasses and determined their near-atomic resolution structures by cryogenic electron-microscopy (cryo-EM). Unexpectedly, all amyloid fibrils examined are composed of a 135-residue C-terminal fragment of transmembrane protein 106B (TMEM106B), a lysosomal membrane protein previously implicated as a genetic risk factor for FTLD-TDP4. In addition to TMEM106B fibrils, abundant non-fibrillar aggregated TDP-43 is present, as revealed by immunogold labeling. Our observations confirm that FTLD-TDP is an amyloid-involved disease and suggest that amyloid involvement in FTLD-TDP is of protein TMEM106B, rather than of TDP-43.
全て注目度MAXの内容でしたが、特にUCLAからの報告はタイトルを見た瞬間に「え!?どーゆーこと!?」と思わず口走ってしまいました。
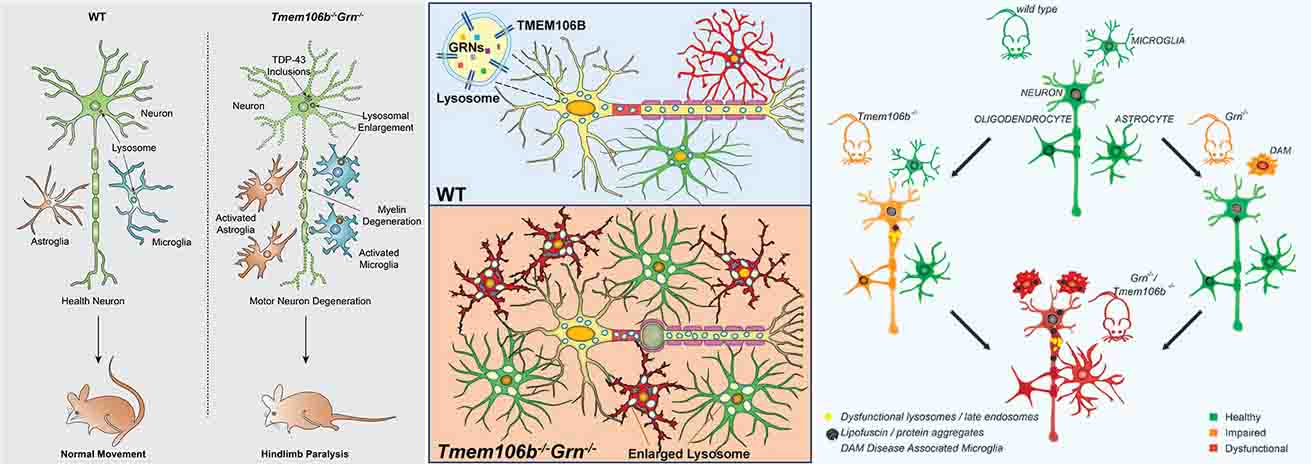
TMEM106Bは、274aaのII型膜貫通型蛋白で、生理状態下では神経・グリア・内皮細胞・ペリサイトなどのリソソームとエンドソームの膜に存在しています。
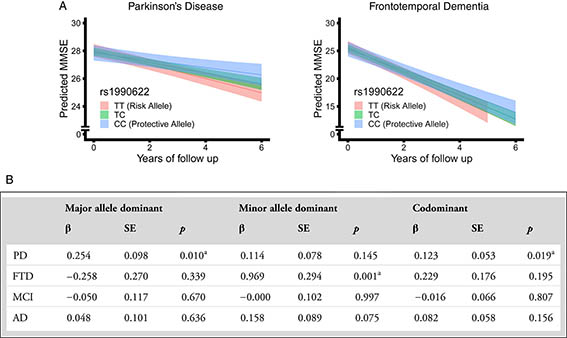
変性疾患との関係については私も何度かこのブログで取り上げましたが、
以前は全く別の疾患と考えられていたものが、共通のリスク因子や病理を持つことが多いという認識が広まり、神経変性疾患の枠組みも大きく変わってきていると感じます。 今回の論文は、frontotemporal lobar deg …
今回は、前頭側頭葉変性症(Frontotemporal lobar degeneration, FTLD)の約半数を占める 「TDP43凝集体を伴うFTLD(FTLD-TDP)」 …に深く関与する、 Progranuli …
今までは、FTD/ALS、LATE、Hippocampal sclerosisなど、TDP-43プロテイノパチーのリスク遺伝子で、疾患のモジュレーターとして考えられていたと思います。
それが今回の3報では、TEME106B自体が人の脳内で凝集体を形成して沈着していることがわかり、今後もしその重要性が明らかになってくれば、「TMEM106Bプロテイノパチー」のような概念が生まれる可能性も出てきたわけです。
しかもUCLAからの論文に関しては、TDP-43よりも重要っぽい事を言っていてかなり挑発的なので、この研究をしている人達の間では色々と物議を醸しているんじゃないかと思います。
とゆーことで、3報続けて読んだのですが、今回はまずCellの論文から。

TMEM06B凝集体が、FTLD-TDP, PSP, DLB脳内で観察
剖検脳から、不溶性蛋白分画を抽出
彼らは、色々な剖検脳の不要性蛋白分画を抽出し、cryo-EMで観察しました。
すると、下記症例で同じような凝集体が観察されました。
- FTLD-TDP
- TypeA
- GRN変異: 4例
- 孤発性: 1例
- TypeB: 2例
- TypeC: 2例
- TypeA
- PSP: 2例
- DLB: 1例
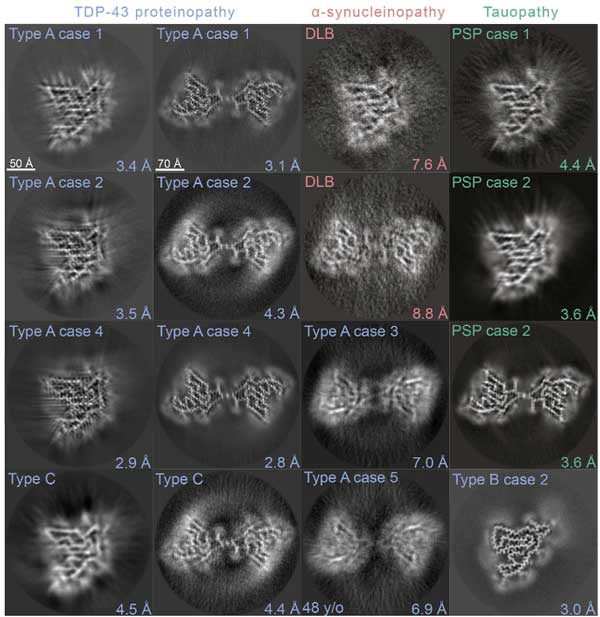
凝集体の種類は2種類あり、それぞれ下記のように命名しました。
- 広く2つに折りたたまれた左右対称のリボン状のフィブリルで、"doublet" fibrils と命名
- 狭くねじれた桿状のフィブリルで、"singlet" fibrils と命名
質量分析でTMEM106Bと断定
これらのフィブリルを質量分析法 (mass spectrometry, MS)にかけて、600種類の候補の中から、cryoIDやfindMySequenceなどのソフトウェアを使って解析した結果、フィブリルの招待はTMEM106Bの120-254aa部分であることが判明しました。
doubletフィブリルは、2つのTMEM(120-254)がそれぞれK178とR180の側鎖部分で対になっており、接合部は蛋白ではない陰性荷電のコファクターでつながっているようでした。
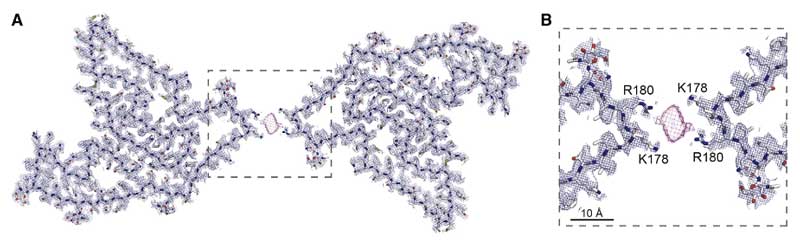
このTEME106B(120-254)のプロトフィラメントコアは、TMEM106Bの内腔ドメインで、細胞質ドメインのN-terminal部分は切断されている事になります。
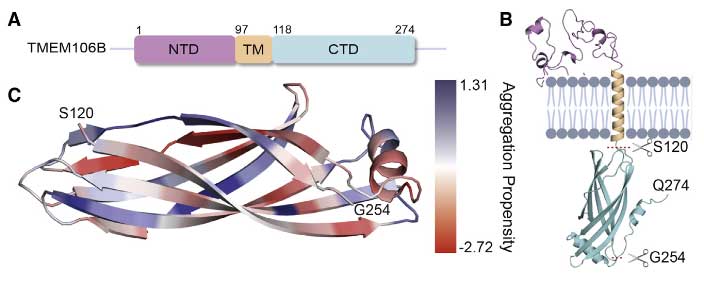
全部で19のβシート構造があり、ショートループを形成していました。
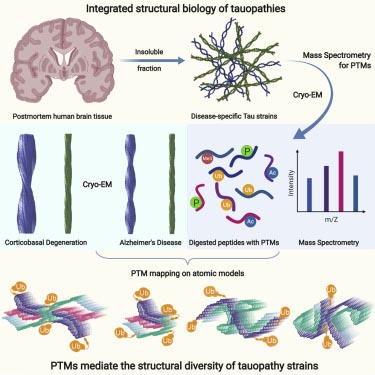
TMEM106Bの翻訳後修飾がフィブリルの構造に及ぼす影響
彼らは以前にも翻訳後修飾(post-translational modification, PTM)がフィラメントの構造に及ぼす影響について報告していましたが [4]、
タウオパチーとして分類される疾患(Alzhiemer's disease, AD; Pick's disease, PiD; CBD; Progressive supranuclear palsy, PSP; Chron …
今回も、PTMがこのTMEM106Bアミロイドフィブリルの構造に及ぼす影響について考えました。
ネイティブのTMEM106Bは6つのN-glycosylation siteがあり、全て内腔ドメインに存在しています。
彼らはそのうち
- N183
- N164
- N151
- 1N145
でN-glycosylationが保たれていることを確認しました。
TMEM106B(182-185)の構造は、疾患多型のT185Sとも関係しているので非常に興味深く、
T185のリン酸化はN183のグリコシル化を決めると報告されており [5] 、この部分は複数の糖鎖が負荷されているようでした。
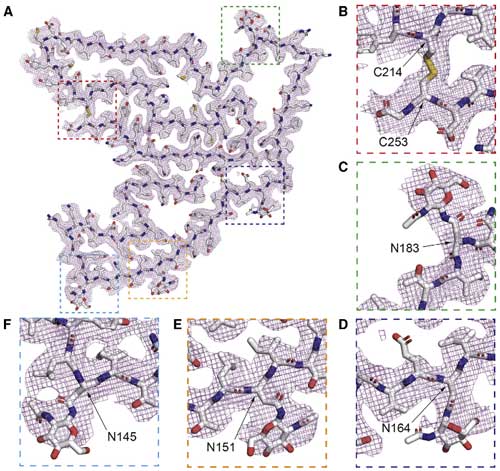
TMTM106B(120-254)フィブリルは、リスク多型のT185、プロテクティブ多型のS185ハプロタイプに関係なく存在しているようでした。
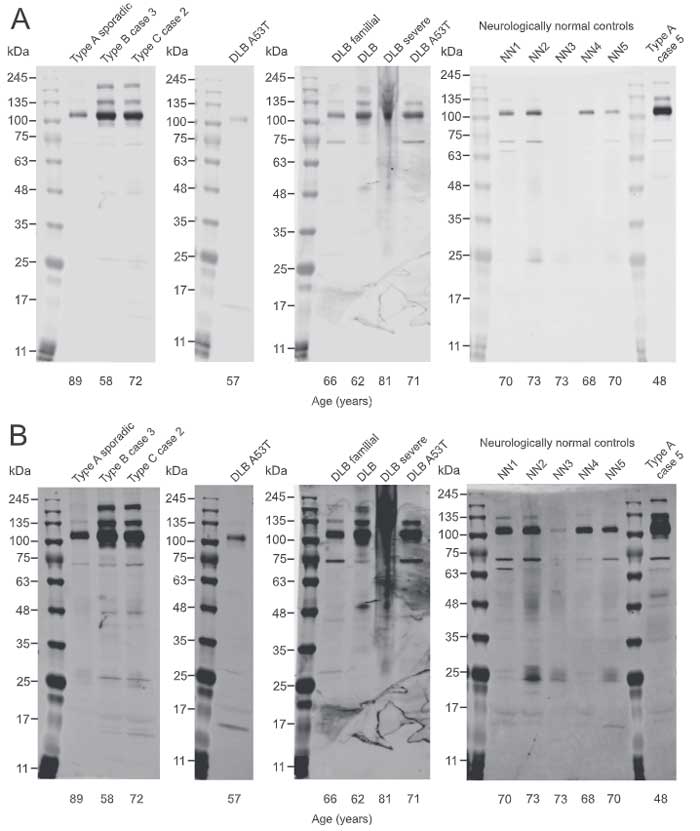
TMEM106B抗体で検証
この論文が出た時点では、世の中にTMEM106Bフィブリルの良い抗体がなかったのですが、著者らは頑張って、TMEM106BのC末抗体(204-253)でウェスタンブロット(WB)をしてみました。
- 健常人5人(68-73yo)
- FTLD-TDP TypeA
- FTLD-TDP TypeB
- FTLD-TDP TypeC
- シヌクレイノパチー5人
の脳をTMEM106BのC末抗体でWBしたところ、
- TMEM106Bモノマー(~16kDa)
- グリコシル化TMEM106B(~25kDa)
- TMEM106Bオリゴマー(110kDa, 135kDa, 190kDa)
と思われるバンドが確認され、高分子バンドは神経変性疾患脳でより多く認められました。
・
・
・
以上の結果から
「TDP-43プロテイノパチー、タウオパチー、シヌクレイノパチーなど、様々な変性疾患でTMEM106Bの凝集体が存在している」
という事が明らかとなりました。

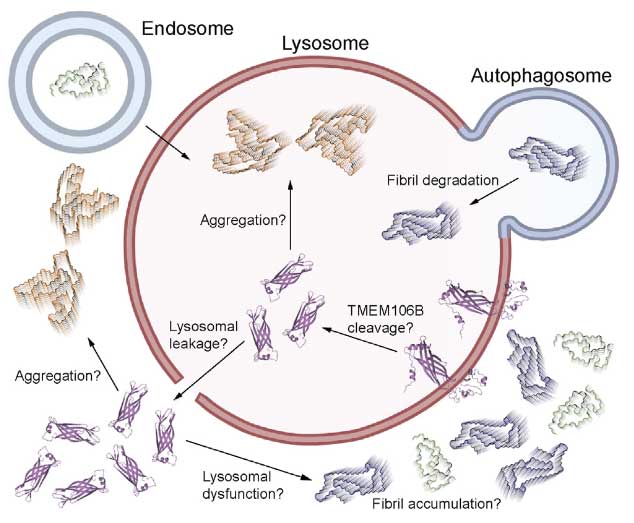
TMEM106Bはもともとリソソームの膜蛋白なので、リソソーム内でC末が切れてリソソーム膜を障害し、リソソーム内や細胞質でsinglet fibrilsとして蓄積したり、doublet fibrilsとして凝集したりする可能性が考えられました。
Cryo-EM structures of brain-derived TMEM106B fibrils from neurodegenerative diseases • Endolysosomal membrane protein TMEM106B C-terminal fragment forms amyloid fibrils • TMEM106B fibrillization is widespread among diverse neurodegenerative proteinopathies • Identification of fibrillization pathway potentially implicated in neurodegeneration
References
- Chang A, Xiang X, Wang J, Lee C, Arakhamia T, Simjanoska M, Wang C, Carlomagno Y, Zhang G, Dhingra S, Thierry M, Perneel J, Heeman B, Forgrave LM, DeTure M, DeMarco ML, Cook CN, Rademakers R, Dickson DW, Petrucelli L, Stowell MHB, Mackenzie IRA, Fitzpatrick AWP. Homotypic fibrillization of TMEM106B across diverse neurodegenerative diseases. Cell. 2022 Mar 1:S0092-8674(22)00259-8. doi: 10.1016/j.cell.2022.02.026. Epub ahead of print. PMID: 35247328.
- Schweighauser M, Arseni D, Bacioglu M, Huang M, Lövestam S, Shi Y, Yang Y, Zhang W, Kotecha A, Garringer HJ, Vidal R, Hallinan GI, Newell KL, Tarutani A, Murayama S, Miyazaki M, Saito Y, Yoshida M, Hasegawa K, Lashley T, Revesz T, Kovacs GG, van Swieten J, Takao M, Hasegawa M, Ghetti B, Spillantini MG, Ryskeldi-Falcon B, Murzin AG, Goedert M, Scheres SHW. Age-dependent formation of TMEM106B amyloid filaments in human brains. Nature. 2022 Mar 28. doi: 10.1038/s41586-022-04650-z. Epub ahead of print. PMID: 35344985.
- Jiang YX, Cao Q, Sawaya MR, Abskharon R, Ge P, DeTure M, Dickson DW, Fu JY, Ogorzalek Loo RR, Loo JA, Eisenberg DS. Amyloid fibrils in disease FTLD-TDP are composed of TMEM106B not TDP-43. Nature. 2022 Mar 28. doi: 10.1038/s41586-022-04670-9. Epub ahead of print. PMID: 35344984.
- Arakhamia T, Lee CE, Carlomagno Y, Duong DM, Kundinger SR, Wang K, Williams D, DeTure M, Dickson DW, Cook CN, Seyfried NT, Petrucelli L, Fitzpatrick AWP. Posttranslational Modifications Mediate the Structural Diversity of Tauopathy Strains. Cell. 2020 Feb 20;180(4):633-644.e12. doi: 10.1016/j.cell.2020.01.027. Epub 2020 Feb 6. Erratum in: Cell. 2021 Dec 9;184(25):6207-6210. PMID: 32032505; PMCID: PMC7491959.
- Nicholson AM, Finch NA, Wojtas A, Baker MC, Perkerson RB 3rd, Castanedes-Casey M, Rousseau L, Benussi L, Binetti G, Ghidoni R, Hsiung GY, Mackenzie IR, Finger E, Boeve BF, Ertekin-Taner N, Graff-Radford NR, Dickson DW, Rademakers R. TMEM106B p.T185S regulates TMEM106B protein levels: implications for frontotemporal dementia. J Neurochem. 2013 Sep;126(6):781-91. doi: 10.1111/jnc.12329. Epub 2013 Jul 1. PMID: 23742080; PMCID: PMC3766501.