αシヌクレイン(α-synuclein, α-syn)は、パーキンソン病、レビィ小体型認知症、多系統萎縮症など、シヌクレイノパチーの主要病理タンパクとして研究が進められており、
α-syn凝集体の多様性が疾患や病理の多様性を生んでいる、という考えが主流となっています。
α-synは、タウetc.と違って、ただ振盪させているだけでモノマーが勝手に凝集していくのですが、
今までは、その時のバッファーの組成が異なると、違う構造&性質のα-syn凝集体ができる、ということが報告されていました [1, 2]。
今回、フランス・CNRSのDr. Ichasらの研究グループは、バッファーの組成等を全く同じ条件にしても、構造と性質の異なるフィブリルができあがる、という事を報告しました [3]。
αシヌクレイン凝集形成の多様性について真面目に検証
ヒトα-synモノマーのバッチを7つに分注し、1つは4℃で、残りの6つは37℃で振盪させ、フィブリルを作製した。
チオフラビンT(ThT)で確認すると、7つ全てのaliquotで、異なるThT結合能を示した。
この中から、
- 最もThT結合能の高かったIso1
- 最もThT結合能の低かったIso3
を、それぞれプライマリーニューロンに形質導入した。
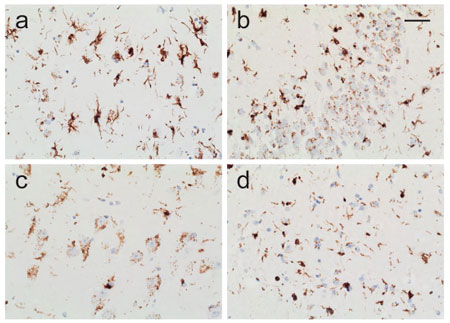
すると、Iso1ではほとんど細胞内凝集体を形成しないのに対して、Iso3では高い細胞内凝集体能を示した。
ただし、ソニケーション後産物は、Iso1の方でより小さなフィブリン断片が得られていた。
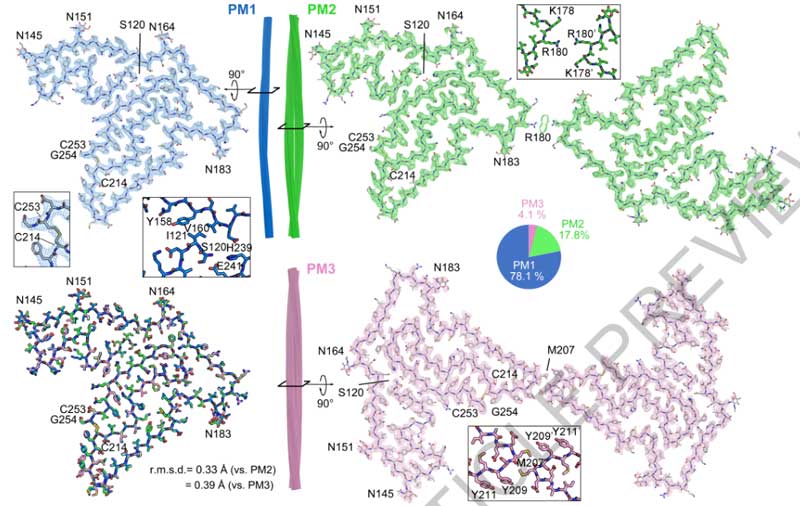
全く同じ条件で作製したフィブリルが、異なるThT結合能や細胞内凝集体系性能を示すメカニズムについて調べるため、彼らはさらに電顕やNMRで解析した。
すると、Iso1とIso3は異なる構造のフィブリルになっていることがわかった。
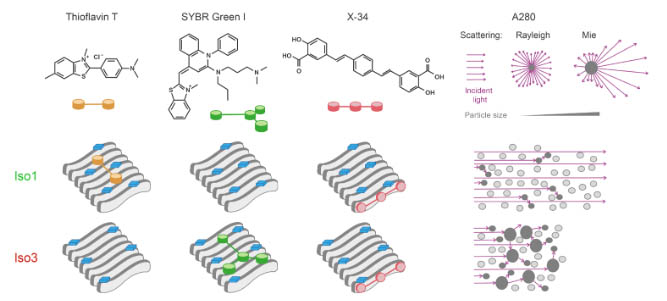
さらに、Iso3はThTの結合能が弱かったが、コンゴーレッド誘導体のX-34で同様に検証すると、Iso1と同等のX-34結合能を示した。
他にも簡便に違いを見分けられないかといろいろ探し、ThTと同じアミロイド結合サイトを持つSYBR Green I(SG)を試したところ、Iso3は強いSG結合能を示した。
| ThT | SG | X-34 | A280 | |
| 食塩水 | - | ± | ± | - |
| 4℃モノマー | - | ± | ± | + |
| Iso1 | +++ | + | ++ | + |
| Iso3 | + | +++ | ++ | ++ |
さらにこれらのフィブリルをモノマーで継代したところ、こららの異なる構造/性質は、継代後も引き継がれていた。
My View
うちのラボのシヌクレインチームは、もう何年もシヌクレインの増幅等を行って実験しているのですが、
作製したシヌクレイン凝集体の再現性がとれないことが多く、
担当しているポスドクは、
「同じソニケーターで粉砕して、同じ振盪機、同じ周波数、同じ温度、同じ時間振盪させても、違う性質のフィブリルができあがるんだ。」
と嘆いていました。
多分みんな経験的にわかっていた事じゃないかと思うのですが、今回の論文ではその現象について、真面目にしっかりと検証していて偉いな-、と思いました。
あまり一般向けの内容ではないですが、このような論文は、同様の実験をしている人達にとってはありがたい研究だと思います。
そして、今まで報告されてきた内容も、
「たまたま凝集能や伝播能が異なるフィブリルを使って、違う結果がでていた」
という現象も少なからず隠れている可能性があるんじゃないかなーと思います。
「じゃあどうすればいいの?」
という疑問に対しては、ちょっと答えが難しいですね。
同じラボ内だったら、
「モノマーを大量にフィブリル化して分注してずっと使う」
という事が可能ですが、
異なる研究施設で異なる実験結果がでる事については、
「どこかの施設で一斉につくって各施設に配る」
というような方法以外に、今のところ解決策はないような…
まあ、それでもサンプル量には際限があるし、ある程度はしょうがないのかな。
もう少し研究が進んで、
「必ず再現性のとれるフィブリル化の方法」
というのがわかるようになるといいですね。
References
- Bousset, L., Pieri, L., Ruiz-Arlandis, G. et al. Structural and functional characterization of two alpha-synuclein strains. Nat Commun 4, 2575 (2013). https://doi.org/10.1038/ncomms3575
- Peelaerts, W., Bousset, L., Van der Perren, A. et al. α-Synuclein strains cause distinct synucleinopathies after local and systemic administration. Nature 522, 340–344 (2015). https://doi.org/10.1038/nature14547
- De Giorgi F, Laferrière F, Zinghirino F, Faggiani E, Lends A, Bertoni M, Yu X, Grélard A, Morvan E, Habenstein B, Dutheil N, Doudnikoff E, Daniel J, Claverol S, Qin C, Loquet A, Bezard E, Ichas F. Novel self-replicating α-synuclein polymorphs that escape ThT monitoring can spontaneously emerge and acutely spread in neurons. Sci Adv. 2020 Oct 2;6(40):eabc4364. doi: 10.1126/sciadv.abc4364. PMID:33008896.