パーキンソン病 (Parkinson's disease, PD) はその多くが孤発性ですが、10%程度に遺伝性で発症する家族性PDがあります [1]。
その中で、主要病理蛋白であるα-シヌクレイン (α-synuclein, α-syn) をコードするSNCA遺伝子のコピー数が2倍体 [2]、3倍体 [3] と、α-synの発現量が増えることで家族性PD(PARK4)を発症することが知られており、α-synの発現量を減らすことはPDの一つの治療ターゲットとなり得ると考えられています。
今回、米国UFスクリプス研究所(The Herbert Wertheim UF Scripps Institute for Biomedical Innovation & Technology)のDr. Disneyらの研究グループは、α-synのmRNAに結合してα-synの翻訳を阻害する化合物、およびmRNAを分解する化合物を開発し、α-synの量を減らす試みを行いました [4]。

α-シヌクレインを減らしてパーキンソン病を防ぐ
α-syn mNRAに結合してα-synの翻訳を抑制する低分子化合物の開発
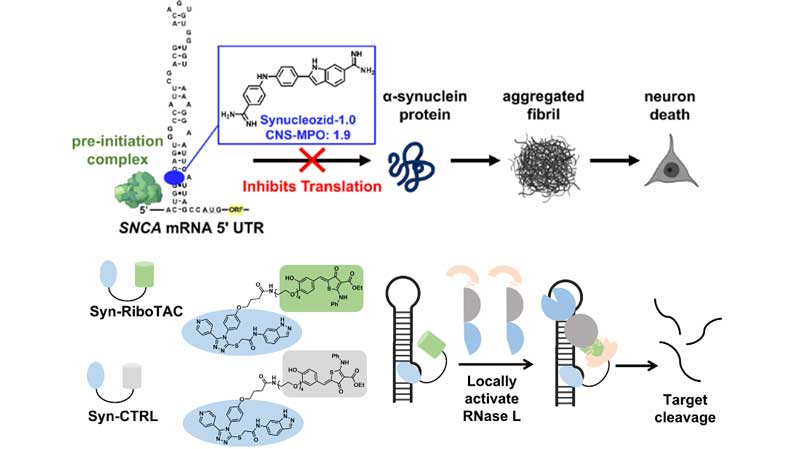
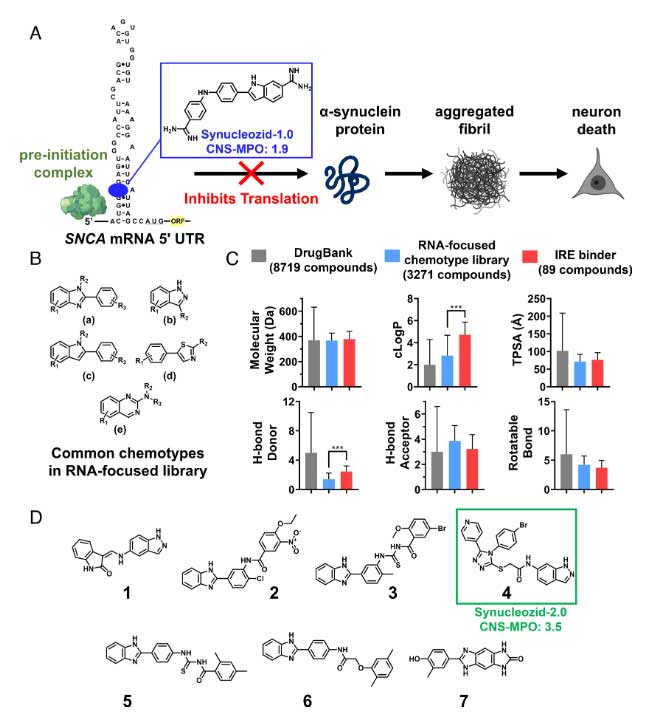
彼らは以前、α-syn mRNAの5'UTRに存在する、鉄反応性エレメント(iron-responsive element, IRE)をターゲットに結合する低分子化合物「Synucleozid-1.0」を開発していました [5]。
この化合物はSNCA IREに結合しα-synの翻訳を阻害しますが、BBB透過性が弱く、治療薬として使いにくいという難点がありました。
今回はそれを改良し、BBBを通過し、mRNAに結合する低分子化合物「Synucleozid-2.0」を開発しました。
Synucleozid-2.0は、α-syn凝集体の細胞毒性を防ぐ
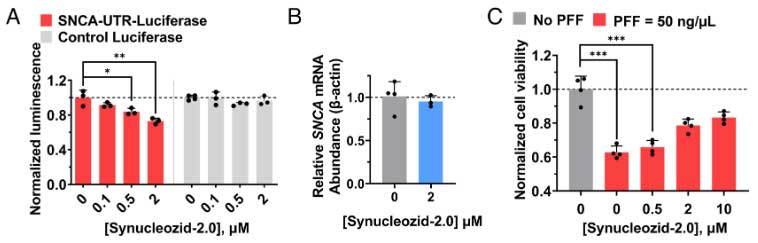
α-synの凝集体(α-syn-PFF)は細胞毒性を持ちますが、Synucleozid-2.0はこの作用を濃度依存的にブロックしました。
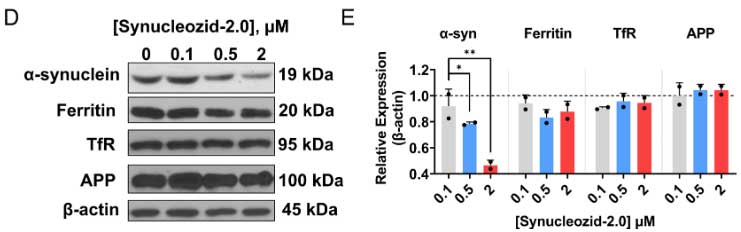
Synucleozid-2.0は、SNCAのIREにしか反応しない
IREをもつ遺伝子はたくさんあるので、彼らは5’UTRにIREを持つ遺伝子として、フェリチンとアミロイド前駆蛋白 (Amyloid precursor protein, APP) 、3’UTRにIREを持つ遺伝子としてトランスフェリン受容体(transferrin receptor, TfR)へのSynucleozid-2.0の反応を調べました。
すると、Synucleiozid-2.0は、フェリチン、APP、TfRには反応せず、α-synの翻訳のみ選択的に阻害することがわかりました。
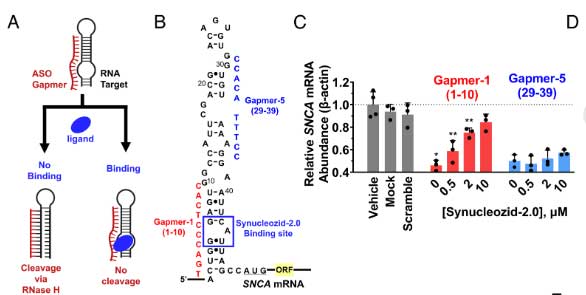
Synucleozid-2.0は、SNCA IRE A bulge部分に結合する
Synucleozid-2.0がSNCA mRNAのどこに結合するのか、2つの系で確認しました。
ASOを使った系「ASO-Bind-Map」
ASOはmRNAに結合して標的mRNAを切断しますが、Synucleozid-2.0が結合しているとその部位にハイブリダイズできず、mRNAを切断できなくなります。
この現象を利用して、彼らはSNCA mRNAの特定の場所にハイブリダイズするアンチセンスオリゴヌクレオチド(antisense oligonucleotide, ASO)を複数作製し、Synucleozid-2.0とASO処置下でのα-synのmRNA量を調べました(ASO-Bind-Map)。
すると、Synucleozid-2.0は、SNCA IREのA bulge部分に結合することがわかりました。
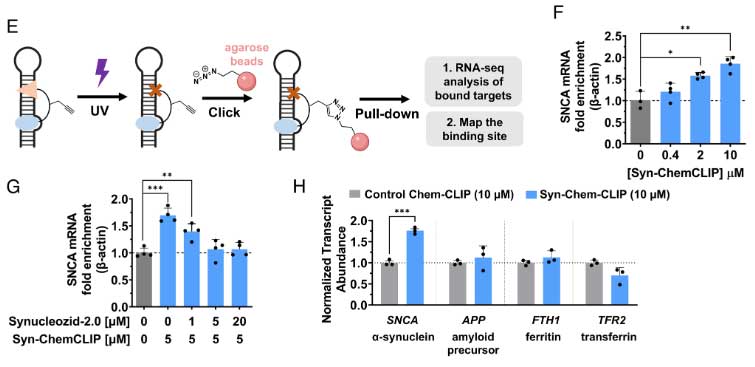
Chemical Cross-Linking and Isolation by Pull-down (Chem-CLIP)法
もう一つの系はChem-CLIP法で、Synucleozid-2.0に光感受性ダイアジリングループとアルキンハンドルをつけ、紫外線照射します。
すると、ダイアジリングループが活性化され、近接する標的分子と共有結合します。
共有結合したプローブは、アルキンハンドルを使ってビーズでプルダウンし、結合したmRNAの量を測定します。
SNCA IRE A buldge部分に結合するSyn-ChemCLIPを作製し、Synucleozid-2.0の容量を変えてSHSY-5Y細胞に同時に処置すると、Synucleozid-2.0は、Syn-ChemCLIPの結合を濃度依存的に阻害しました。
このことから、Synucleozid-2.0は、やっぱりSNCA IRE A buldgeの部分に結合することがわかりました。
Synucleozid-2.0は、SNCA mRNAへのリボソームの結合を阻害し、翻訳を抑制する
Synucleozid-2.0がα-synの発現を抑制するメカニズムを調べるため、彼らはいくつかの実験を行いました。
結果、Synucleozid-2.0は、SNCA mRNAの5’UTRに結合し、安定化してunfoldingを防ぐことで、リボソームが結合しにくくなり、翻訳を抑制することがわかりました。
SNCA mRNAを選択的に切断する化合物「Syn-RiboTAC」
mRNAに結合する低分子化合物の効力を高めるため、彼らは「RiboTAC [6]」に注目しました。
RiboTACは、結合したmRNAを選択的に切断する機能を持ちます [6,7]。
彼らはSynucleozid-2.0をRiboTACにくっつけ、SNCA mRNAを選択的に切断する「Syn-RiboTAC」を合成しました。
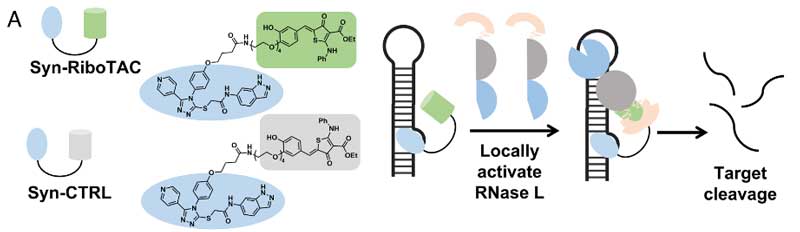
Syn-RiboTACは、濃度依存的にmRNAを選択的に切断しました。
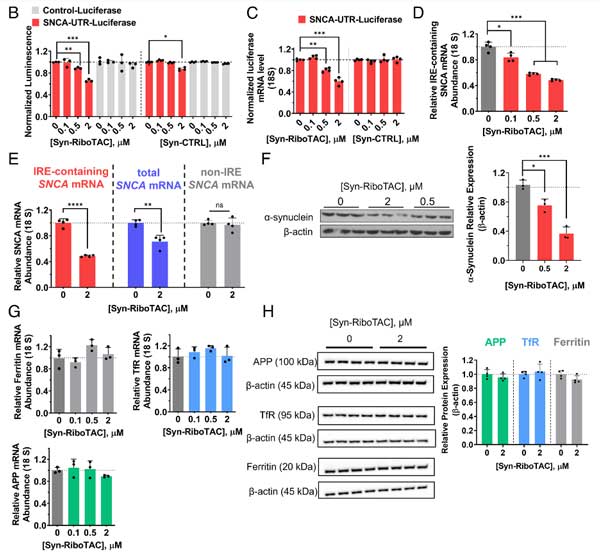
ヒトiPS細胞由来のドパミン神経細胞で検証
彼らは、SNCA triplicationの患者由来と健常人由来の人口多能性幹細胞(Induced pluripotent stem細胞, iPS細胞)をドパミン神経細胞に分化させ、それぞれSynucleozid-2.0とSyn-RiboTACの効果を調べました。
SNCA triplicationの患者由来のドパミン神経はα-syn量が健常人の2倍になっていましたが、Synucleozid-2.0もSyn-RiboTACも両方ともα-synの量を半分程度にまで減らしました。
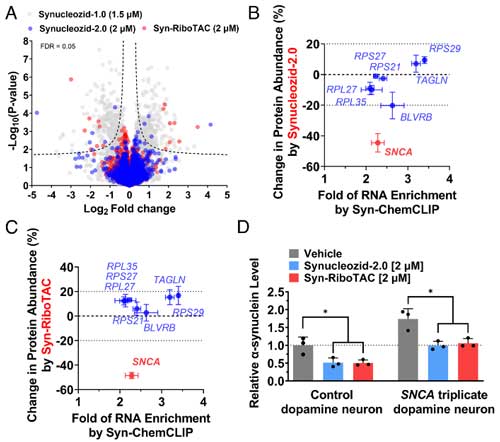
作業仮説の通り、Synucleozid-2.0はSNCA mRNA量には変化がなく、Syn-RiboTACはSYNCA mRAN量も減少させました。
また、その他の変化している遺伝子も、Ryn-RiboTAC処置によって、半分程度が健常人と同じプロファイルに近づいていました。
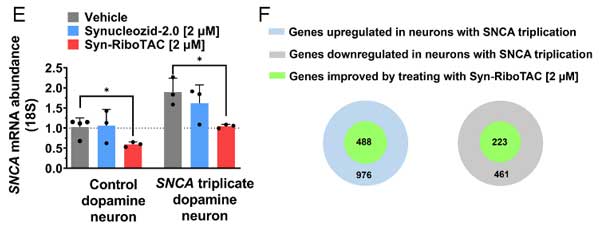
以上の結果から、Synucleozid-2.0とSyn-RiboTACは、神経細胞内のα-syn量を減らし、PDの予防・治療に有用である可能性が示唆されました。
Tong Y, Zhang P, Yang X, Liu X, Zhang J, Grudniewska M, Jung I, Abegg D, Liu J, Childs-Disney JL, Gibaut QMR, Haniff HS, Adibekian A, Mouradian MM, Disney MD. Decreasing the intrinsically disordered protein α-synuclein levels by targeting its structured mRNA with a ribonuclease-targeting chimera. Proc Natl Acad Sci U S A. 2024 Jan 9;121(2):e2306682120. doi: 10.1073/pnas.2306682120. Epub 2024 Jan 5. PMID: 38181056; PMCID: PMC10786272.
My View
私は以前、α-synの発現量を減らす薬剤スクリーニングのプロジェクトに関わったことがあり、α-synの転写を阻害する低分子化合物の候補が見つかりました。
そのプロジェクトは私の力不足で形にすることはできませんでしたが、目的は、今回の論文と同じだと思います。
α-synは、その凝集体が脳内を伝播し、内因性のα-synを凝集化させて病態を広げていくと言われていますが、α-synノックアウトマウスにはα-syn凝集体を接種しても広がりません [8]。
つまり、前述のSNCA Duplication/Tripricationのような特殊な家系でなくても、α-synの量を減らす事で孤発性のPDの病態抑制につながる可能性がある、と思います。
ただ、このような試みはこれまでも多くの施設で取り組まれてきたと思いますが、現時点ではヒトの臨床治験で良いところまでいった、という話を聞きません。
まず、α-synを半分にして本当に大丈夫か、とか、PDに効くとしてどのくらい早期段階でリクルートすべきかなど、色々と乗り越えるべき課題があるように思います。
何とかこれらの障壁を乗り越えて、治療薬に結びついてほしいです……。
Glossary
鉄反応性エレメント(iron-responsive element, IRE)
IREは、主に鉄代謝に関わる、mRNAの非翻訳領域に存在するヘアピン構造で、IREに iron regulatory protein等が結合し、遺伝子の翻訳を調節する。
IREは5’UTR側と3’UTR側のどちらかに存在するが、それぞれ逆の働きがある。
5’UTR側に結合した場合、そのmRNAのリボソームへの結合が阻害され、mRNAが存在してもタンパクの翻訳されず、その発現が抑制される。
一方、3'UTR側のIREに結合した場合は、mRNAのエンドヌクレアーゼによる切断を免れて安定化して翻訳量は増加し、発現が亢進する [9,10] 。
References
- Vasquez V, Mitra J, Wang H, Hegde PM, Rao KS, Hegde ML. A multi-faceted genotoxic network of alpha-synuclein in the nucleus and mitochondria of dopaminergic neurons in Parkinson's disease: Emerging concepts and challenges. Prog Neurobiol. 2020 Feb;185:101729. doi: 10.1016/j.pneurobio.2019.101729. Epub 2019 Dec 18. PMID: 31863801; PMCID: PMC7098698.
- Ibáñez P, Bonnet AM, Débarges B, Lohmann E, Tison F, Pollak P, Agid Y, Dürr A, Brice A. Causal relation between alpha-synuclein gene duplication and familial Parkinson's disease. Lancet. 2004 Sep 25-Oct 1;364(9440):1169-71. doi: 10.1016/S0140-6736(04)17104-3. PMID: 15451225.
- Singleton AB, Farrer M, Johnson J, Singleton A, Hague S, Kachergus J, Hulihan M, Peuralinna T, Dutra A, Nussbaum R, Lincoln S, Crawley A, Hanson M, Maraganore D, Adler C, Cookson MR, Muenter M, Baptista M, Miller D, Blancato J, Hardy J, Gwinn-Hardy K. alpha-Synuclein locus triplication causes Parkinson's disease. Science. 2003 Oct 31;302(5646):841. doi: 10.1126/science.1090278. PMID: 14593171.
- Tong Y, Zhang P, Yang X, Liu X, Zhang J, Grudniewska M, Jung I, Abegg D, Liu J, Childs-Disney JL, Gibaut QMR, Haniff HS, Adibekian A, Mouradian MM, Disney MD. Decreasing the intrinsically disordered protein α-synuclein levels by targeting its structured mRNA with a ribonuclease-targeting chimera. Proc Natl Acad Sci U S A. 2024 Jan 9;121(2):e2306682120. doi: 10.1073/pnas.2306682120. Epub 2024 Jan 5. PMID: 38181056.
- Zhang P, Park HJ, Zhang J, Junn E, Andrews RJ, Velagapudi SP, Abegg D, Vishnu K, Costales MG, Childs-Disney JL, Adibekian A, Moss WN, Mouradian MM, Disney MD. Translation of the intrinsically disordered protein α-synuclein is inhibited by a small molecule targeting its structured mRNA. Proc Natl Acad Sci U S A. 2020 Jan 21;117(3):1457-1467. doi: 10.1073/pnas.1905057117. Epub 2020 Jan 3. PMID: 31900363; PMCID: PMC6983430.
- Costales MG, Aikawa H, Li Y, Childs-Disney JL, Abegg D, Hoch DG, Pradeep Velagapudi S, Nakai Y, Khan T, Wang KW, Yildirim I, Adibekian A, Wang ET, Disney MD. Small-molecule targeted recruitment of a nuclease to cleave an oncogenic RNA in a mouse model of metastatic cancer. Proc Natl Acad Sci U S A. 2020 Feb 4;117(5):2406-2411. doi: 10.1073/pnas.1914286117. Epub 2020 Jan 21. Erratum in: Proc Natl Acad Sci U S A. 2022 May 3;119(18):e2204149119. PMID: 31964809; PMCID: PMC7007575.
- Zhang P, Liu X, Abegg D, Tanaka T, Tong Y, Benhamou RI, Baisden J, Crynen G, Meyer SM, Cameron MD, Chatterjee AK, Adibekian A, Childs-Disney JL, Disney MD. Reprogramming of Protein-Targeted Small-Molecule Medicines to RNA by Ribonuclease Recruitment. J Am Chem Soc. 2021 Aug 25;143(33):13044-13055. doi: 10.1021/jacs.1c02248. Epub 2021 Aug 13. PMID: 34387474; PMCID: PMC9264281.
- Luk KC, Kehm V, Carroll J, Zhang B, O'Brien P, Trojanowski JQ, Lee VM. Pathological α-synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice. Science. 2012 Nov 16;338(6109):949-53. doi: 10.1126/science.1227157. PMID: 23161999; PMCID: PMC3552321.
- 宮沢正樹 鉄代謝とその制御 基礎老年研究43(1):31-37,2019
- 岩井一宏、植田亮 生体の鉄代謝調節メカニズム:細胞の鉄センシングにはミトコンドリアが関与する 生化学79(11)1021-1031,2007