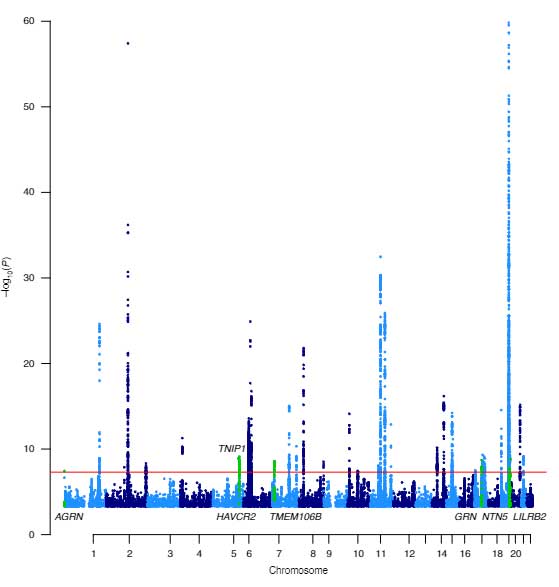
前頭側頭葉変性症(Frontotemporal lobar degeneration, FTLD) は、人格変化、情動異常、言語障害などを特徴とする認知症の1つで、若年性認知症(65歳以下)の症例数としては、アルツハイマー病(Alzheimer's disease, AD)に次いで2番目に多いとも言われています [1]。
この疾患は遺伝学的、病理学的観点から、筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis, ALS)と共通の疾患スペクトラムを形成する一方で、4Rタウオパチーの進行性核上性麻痺(Progressive supranuclear palsy, PSP)やcortico basal degeneration(CBD)とも共通のスペクトラムを形成する、非常に多様性のある疾患群で、広義的にFTLDスペクトラムと呼ばれています [2, 3] 。
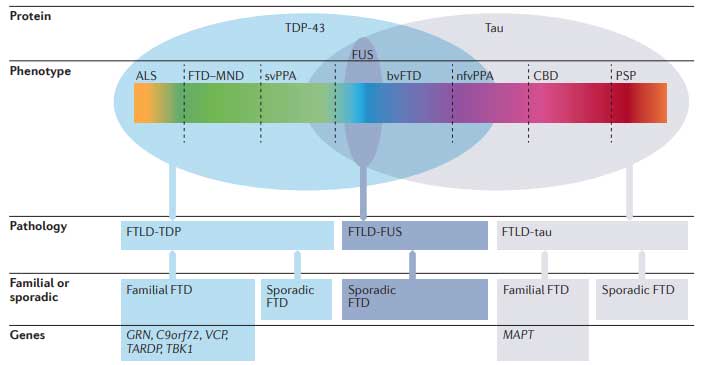
病理学的には、ALSはTDP-43病理の症例が圧倒的に多い一方、前頭側頭型認知症(frontotemporal dementia, FTD)は、FTLD-FUSが10%で、残り90%をFTLD-TDPとFTLD-tauが半分ずつ、といったイメージです [4, 5] 。
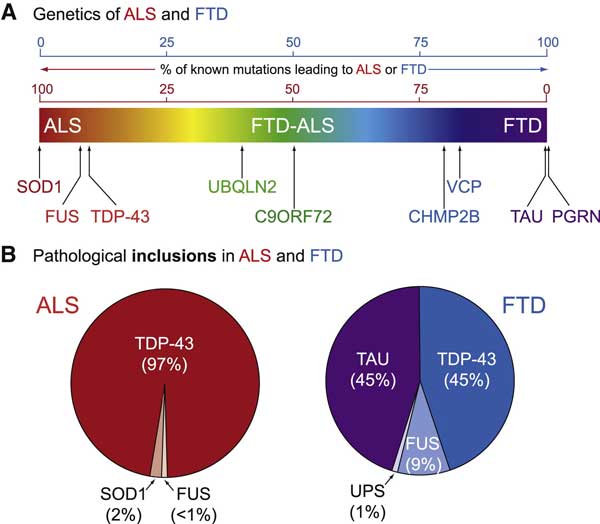
一方、PSPやCBDは主に4Rタウで構成される凝集体を神経やグリアに認めるのが特徴で、タウオパチーに分類されています [5, 6]。
ところがPSPやCBDも、どちらもFTLDスペクトラムに含まれるだけあって、よくよく調べたらTDP-43病理を脊髄に認める症例が結構あったようです。
今回、名古屋大学・祖父江先生らの研究グループは、
「PSPとCBDの患者さんの脊髄にTDP-43病理が観察された」
という内容を報告しました。

PSPとCBDの脊髄にTDP-43病理
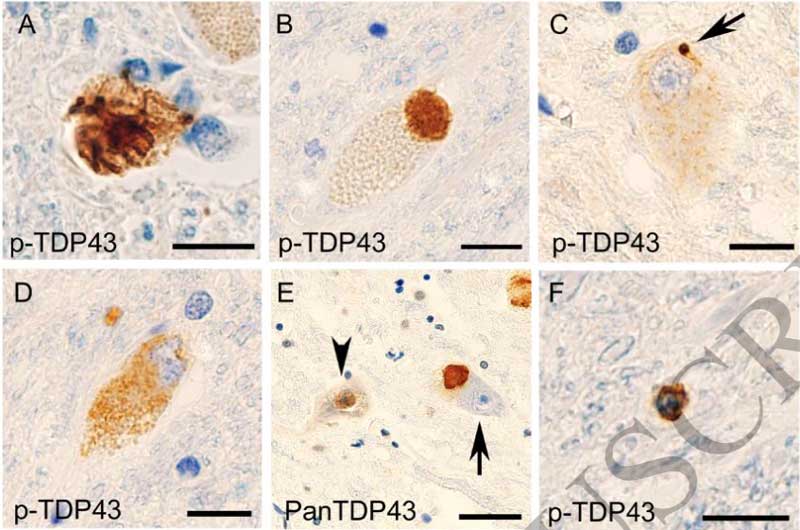
PSPとCBDの一部の症例の脊髄に、FTLD-TDPと同じTDP-43病理
彼らは、
- PSP (n=26)
- CBD (n-12)
- GGT (n=6)
- PiD (n=6)
- AD (n=21)
- healthy control (n=36)
の剖検症例の脊髄
- 頸髄 (C4-8)
- 胸髄 (T5-9)
- 腰髄 (L-4)
をタウやTDP-43抗体などで免疫染色し、
PSP26人(38%)、CBD12人(58%)の脊髄前核(一部はClarke's columnや後角にも)神経細胞でTDP-43の異所局在と細胞質内凝集体を認めました。
その一方で、GGT, PiD, AD, healthy control症例には、典型的なTDP-43細胞内病理を認めませんでした。
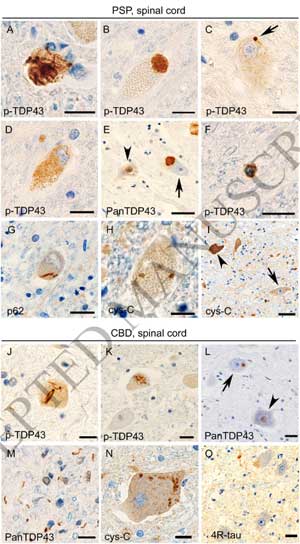
これらのTDP-43病理は、p62やユビキチンと共局在し、
ウェスタンブロットでFTLD-TDP typeAと同じC末断端のバンドパターンを認めました。
PSP/CBD症例のTDP-43病理の数は、4Rタウ病理の数と正の相関を示していましたが、同じ細胞には存在していませんでした。
背景にSFPQとFUSの相互作用の変化?
彼らは以前、splicing factor proline/glutamine rich (SFPQ) とfused-in-sarcoma (FUS) の相互作用がPSP/CBD/ALS/FTLDの患者さんで落ちている事を報告していました [8]。
SFPQはALS病理のレギュレーターとして知られており [9, 10, 11]、さらにFUSと相互作用してMAPTのエクソン10のスプライシングを調節することも知られています [12]。
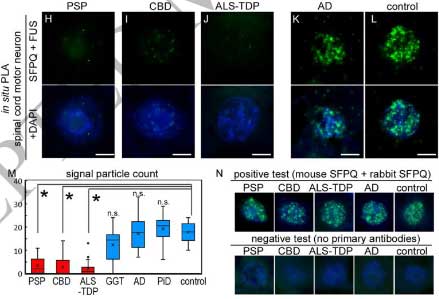
今回のTDP-43とタウ病理の現象の背景にもSFPQが関係している可能性を考え、彼らは二重染色や近接ライゲーションアッセイ(proximity ligation assay, PLA)で調べてみました。
すると、AD, PiD, GGT, コントロールで見られるようなSFPQ-FUSのPLAシグナルが、PSP, CBD, ALS-TDP症例では少なくなっており、これらの症例ではSFPQ-FUSの相互作用が落ちている可能性が示唆されました。
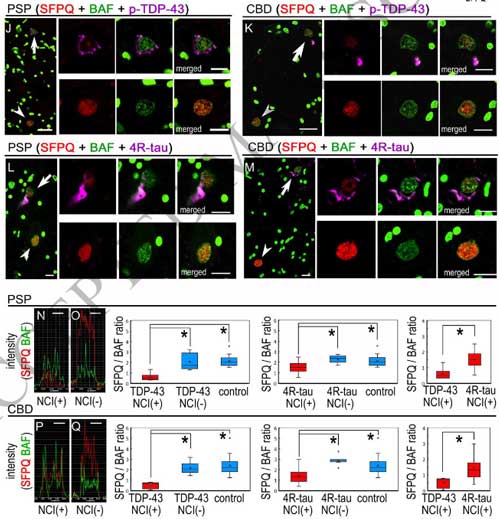
SFPQとクロマチンのインターラクションを調べると、TDP-43病理を認めた神経細胞で明らかに低下していました。
ミクログリオーシス
Iba1で脊髄前角のミクログリオーシスの程度を比較すると、
- p-TDP-43と4R-tauの両方の凝集体がある症例
- 4R-tau凝集体のみがある症例
- いずれの凝集体もない症例
の順にミクログリオーシスの程度が強く、TDP-43病理とタウ病理が相乗効果的にグリオーシスを誘導している可能性が示唆されました。
PSP/CBDの脊髄で認めたTDP-43病理は、一次運動野にも
脊髄でTDP-43病理を認めたPSP/CBD症例の脳内を調べると、一次運動野にも同じようにTDP-43病理のある症例を多く認めました。
病理的にはFTLD-TDP typeBで、運動ニューロン疾患型前頭側頭葉型認知症(FTD-MND)で報告されていたタイプでした [13] が、皮質全層に渡って核内凝集体も多く見られ、これはFTLD-TDPのどのパターンにも当てはまらないものでした [13]。
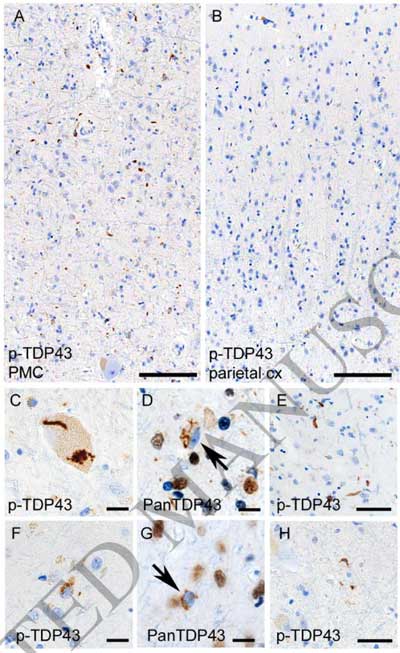
他にも、中脳被蓋や淡蒼球、扁桃体などに比較的多くTDP-43病理を認めました。
TDP-43(+)症例の臨床経過等や遺伝子プロファイル
TDP-43(+)とTDP-43(-)の症例で、
- 罹病期間
- 年齢
- 経口摂取期間
- 発症から最初に転倒するまでの期間
- Braakステージ
- LATEステージ
などを比較しましたが、いずれも両群で有意な違いはありませんでした。
また遺伝子プロファイルとして、
- MAPT
- C9orf72
- TARDBP
- VCP
- GRN
の変異を調べましたが、明らかなものはありませんでした。
また、
- TMEM106b
- GRN
のリスク多型も、日本人の頻度とほぼ同じ割合でした。
Abstract. Transactive response DNA-binding protein 43 kDa (TDP-43) is mislocalized from the nucleus and aggregates within the cytoplasm of affected neurons in a
My View
最近、limbic-predominant age-related TDP-43 encephalopathy(LATE)に関する話題が多く、私自身もLATEのプロジェクトを持っていたので、今回のタイトルを見た時に、
「タウとTDP-43の関係が、LATEに定義される辺縁系だけじゃなくて脊髄でも見られるってことかな。」
と思って読み始めましたが、そうではなくて、
「FTLDスペクトラムのタウオパチーではTDP-43病理が見られ、その背景にSFPQの機能低下が関係してそう。」
という内容の論文でした。
ADなどではこの現象は見られず、年齢等も関係ないことので、LATEとは全然違う概念でした。
脳神経科医のレジデントとしてそれぞれの患者さんを診療していた頃は、ALS/FTDとCBD/PSPが同じスペクトラムに入るなんて想像もしていませんでしたが、
遺伝子解析が進んで、同じ遺伝子の変異でも違う病理・臨床症状を呈す事が分かってきて、全ての疾患が1つの帯のように繋がっているようなイメージになって、
「疾患名ってゆーのは結局人間が線引きをしただけで、病態はもっと深い所で繋がっているんだろうな。」
と思います。
自分が生きている間にあとどれくらいの事がわかるのだろうかという楽しみと、自然の摂理が深すぎて、どこまで行っても結局よくわからないまま……とゆーかわからない事が増えていくような虚しさと、
勉強していると、時々、そんな複雑な気分になる事があります。
References
- Knopman DS, Roberts RO. Estimating the number of persons with frontotemporal lobar degeneration in the US population. J Mol Neurosci. 2011 Nov;45(3):330-5. doi: 10.1007/s12031-011-9538-y. Epub 2011 May 17. PMID: 21584654; PMCID: PMC3208074.
- Seltman RE, Matthews BR. Frontotemporal lobar degeneration: epidemiology, pathology, diagnosis and management. CNS Drugs. 2012 Oct 1;26(10):841-70. doi: 10.2165/11640070-000000000-00000. PMID: 22950490.
- Meeter LH, Kaat LD, Rohrer JD, van Swieten JC. Imaging and fluid biomarkers in frontotemporal dementia. Nat Rev Neurol. 2017 Jul;13(7):406-419. doi: 10.1038/nrneurol.2017.75. Epub 2017 Jun 16. PMID: 28621768.
- Ling SC, Polymenidou M, Cleveland DW. Converging mechanisms in ALS and FTD: disrupted RNA and protein homeostasis. Neuron. 2013 Aug 7;79(3):416-38. doi: 10.1016/j.neuron.2013.07.033. PMID: 23931993; PMCID: PMC4411085.
- Dickson DW, Kouri N, Murray ME, Josephs KA. Neuropathology of frontotemporal lobar degeneration-tau (FTLD-tau). J Mol Neurosci. 2011 Nov;45(3):384-9. doi: 10.1007/s12031-011-9589-0. Epub 2011 Jul 1. PMID: 21720721; PMCID: PMC3208128.
- Coughlin DG, Dickson DW, Josephs KA, Litvan I. Progressive Supranuclear Palsy and Corticobasal Degeneration. Adv Exp Med Biol. 2021;1281:151-176. doi: 10.1007/978-3-030-51140-1_11. PMID: 33433875.
- Riku Y, Iwasaki Y, Ishigaki S, Akagi A, Hasegawa M, Nishioka K, Li Y, Riku M, Ikeuchi T, Fujioka Y, Miyahara H, Sone J, Hattori N, Yoshida M, Katsuno M, Sobue G. Motor neuron TDP-43 proteinopathy in progressive supranuclear palsy and corticobasal degeneration. Brain. 2022 Mar 11:awac091. doi: 10.1093/brain/awac091. Epub ahead of print. PMID: 35274674.
- Ishigaki S, Riku Y, Fujioka Y, Endo K, Iwade N, Kawai K, Ishibashi M, Yokoi S, Katsuno M, Watanabe H, Mori K, Akagi A, Yokota O, Terada S, Kawakami I, Suzuki N, Warita H, Aoki M, Yoshida M, Sobue G. Aberrant interaction between FUS and SFPQ in neurons in a wide range of FTLD spectrum diseases. Brain. 2020 Aug 1;143(8):2398-2405. doi: 10.1093/brain/awaa196. PMID: 32770214.
- Luisier R, Tyzack GE, Hall CE, Mitchell JS, Devine H, Taha DM, Malik B, Meyer I, Greensmith L, Newcombe J, Ule J, Luscombe NM, Patani R. Intron retention and nuclear loss of SFPQ are molecular hallmarks of ALS. Nat Commun. 2018 May 22;9(1):2010. doi: 10.1038/s41467-018-04373-8. PMID: 29789581; PMCID: PMC5964114.
- Tyzack GE, Neeves J, Crerar H, Klein P, Ziff O, Taha DM, Luisier R, Luscombe NM, Patani R. Aberrant cytoplasmic intron retention is a blueprint for RNA binding protein mislocalization in VCP-related amyotrophic lateral sclerosis. Brain. 2021 Aug 17;144(7):1985-1993. doi: 10.1093/brain/awab078. PMID: 33693641; PMCID: PMC8370440.
- Rayner SL, Cheng F, Hogan AL, Grima N, Yang S, Ke YD, Au CG, Morsch M, De Luca A, Davidson JM, Molloy MP, Shi B, Ittner LM, Blair I, Chung RS, Lee A. ALS/FTD-causing mutation in cyclin F causes the dysregulation of SFPQ. Hum Mol Genet. 2021 May 31;30(11):971-984. doi: 10.1093/hmg/ddab073. PMID: 33729478.
- Ishigaki S, Fujioka Y, Okada Y, Riku Y, Udagawa T, Honda D, Yokoi S, Endo K, Ikenaka K, Takagi S, Iguchi Y, Sahara N, Takashima A, Okano H, Yoshida M, Warita H, Aoki M, Watanabe H, Okado H, Katsuno M, Sobue G. Altered Tau Isoform Ratio Caused by Loss of FUS and SFPQ Function Leads to FTLD-like Phenotypes. Cell Rep. 2017 Jan 31;18(5):1118-1131. doi: 10.1016/j.celrep.2017.01.013. PMID: 28147269.
- Mackenzie IR, Neumann M, Baborie A, Sampathu DM, Du Plessis D, Jaros E, Perry RH, Trojanowski JQ, Mann DM, Lee VM. A harmonized classification system for FTLD-TDP pathology. Acta Neuropathol. 2011 Jul;122(1):111-3. doi: 10.1007/s00401-011-0845-8. Epub 2011 Jun 5. PMID: 21644037; PMCID: PMC3285143.