アルツハイマー病 (Alzheimer's disease, AD) の90%は孤発性で、リスク遺伝子多型に関しては今までにも何度かゲノムワイド関連解析 (genome-wide association study, GWAS) が行われてきました。
今までで一番大きいGWAS解析では、71,880症例のAD群と383,378症例のコントロール群のGWAS解析で、29のリスク多型を報告しました [1]。
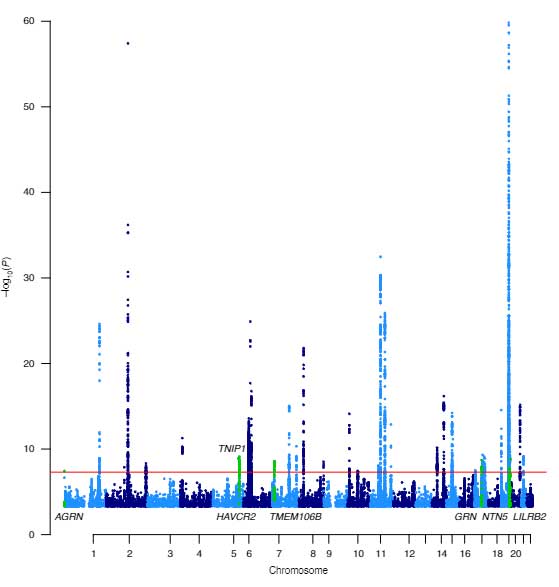
今回は、90,338症例のAD群と1,036,225症例のコントロール群でGWAS解析を行い、38のADリスク多型を同定し、そのうち7つは新規に同定されました [2] 。

孤発性ADの大規模GWAS解析
著者らは、下記を含む13のコホートのデータを使用し、GWAS解析を行いました。
- International Genomics of Alzheimer's Project (IGAP)
- deCODE
- UK Biobank
- 23andME
- BioVU
- the Trondelag Health Study
- DemGene TwinGene
- STSA
- GR@CE
- Gothenburg
- ANMerge
- Finngen
同定したADのリスク多型は38遺伝子で、
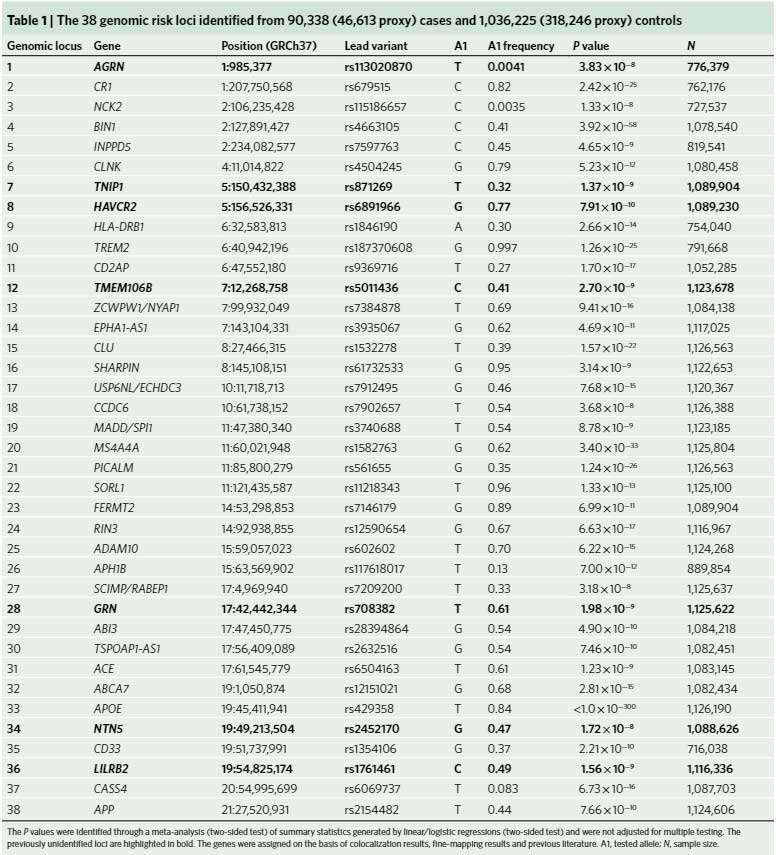
そのうち、下記7遺伝子が新規で同定されました。
- AGRN
- TNIP1
- HAVCR2
- TMTM106B
- GRN
- NTN5
- LILRB2
このうち、TMEM106BとGRNは、TDP-43病理を伴う前頭側頭葉変性症(Frontotemporal lobar degenerationX-TDP-43, FTLD-TDP)に関連する遺伝子として注目されており、
私も limbic-predominant age-related TDP-43 encephalopathy (LATE) の研究で調べたことがあります。
それ以外の遺伝子としては、免疫系や蛋白分解系に関与するので、Aβやタウの貪食・分解機能の低下が関係しているかもしれません。

……アップデート!
Glossary
孤発性AD関連遺伝子TOP 10
今までのGWASの結果で、孤発性ADに関連する遺伝子多型トップ10は下記↓
| # | Gene | Polymorphism | OR | 機能いろいろ | AD関連 |
|---|---|---|---|---|---|
| 1 | APOE | APOE2/3/4 | 3.69 | 脂質代謝 | Aβ凝集↑、Aβクリアラインス↓、タウ病理↑、血管障害↑、神経障害↑ etc. [3] |
| 2 | BIN1 | rs744373 | 1.17 | 癌抑制蛋白と相互作用、骨格筋障害の変異遺伝子、シナプス伝達機能 | BACE1の細胞内輸送→Aβ産生↑、タウのリリース↑ etc. [4] |
| 3 | CLU | rs11136000 | 0.88 | クラステリン。シャペロン、癌関、心血管系関連 | Aβ産生↓、Aβ移送、Aβクリアランス↑ etc. [5] |
| 4 | ABCA7 | rs3764650 | 1.23 | ATP-binding cassette (ABC) トランスポーター。血球系、マクロファージ、ミクログリアに多く発現し、貪食に関与。 | Aβ産生やクリアランスが示唆されているが、詳細は不明。[6] |
| 5 | CR1 | rs3818361 | 1.17 | 1型膜貫通糖蛋白 | Aβ↑、タウ↑、神経炎症↑ etc. [7] |
| 6 | PICALM | rs3851179 | 0.88 | クラスリンとAP2を膜領域に集め、クラスリン小胞を作る。 | Aβ産生とクリアランス、タウ取り込み、シナプス障害 etc.[8] |
| 7 | MS4A6A | rs610932 | 0.90 | シグナル伝達系、レセプター。 | 抗酸化作用 [9]、ミクログリア機能、sTREM2 [10] etc. |
| 8 | CD33 | rs3865444 | 0.90 | 免疫系細胞に多く発現。脳内ではミクログリアとマクロファージに発現。受容体-リガンドの相互作用によってい働きは色々。 | Aβ病理 > タウ病理 に関与。[11] |
| 9 | MS4A4E | rs570139 | 1.08 | CD20。T細胞の細胞周期・増殖に関与。 | 不明。"MS4A4A"はsTREM2を調節 [12] だけど。。。 |
| 10 | CD2AP | rs9349407 | 1.12 | 免疫系細胞や上皮系細胞に発現。CD4+T細胞ではヘルパーT細胞への分化を調節。 | APPのソーティングとAβ産生、タウ介在性細胞毒性 etc. [13] |
今回新たに同定された7遺伝子
今回同定された38遺伝子のうち、新しい7遺伝子は下記↓
| # | Gene | Polymorphism | A1 | A1 frequency | Description |
|---|---|---|---|---|---|
| 1 | AGRN | rs113020870 | T | 0.004 | Agrin。胎生期に、運動神経終末から分泌される [14]。神経筋接合部において重要な働きをもつ [15]。 |
| 2 | TNIP | rs871269 | T | 0.32 | TNF-alpha induced protein 3-interacting protein。TNIP5TNIP3がよく調べられている。TNFAIP3に結合して、TNF、TLF4、IL1などによるNFκB活性上昇を阻害する [16] |
| 3 | HAVCR2 | rs6168966 | G | 0.77 | Hepatitis A virus cellular receptor 2。T-cell immunoglobulin and mucin-domain containing-3 (5M-3) ともいう。T細胞や骨髄系の細胞に発現する膜貫通型蛋白。PD-1とともに免疫チェックポイントに関与 [17]。 |
| 4 | TMEM106B | rs50011436 | G | 0.41 | Transmembrane protein 106B。FTLD-TDPの原因遺伝子 [18]。LATEのリスク多型でもある [19]。 |
| 5 | GRN | rs608382 | T | 0.61 | progranulin。リソソームの膜構成蛋白。皮膚や免疫系細胞に発現し、細胞周期や炎症、免疫システム等に関与。FTLD-TDPの原因遺伝子 [19]。LATEのリスク多型でもある [19]。 |
| 6 | NTN5 | r2452170 | G | 0.47 | Netrin-1-like protein。神経新生に関与 [20]。 |
| 7 | LILRB2 | rs1871461 | C | 0.49 | Leukocyte immunoglobulin-like receptor subfamily B member 2。leukocyte immunoglobulin5ike receptor (LIR) ファミリーに属す。LIRは免疫系細胞に発現し、抗原提示細胞のMHCクラスI分子に結合して免疫反応の刺激を阻害する [21]。 |
References
- Wightman DP, Jansen IE, Savage JE, Shadrin AA, Bahrami S, Holland D, Rongve A, Børte S, Winsvold BS, Drange OK, Martinsen AE, Skogholt AH, Willer C, Bråthen G, Bosnes I, Nielsen JB, Fritsche LG, Thomas LF, Pedersen LM, Gabrielsen ME, Johnsen MB, Meisingset TW, Zhou W, Proitsi P, Hodges A, Dobson R, Velayudhan L; 23andMe Research Team, Sealock JM, Davis LK, Pedersen NL, Reynolds CA, Karlsson IK, Magnusson S, Stefansson H, Thordardottir S, Jonsson PV, Snaedal J, Zettergren A, Skoog I, Kern S, Waern M, Zetterberg H, Blennow K, Stordal E, Hveem K, Zwart JA, Athanasiu L, Selnes P, Saltvedt I, Sando SB, Ulstein I, Djurovic S, Fladby T, Aarsland D, Selbæk G, Ripke S, Stefansson K, Andreassen OA, Posthuma D. A genome-wide association study with 1,126,563 individuals identifies new risk loci for Alzheimer's disease. Nat Genet. 2021 Sep;53(9):1276-1282. doi: 10.1038/s41588-021-00921-z. Epub 2021 Sep 7. PMID: 34493870.
- Wightman DP, Jansen IE, Savage JE, Shadrin AA, Bahrami S, Holland D, Rongve A, Børte S, Winsvold BS, Drange OK, Martinsen AE, Skogholt AH, Willer C, Bråthen G, Bosnes I, Nielsen JB, Fritsche LG, Thomas LF, Pedersen LM, Gabrielsen ME, Johnsen MB, Meisingset TW, Zhou W, Proitsi P, Hodges A, Dobson R, Velayudhan L; 23andMe Research Team, Sealock JM, Davis LK, Pedersen NL, Reynolds CA, Karlsson IK, Magnusson S, Stefansson H, Thordardottir S, Jonsson PV, Snaedal J, Zettergren A, Skoog I, Kern S, Waern M, Zetterberg H, Blennow K, Stordal E, Hveem K, Zwart JA, Athanasiu L, Selnes P, Saltvedt I, Sando SB, Ulstein I, Djurovic S, Fladby T, Aarsland D, Selbæk G, Ripke S, Stefansson K, Andreassen OA, Posthuma D. A genome-wide association study with 1,126,563 individuals identifies new risk loci for Alzheimer's disease. Nat Genet. 2021 Sep;53(9):1276-1282. doi: 10.1038/s41588-021-00921-z. Epub 2021 Sep 7. PMID: 34493870.
- Serrano-Pozo A, Das S, Hyman BT. APOE and Alzheimer's disease: advances in genetics, pathophysiology, and therapeutic approaches. Lancet Neurol. 2021 Jan;20(1):68-80. doi: 10.1016/S1474-4422(20)30412-9. Erratum in: Lancet Neurol. 2021 Feb;20(2):e2. PMID: 33340485; PMCID: PMC8096522.
- Gao P, Ye L, Cheng H, Li H. The Mechanistic Role of Bridging Integrator 1 (BIN1) in Alzheimer's Disease. Cell Mol Neurobiol. 2021 Oct;41(7):1431-1440. doi: 10.1007/s10571-020-00926-y. Epub 2020 Jul 27. PMID: 32719966.
- Foster EM, Dangla-Valls A, Lovestone S, Ribe EM, Buckley NJ. Clusterin in Alzheimer's Disease: Mechanisms, Genetics, and Lessons From Other Pathologies. Front Neurosci. 2019 Feb 28;13:164. doi: 10.3389/fnins.2019.00164. PMID: 30872998; PMCID: PMC6403191.
- De Roeck A, Van Broeckhoven C, Sleegers K. The role of ABCA7 in Alzheimer's disease: evidence from genomics, transcriptomics and methylomics. Acta Neuropathol. 2019 Aug;138(2):201-220. doi: 10.1007/s00401-019-01994-1. Epub 2019 Mar 22. PMID: 30903345; PMCID: PMC6660495.
- Zhu XC, Yu JT, Jiang T, Wang P, Cao L, Tan L. CR1 in Alzheimer's disease. Mol Neurobiol. 2015 Apr;51(2):753-65. doi: 10.1007/s12035-014-8723-8. Epub 2014 May 4. PMID: 24794147.
- Lacher SE, Alazizi A, Wang X, Bell DA, Pique-Regi R, Luca F, Slattery M. A hypermorphic antioxidant response element is associated with increased MS4A6A expression and Alzheimer's disease. Redox Biol. 2018 Apr;14:686-693. doi: 10.1016/j.redox.2017.10.018. Epub 2017 Oct 27. PMID: 29179108; PMCID: PMC5705802.
- Hou XH, Bi YL, Tan MS, Xu W, Li JQ, Shen XN, Dou KX, Tan CC, Tan L; Alzheimer's Disease Neuroimaging Initiative, Yu JT. Genome-wide association study identifies Alzheimer's risk variant in MS4A6A influencing cerebrospinal fluid sTREM2 levels. Neurobiol Aging. 2019 Dec;84:241.e13-241.e20. doi: 10.1016/j.neurobiolaging.2019.05.008. Epub 2019 May 21. PMID: 31204042.
- Xu W, Tan L, Yu JT. The Role of PICALM in Alzheimer's Disease. Mol Neurobiol. 2015 Aug;52(1):399-413. doi: 10.1007/s12035-014-8878-3. Epub 2014 Sep 4. PMID: 25186232.
- Zhao L. CD33 in Alzheimer's Disease - Biology, Pathogenesis, and Therapeutics: A Mini-Review. Gerontology. 2019;65(4):323-331. doi: 10.1159/000492596. Epub 2018 Dec 12. PMID: 30541012.
- Deming Y, Filipello F, Cignarella F, Cantoni C, Hsu S, Mikesell R, Li Z, Del-Aguila JL, Dube U, Farias FG, Bradley J, Budde J, Ibanez L, Fernandez MV, Blennow K, Zetterberg H, Heslegrave A, Johansson PM, Svensson J, Nellgård B, Lleo A, Alcolea D, Clarimon J, Rami L, Molinuevo JL, Suárez-Calvet M, Morenas-Rodríguez E, Kleinberger G, Ewers M, Harari O, Haass C, Brett TJ, Benitez BA, Karch CM, Piccio L, Cruchaga C. The MS4A gene cluster is a key modulator of soluble TREM2 and Alzheimer's disease risk. Sci Transl Med. 2019 Aug 14;11(505):eaau2291. doi: 10.1126/scitranslmed.aau2291. PMID: 31413141; PMCID: PMC6697053.
- Tao QQ, Chen YC, Wu ZY. The role of CD2AP in the Pathogenesis of Alzheimer's Disease. Aging Dis. 2019 Aug 1;10(4):901-907. doi: 10.14336/AD.2018.1025. PMID: 31440393; PMCID: PMC6675523.
- Sanes JR, Lichtman JW. Induction, assembly, maturation and maintenance of a postsynaptic apparatus. Nat Rev Neurosci. 2001 Nov;2(11):791-805. doi: 10.1038/35097557. PMID: 11715056.
- Glass DJ, Bowen DC, Stitt TN, Radziejewski C, Bruno J, Ryan TE, Gies DR, Shah S, Mattsson K, Burden SJ, DiStefano PS, Valenzuela DM, DeChiara TM, Yancopoulos GD. Agrin acts via a MuSK receptor complex. Cell. 1996 May 17;85(4):513-23. doi: 10.1016/s0092-8674(00)81252-0. PMID: 8653787.
- Nextprot, TNIP3-Function. https://www.nextprot.org/entry/NX_Q96KP6/
- Jin HT, Anderson AC, Tan WG, West EE, Ha SJ, Araki K, Freeman GJ, Kuchroo VK, Ahmed R. Cooperation of Tim-3 and PD-1 in CD8 T-cell exhaustion during chronic viral infection. Proc Natl Acad Sci U S A. 2010 Aug 17;107(33):14733-8. doi: 10.1073/pnas.1009731107. Epub 2010 Aug 2. PMID: 20679213; PMCID: PMC2930455.
- Van Deerlin VM, Sleiman PM, Martinez-Lage M, Chen-Plotkin A, Wang LS, Graff-Radford NR, Dickson DW, Rademakers R, Boeve BF, Grossman M, Arnold SE, Mann DM, Pickering-Brown SM, Seelaar H, Heutink P, van Swieten JC, Murrell JR, Ghetti B, Spina S, Grafman J, Hodges J, Spillantini MG, Gilman S, Lieberman AP, Kaye JA, Woltjer RL, Bigio EH, Mesulam M, Al-Sarraj S, Troakes C, Rosenberg RN, White CL 3rd, Ferrer I, Lladó A, Neumann M, Kretzschmar HA, Hulette CM, Welsh-Bohmer KA, Miller BL, Alzualde A, Lopez de Munain A, McKee AC, Gearing M, Levey AI, Lah JJ, Hardy J, Rohrer JD, Lashley T, Mackenzie IR, Feldman HH, Hamilton RL, Dekosky ST, van der Zee J, Kumar-Singh S, Van Broeckhoven C, Mayeux R, Vonsattel JP, Troncoso JC, Kril JJ, Kwok JB, Halliday GM, Bird TD, Ince PG, Shaw PJ, Cairns NJ, Morris JC, McLean CA, DeCarli C, Ellis WG, Freeman SH, Frosch MP, Growdon JH, Perl DP, Sano M, Bennett DA, Schneider JA, Beach TG, Reiman EM, Woodruff BK, Cummings J, Vinters HV, Miller CA, Chui HC, Alafuzoff I, Hartikainen P, Seilhean D, Galasko D, Masliah E, Cotman CW, Tuñón MT, Martínez MC, Munoz DG, Carroll SL, Marson D, Riederer PF, Bogdanovic N, Schellenberg GD, Hakonarson H, Trojanowski JQ, Lee VM. Common variants at 7p21 are associated with frontotemporal lobar degeneration with TDP-43 inclusions. Nat Genet. 2010 Mar;42(3):234-9. doi: 10.1038/ng.536. Epub 2010 Feb 14. PMID: 20154673; PMCID: PMC2828525.
- Nelson PT, Dickson DW, Trojanowski JQ, Jack CR, Boyle PA, Arfanakis K, Rademakers R, Alafuzoff I, Attems J, Brayne C, Coyle-Gilchrist ITS, Chui HC, Fardo DW, Flanagan ME, Halliday G, Hokkanen SRK, Hunter S, Jicha GA, Katsumata Y, Kawas CH, Keene CD, Kovacs GG, Kukull WA, Levey AI, Makkinejad N, Montine TJ, Murayama S, Murray ME, Nag S, Rissman RA, Seeley WW, Sperling RA, White Iii CL, Yu L, Schneider JA. Limbic-predominant age-related TDP-43 encephalopathy (LATE): consensus working group report. Brain. 2019 Jun 1;142(6):1503-1527. doi: 10.1093/brain/awz099. Erratum in: Brain. 2019 Jul 1;142(7):e37. PMID: 31039256; PMCID: PMC6536849.
- Baker M, Mackenzie IR, Pickering-Brown SM, Gass J, Rademakers R, Lindholm C, Snowden J, Adamson J, Sadovnick AD, Rollinson S, Cannon A, Dwosh E, Neary D, Melquist S, Richardson A, Dickson D, Berger Z, Eriksen J, Robinson T, Zehr C, Dickey CA, Crook R, McGowan E, Mann D, Boeve B, Feldman H, Hutton M. Mutations in progranulin cause tau-negative frontotemporal dementia linked to chromosome 17. Nature. 2006 Aug 24;442(7105):916-9. doi: 10.1038/nature05016. Epub 2006 Jul 16. PMID: 16862116.
- https://www.uniprot.org/uniprot/Q8WTR8
- https://www.ncbi.nlm.nih.gov/gene?Db=gene&Cmd=ShowDetailView&TermToSearch=10288