パーキンソン病 (Parkinson's disease, PD) や多系統萎縮症 (Multiple system atrophy, MSA) の主要病理、レヴィ小体やオリゴデンドログリア細胞内嗜銀性封入体 (glial cytoplasmic inclusion, GCI) の主要成分は、α-シヌクレイン (α-synuclein, α-syn) と言われています。
1960年代から1990年代にかけて、電子顕微鏡によるレヴィ小体の解析が行われ、レヴィ小体は線維状の構造をしていると言われていましたが [1, 2]、
細胞小器官も含まれている、という報告もいくつか存在していました [3]。
時を経て2019年、高解像度の電験 (correlative light electron microscopy, CLEM) や、stimulated emission depletion (STED) の超高解像度顕微鏡を使って、
「多くのレヴィ小体には、高脂質の小胞構造や形の壊れたオルガネラが詰まっていて、そのレヴィ小体には α-syn が入っていないものも多い」
という研究報告 [4] がでました。
これは、今まで α-syn をメインに研究してきた人達の研究や、それを元に臨床研究を組んでいる人達の計画に疑問を投げかける内容だったので、
賛成派・反対派に分かれて、喧々諤々の議論が交わされました。
今回、ドイツ・マックス・プランク研究所の Dr. Hartl, Dr. Fernández-Busnadiego らの研究グループは、cryo-electron tomography (cryo-ET) を使って、
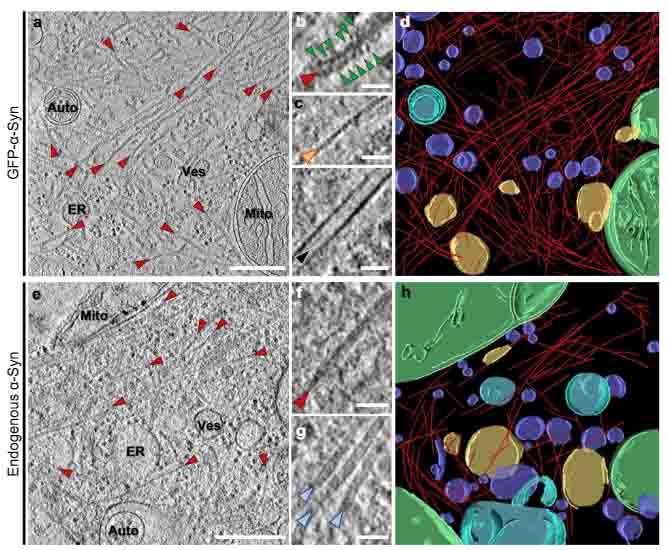
細胞内に形成された α-syn封入体の構造を詳細に解析しました。

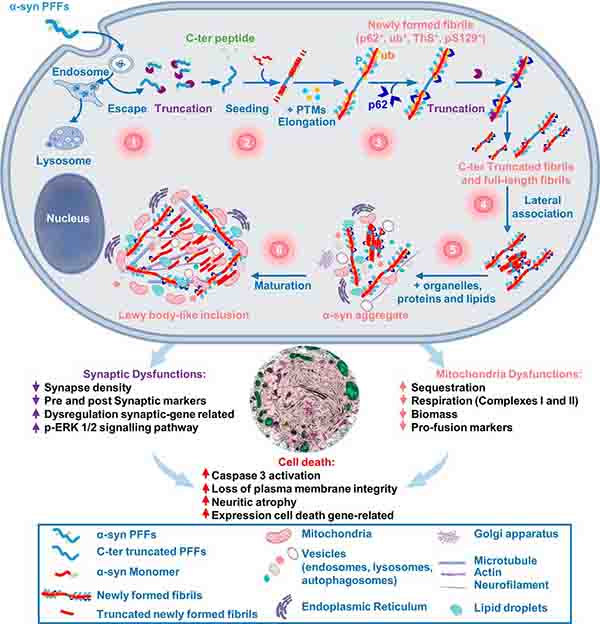
神経細胞内のα-syn凝集体には、オルガネラが巻き込まれている
彼らは、神経細胞初代培養やSHSY-5Y細胞に GFP標識したリコンビナント (野生型 or A53T変異) ヒトα-syn の preformed fibrils (α-syn PFF) を処置し、α-syn凝集体形成モデルを作製しました。
そのα-syn凝集体を cryo-ET で観察すると、α-syn 線維の他に、小胞やミトコンドリアの膜構造が存在していました。

また、MSA患者さんの脳(橋)から抽出した α-syn を処置しても同様の結果が得られました。
α-syn のシードは、小胞膜にくっついているけれども、相互作用しているわけではない
金コロイドでラベルしたα-synを細胞に処置して、小胞膜とα-synシードの相互作用について調べると、
α-synシードは小胞膜にくっついていたり、時々小胞内に入っていたりといった像は観察されましたが、そこから形成されたα-syn凝集体は小胞の外に伸長しており、
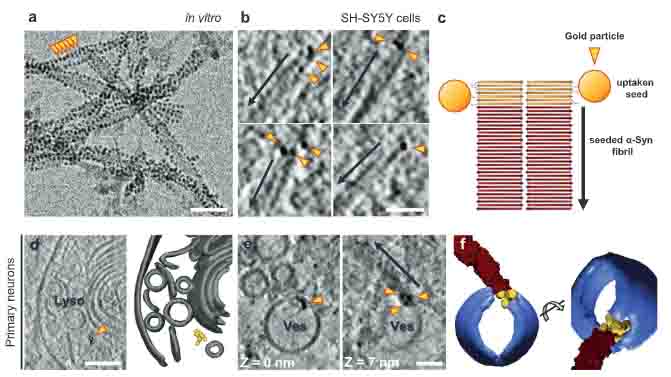
形成された α-syn凝集体が、小胞膜と相互作用していたり、小胞膜をクラスター形成させたりしているわけではなさそうでした。
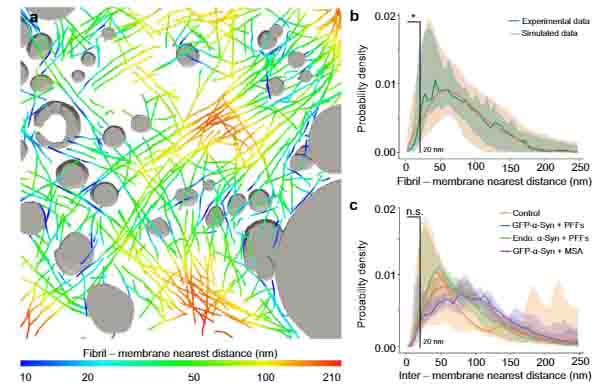
以上の結果から、
- α-syn凝集体の中には確かに細胞小器官の膜構造が巻き込まれているのが観察される
- けれども、それら細胞小器官とα-syn凝集線維との相互作用はなく、ただ一緒にいるだけ
という可能性が考えられました。
The molecular architecture of α-Synuclein (α-Syn) inclusions, pathognomonic of various neurodegenerative disorders, remains unclear. Here, authors use cryo-electron tomography to image neuronal α-Syn inclusions in situ and find that inclusions consist of α-Syn fibrils intermixed with cellular organelles without interacting directly.
My View
PD や DLB の患者さんの脳病理をみていると、HE染色とα-syn染色の像はほぼほぼ一致するので、
「α-synを欠いたレヴィ小体がたくさんある」というのは違うんじゃないかなーとは思っています。
ただ、α-syn が細胞内で凝集する過程において、細胞小器官が巻き込まれるのは本当っぽいです。
去年、α-syn の細胞内凝集過程の後半から細胞小器官を巻き込んでいく、という論文が出ていましたが [5]、
今回はそれをサポートする結果と言えそうです。
ただ、それがどういう意味を持つのかについては、今回の結果からは明らかではなかったようで、その論文とは完全に一致しない感じです。
もう少し深くみていく必要がありそう……ってことでしょうか。
Glossary
cryo-ET
cryo-electron microscopy (cryo-EM) は、試料を凍結 (だいたい液体窒素の温度) させ、自然に近い状態で構造を観察する技術。
それを使って、CTスキャンのように2次元画像を積み上げ、3次元画像を作製する技術 [6]。
これにより、自然に近い状態で、電験レベルの細胞内構造を観察することができる。
References
- Forno LS. Neuropathology of Parkinson's disease. J Neuropathol Exp Neurol. 1996 Mar;55(3):259-72. doi: 10.1097/00005072-199603000-00001. PMID: 8786384.
- Roy S, F L. Ultrastructural observations in Parkinsonism. J Pathol. 1969 Sep;99(1):39-44. doi: 10.1002/path.1710990106. PMID: 5359222.
- Lashuel HA. Do Lewy bodies contain alpha-synuclein fibrils? and Does it matter? A brief history and critical analysis of recent reports. Neurobiol Dis. 2020 Jul;141:104876. doi: 10.1016/j.nbd.2020.104876. Epub 2020 Apr 25. PMID: 2339655.
- Shahmoradian SH, Lewis AJ, Genoud C, Hench J, Moors TE, Navarro PP, Castaño-Díez D, Schweighauser G, Graff-Meyer A, Goldie KN, Sütterlin R, Huisman E, Ingrassia A, Gier Y, Rozemuller AJM, Wang J, Paepe A, Erny J, Staempfli A, Hoernschemeyer J, Großerüschkamp F, Niedieker D, El-Mashtoly SF, Quadri M, Van IJcken WFJ, Bonifati V, Gerwert K, Bohrmann B, Frank S, Britschgi M, Stahlberg H, Van de Berg WDJ, Lauer ME. Lewy pathology in Parkinson's disease consists of crowded organelles and lipid membranes. Nat Neurosci. 2019 Jul;22(7):1099-1109. doi: 10.1038/s41593-019-0423-2. Epub 2019 Jun 24. PMID: 1235907.
- Mahul-Mellier AL, Burtscher J, Maharjan N, Weerens L, Croisier M, Kuttler F, Leleu M, Knott GW, Lashuel HA. The process of Lewy body formation, rather than simply α-synuclein fibrillization, is one of the major drivers of neurodegeneration. Proc Natl Acad Sci U S A. 2020 Mar 3;117(9):4971-4982. doi: 10.1073/pnas.1913904117. Epub 2020 Feb 19. PMID: 32075919; PMCID: PMC7060668.
- Doerr, A. Cryo-electron tomography. Nat Methods 14, 34 (2017). https:// doi.org/10.1038/nmeth.4115/


Synphilin-1というのもLBの構成成分でaSynと相互作用があるとされていたと思うのですが、これは最近はもはや注目されていないのでしょうか?
そうですね……
Synphilin-1のPD関係の論文は、今でも時々見かけており、直近だと Scientific Reports (https://www.nature.com/articles/s41598-021-88910-4) で報告がありました。
ただ、それより大きなジャーナルとかではあまり見ていません。
注目されていないかどうかについては正直よくわからないのですが、
個人的な印象としては、2000年代に比べると、Parkinの基質&LBの構成成分として注目されていた分子たちの論文は少なくなっているように思います。
流行り廃りは繰り返すと言われているので、また注目されるようになるかもしれませんが……
ありがとうございます。propagationはまったくの素人なのですが、伝播していく過程で他の構成成分の関与はどんなものなのか、興味はあります。もしかしたら伝播の指向性に関わるかもしれませんし。
そうですね。私も興味深い内容だと思います。
伝播の受け皿となるレセプターの研究とかもよくでていますが、どれかが正解って感じではなくて、色々な要素が関係している感じがしますね。
LB、プラーク、タングルの構成成分も色々言われてきたと思いますが、「やっぱりただ巻き込まれているだけだったのかも」という結論になることも多いので、その中から積極的に病態に関与しているものを見つけられたら素晴らしいと思います。