タウは微小管結合タンパクで、その異常凝集体はアルツハイマー病(Alzheimer's disease, AD)の主要病理の1つと言われています。
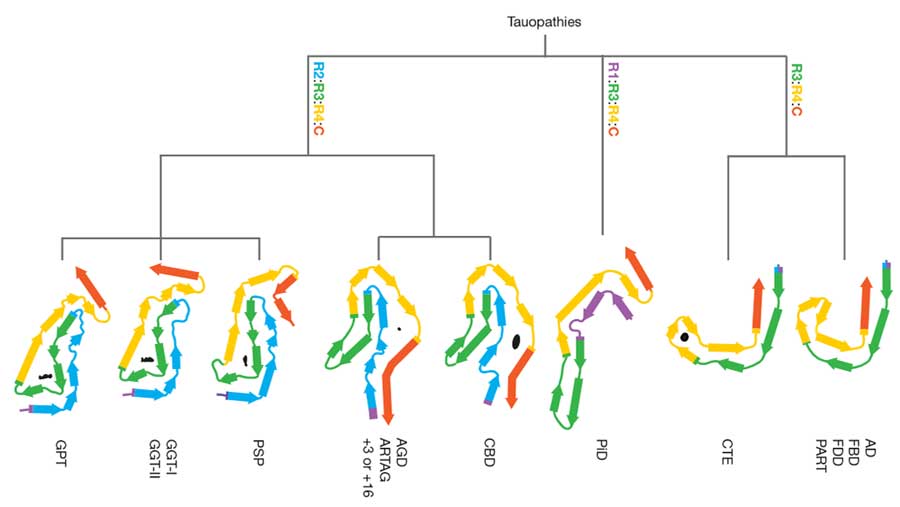
他にも、前頭側頭型認知症(frontotemporal dementia, FTD)、進行性核上性麻痺(Progressive supranuclear palsy, PSP)、cortico basal degeneration(CBD)、慢性外傷性脳症(chronic traumatic encephalopathy, CTE)など、
色々なタウオパチー疾患で、様々な構造のタウ凝集体が確認されており [1, 2, 3, 4, 5, 6] 、
クライオ電子顕微鏡法(cryo-electron microscopy, cryo-EM)でのフィラメント構造解析については、このブログでも何回かとりあげました。 主に、イギリス・MRC分子生物学研究所の …
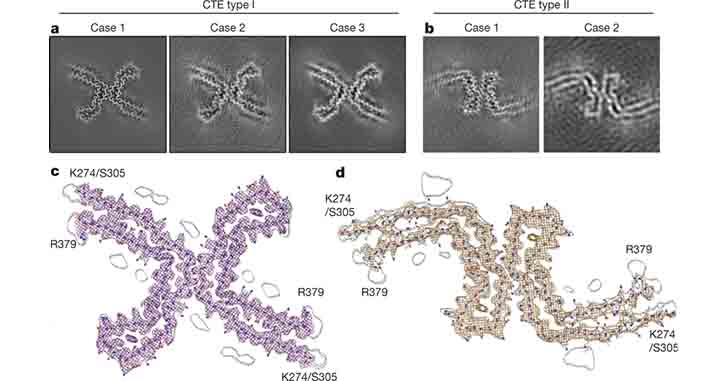
慢性外傷性脳症(Chronic traumatic encephalopathy, CTE)は、何回も頭部に衝撃を受けた人等に起こる、脳内の神経変性性タウタウオパチーである。 CTEでは、過リン酸化したタウが、脳皮質の浅 …
タウオパチーとして分類される疾患(Alzhiemer's disease, AD; Pick's disease, PiD; CBD; Progressive supranuclear palsy, PSP; Chron …
Cryo-EMで前方側頭葉変性症(FLTD), アルツハイマー病(AD), 慢性外傷性脳症(CTE), 大脳皮質基底核変性症(CBD)のタウを次々と解析している、イギリス・MRC Laboratory of Molecu …
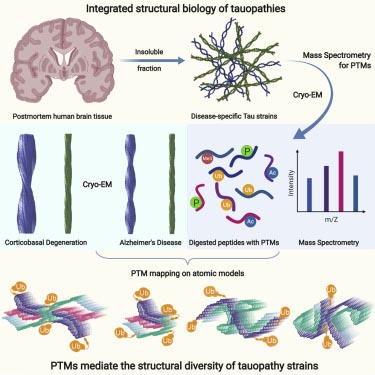
神経変性疾患で大きなトピックとなっているタンパク凝集体の実験について。 リコンビナントのタウやα-シヌクレイン (α-synuclein, α-syn) の凝集体は、実際の患者さん脳内のタンパク凝集体と構造が異なることが …
これらのタウ凝集体の病理メカニズムの解析は、タウオパチーの病態を知る上で重要な鍵と考えられています。
このため、リコンビナントタウを凝集化して実験に使用することが試みられてきましたが、リコンビナントで人工的に作ったタウ凝集体(主にヘパリンをco-factorとして使用)は、本物のADタウ凝集体などと構造が違っており [7]、
その細胞間や脳内伝播などの性質も全く異なる [8] 事 etc. が報告されてきました。
今回、イギリス・ケンブリッジ大学MRC研究所のDr. Goedert、Dr.Scheresらの研究グループは、
「リコンビナントタウでも、凝集化の工程を工夫すると、Cryo-EM上、ADやCTEタイプIIのタウ凝集体と似た様な構造の凝集体が作れた」
という事を報告しました [9]。

リコンビナントのタウでも本物に近い構造の凝集体が作れる
振盪スピード:ゆっくり(200rpm)の方が良さげ
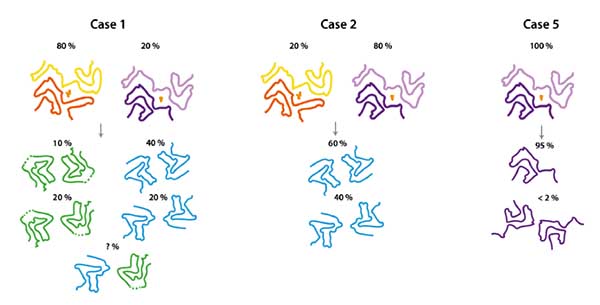
まず彼らは、リコンビナントタウ(297-391)を通常のバッファー(10mM Phosphate buffer(PB), 10mM dithiothreitol, DTT)で700rpmのスピードで振盪させました。
この条件だと、4hでチオフラビンT(ThT)+のフィラメントができはじめ、48h後のcryo-EMでADやCTEと違った形のフィラメントが観察されました。

振盪数を200rpmに落としてみると、フィラメントはゆっくりと形成され、ADタウに近い構造のフィラメントもできてきました。
けれども、変な形のフィラメントの割合も多く、3つや4つのプロトフイブリル(それぞれtriple helical filaments, THFs / quadruple helical filaments, QHFsと命名)で構成された、普通の脳ライセートではまず見られない構造のフィラメントもありました。

塩の検討:MgCl2が良さげ
そこで著者らは、バッファーの塩の種類や濃度etc.の条件を調べてみました。
すると、
- 200mN MgCl2
- 20mN CaCl2
- 0.1 µg/ml dextran sulfate
等の条件で、AD-likeなフィラメントの割合が95%くらいまであがりました。

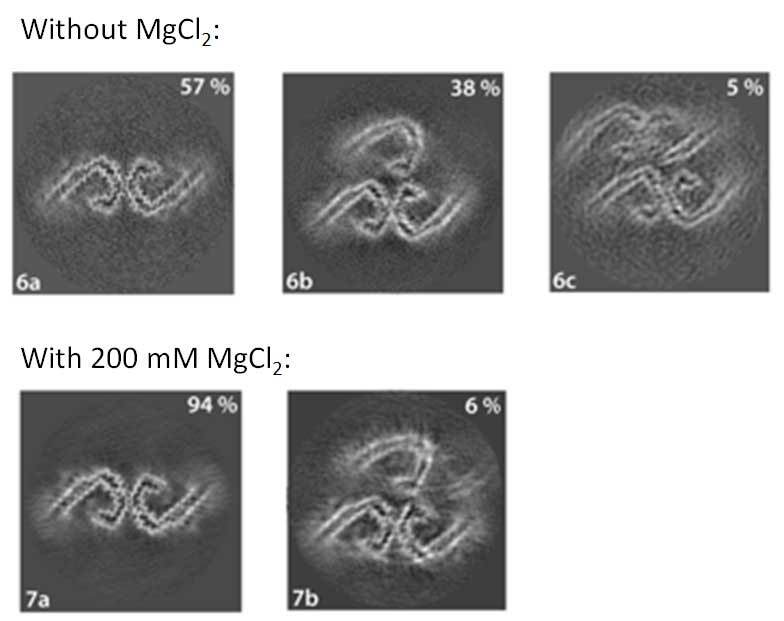
ADタウやCTEタウは3Rタウと4Rタウが50:50の割合で構成されているので、著者らは、R2を除いたタウ266-391を200mM MgCl2ありのバッファーに、3R(266LKHQ269)/4R(297IKHV300)タウを50:50の割合でMgCl2なしのバッファーに入れた状態で振盪させてみました。
結果、MgCl2を入れた方が、ADタウ-likeなC-shapedタウフィラメントの割合が多くなる事がわかりました。
彼らは他にも、
- ZnCl2
- CuCl2
- NaCl
- LiCl
- KCl
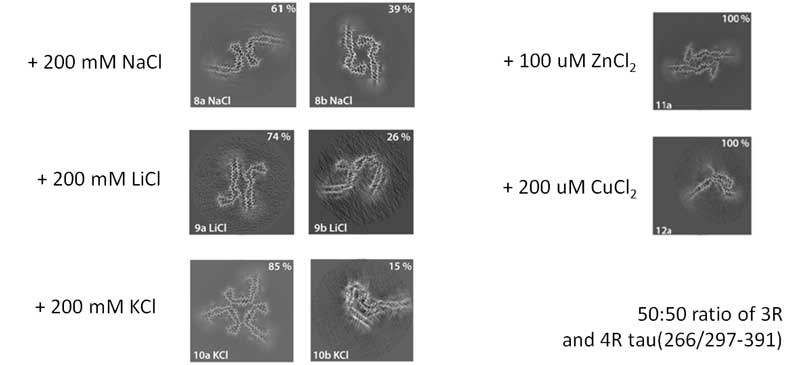
などを添加して条件検討し、それぞれAD-likeタウとは違った形のフィラメントができる事を確認しました。
リコンビナントタウの長さ:フィブリルコアの部分だけで作った方が良さげ
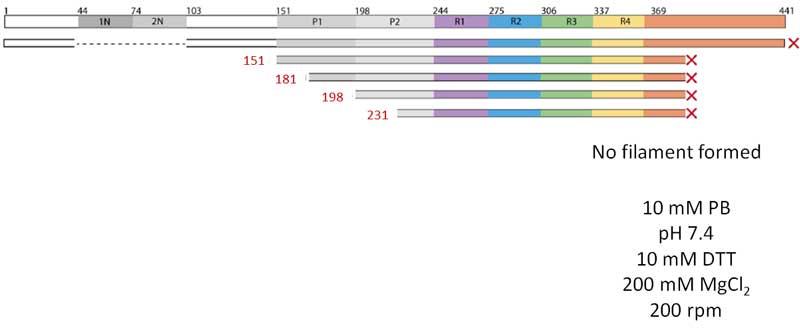
次に彼らは、色々な長さのタウを作って、それぞれどのような形のフィラメントができるか調べてみました。
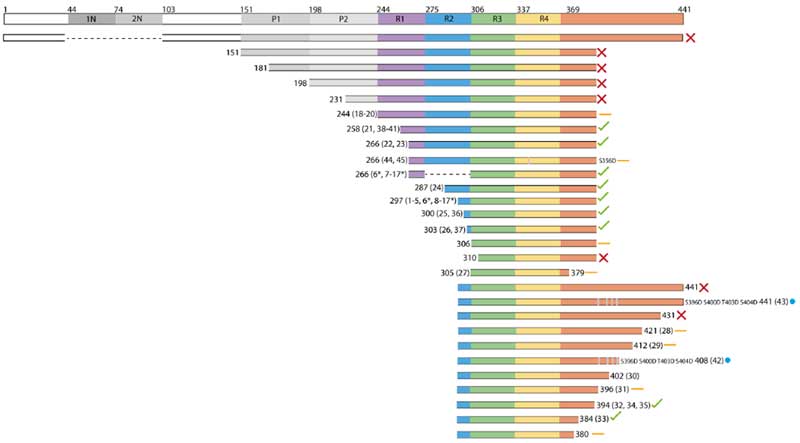
結果、N末側やC末側が含まれているタウはフィラメントを構成せず、fuzzy-coatの部分を入れると凝集化が阻害される事が考えられました。
C末側の場合は少し含まれていてもフィラメントができましたが、形はAD-likeとは言えないものができあがりました。
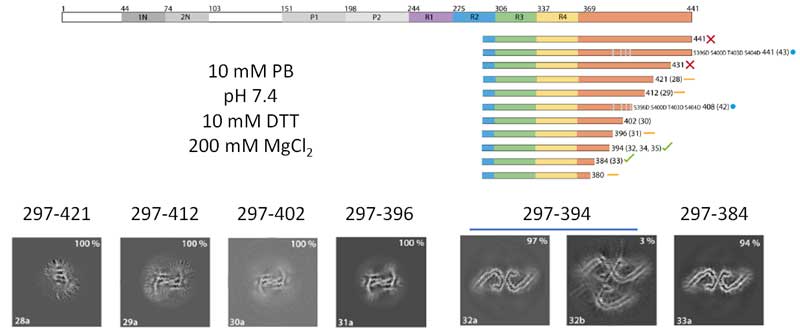
微小管結合領域(microtubule binding domain, MTBD)の部分で作るとフィラメントを作りましたが、R1部分を全部入れるとダメで、

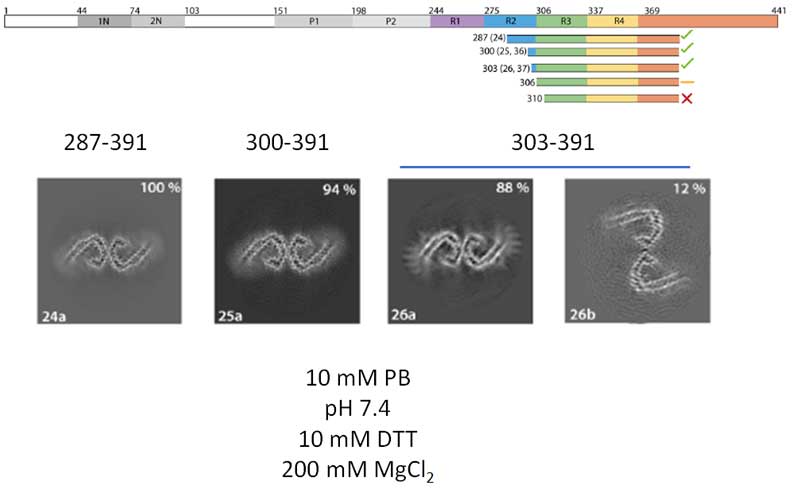
R1のC末側とR4よりC末側を少しずつ残した状態、
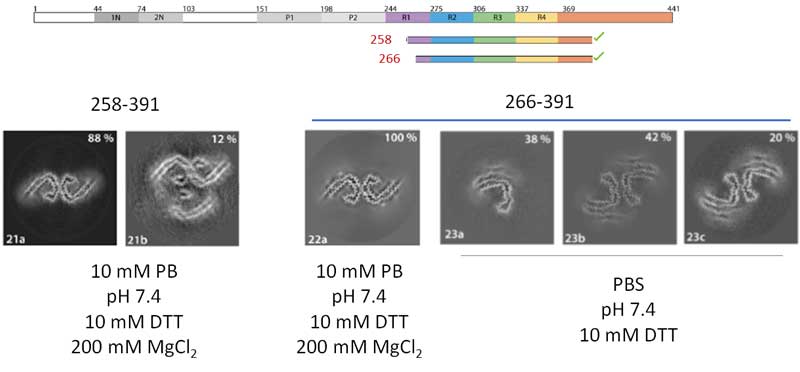
もしくは、R2の途中からR4よりC末側を少し入れた状態で、もっとも効率よくAD-likeなフィラメントを作る事ができました。
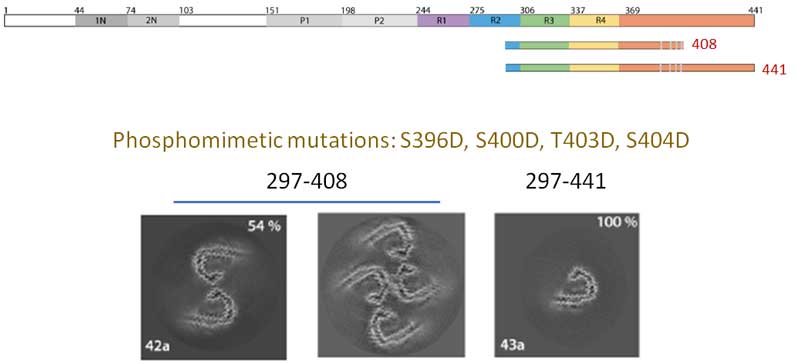
タウのリン酸化で全長タウの凝集化に成功
ADタウは全長でできているのにリコンビナントタウはコア部分で作らないと凝集しないのはなぜでしょうか?
ADタウとリコンビナントタウの大きな違いの1つとして、著者らは、ADタウが色々な部位で過リン酸化している事に着目し、
リコンビナントタウを
- S356D
- S396D
- S400D
- T403D
- S404D
等で疑似リン酸化させて、全長タウが凝集するかどうか調べました。
結果、疑似リン酸化したリコンビナントタウは、構造は違うものの、全長タウでフィラメントを形成したので、
全長タウがAD-likeなタウフィラメントになるための鍵は、タウに多く存在しているリン酸化部位(他の翻訳後修飾も)の可能性が考えられました。

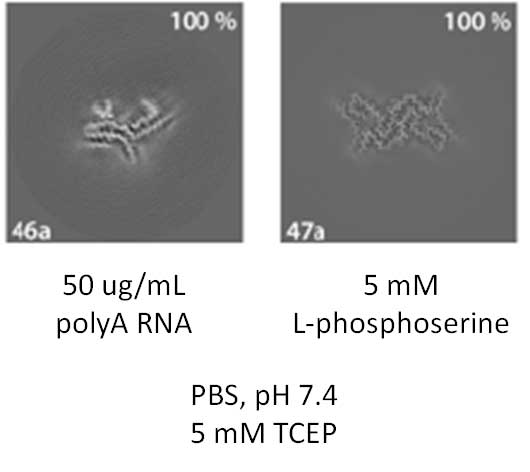
陰イオンのco-factorを入れると全然違うフィラメントができる
タウはそれだけで凝集することが難しいので、ヘパリンやホスホセリン、RNAなどの陰イオンのco-factorを入れて凝集させるのが一般的でした。
けれども、著者らは以前ヘパリンを使ったタウフィラメントは構造が違う事を報告していたので、
他の陰イオンco-factorでタウを凝集させるとどのような構造のフィラメントができるか検証しました。
結果、polyA RNAやL-phosphoserineをco-factorとして使用したタウは、100%違う構造のタウフィラメントになっており、
AD-likeなタウフィラメントを作る為にはco-factorを使用しないほうがよい、という事がわかりました。
My View
Cryo-EMでは、Aβ [10] 、タウ [2, 3, 11, 4, 5, 6] 、α-Syn [12, 13] 、TDP-43 [14] と、変性疾患のkey proteinsのほとんどの構造が解析され(そのほとんどは Drs. Scheres and Goedert グループからの報告)、
「もうそろそろ調べる凝集体も出尽くしたかなー。」
と勝手に思っていたのですが、
今回、
「in vitroで本物に近い構造のタウフィラメントを作るにはどうしたらよいか」
という事に焦点を当てていて、
「まだまだ彼らの研究課題は尽きないんだな。」
と思いました。
以前から、ヘパリンで作ったタウ凝集体は野生型マウスで伝播しにくい事は報告されていましたが [8]、
それはタウ凝集体の取り込みの一端を担っているヘパラン硫酸プロテオグリカンへの結合を阻害する事が原因と考えられていました [8, 15]。
タウ屋以外の人にとってはちょっとマニアックな話かもしれませんが…… タウP301Sのトランスジェニックマウス [1] やタウオパチー [2] [3] の脳から抽出したタウ凝集体を野生型マウスに接種すると、 レシピエントの …
けれども、cryo-EMでみたらヘパリンで作ったらそもそも違う構造の凝集体ができていた、という事がわかり [7]、
「cryo-EMのおかげで、今まで技術的に無理だった事が検証できるようになったんだなー。」
と感銘を受けたのを覚えています。
私自身は、化学の知識は高校で止まっているし、そもそもCryo-EMが使えないしで、自分ではこんな条件検討はできないので、
彼らの論文からいつも多くの情報を頂いていて、ありがたい限りです。
今回は、リコンビナントタウでも条件を変えればAD-likeなタウ凝集体が作れるという事がわかったので、もっと条件検討を重ねたら、いつか本物と同じ構成・構造・機能のタウ凝集体が作れるんじゃないか、と期待が湧きました。
剖検脳が手に入るラボというのはそう多くないので、リコンビナントタウで実験しやすくなれば、研究の裾野も広がり、この分野の研究がぐんと進むんじゃないかと思います。
今回は構造のみで、機能はまったく見ていないので、AD-likeな合成タウ凝集体が細胞系やマウス脳内でどのような動きをするか、続報に期待したいです。
References
- Shi Y, Zhang W, Yang Y, Murzin AG, Falcon B, Kotecha A, van Beers M, Tarutani A, Kametani F, Garringer HJ, Vidal R, Hallinan GI, Lashley T, Saito Y, Murayama S, Yoshida M, Tanaka H, Kakita A, Ikeuchi T, Robinson AC, Mann DMA, Kovacs GG, Revesz T, Ghetti B, Hasegawa M, Goedert M, Scheres SHW. Structure-based classification of tauopathies. Nature. 2021 Oct;598(7880):359-363. doi: 10.1038/s41586-021-03911-7. Epub 2021 Sep 29. PMID: 34588692; PMCID: PMC7611841.
- Fitzpatrick AWP, Falcon B, He S, Murzin AG, Murshudov G, Garringer HJ, Crowther RA, Ghetti B, Goedert M, Scheres SHW. Cryo-EM structures of tau filaments from Alzheimer's disease. Nature. 2017 Jul 13;547(7662):185-190. doi: 10.1038/nature23002. Epub 2017 Jul 5. PMID: 28678775; PMCID: PMC5552202.
- Falcon B, Zhang W, Murzin AG, Murshudov G, Garringer HJ, Vidal R, Crowther RA, Ghetti B, Scheres SHW, Goedert M. Structures of filaments from Pick's disease reveal a novel tau protein fold. Nature. 2018 Sep;561(7721):137-140. doi: 10.1038/s41586-018-0454-y. Epub 2018 Aug 29. PMID: 30158706; PMCID: PMC6204212.
- Falcon B, Zivanov J, Zhang W, Murzin AG, Garringer HJ, Vidal R, Crowther RA, Newell KL, Ghetti B, Goedert M, Scheres SHW. Novel tau filament fold in chronic traumatic encephalopathy encloses hydrophobic molecules. Nature. 2019 Apr;568(7752):420-423. doi: 10.1038/s41586-019-1026-5. Epub 2019 Mar 20. PMID: 30894745; PMCID: PMC6472968.
- Zhang W, Tarutani A, Newell KL, Murzin AG, Matsubara T, Falcon B, Vidal R, Garringer HJ, Shi Y, Ikeuchi T, Murayama S, Ghetti B, Hasegawa M, Goedert M, Scheres SHW. Novel tau filament fold in corticobasal degeneration. Nature. 2020 Apr;580(7802):283-287. doi: 10.1038/s41586-020-2043-0. Epub 2020 Feb 12. PMID: 32050258; PMCID: PMC7148158.
- Shi Y, Murzin AG, Falcon B, Epstein A, Machin J, Tempest P, Newell KL, Vidal R, Garringer HJ, Sahara N, Higuchi M, Ghetti B, Jang MK, Scheres SHW, Goedert M. Cryo-EM structures of tau filaments from Alzheimer's disease with PET ligand APN-1607. Acta Neuropathol. 2021 May;141(5):697-708. doi: 10.1007/s00401-021-02294-3. Epub 2021 Mar 16. Erratum in: Acta Neuropathol. 2021 Apr 8;: PMID: 33723967; PMCID: PMC8043864.
- Zhang W, Falcon B, Murzin AG, Fan J, Crowther RA, Goedert M, Scheres SH. Heparin-induced tau filaments are polymorphic and differ from those in Alzheimer's and Pick's diseases. Elife. 2019 Feb 5;8:e43584. doi: 10.7554/eLife.43584. PMID: 30720432; PMCID: PMC6375701.
- Guo JL, Narasimhan S, Changolkar L, He Z, Stieber A, Zhang B, Gathagan RJ, Iba M, McBride JD, Trojanowski JQ, Lee VM. Unique pathological tau conformers from Alzheimer's brains transmit tau pathology in nontransgenic mice. J Exp Med. 2016 Nov 14;213(12):2635-2654. doi: 10.1084/jem.20160833. Epub 2016 Oct 17. PMID: 27810929; PMCID: PMC5110027.
- Lövestam S, Koh FA, van Knippenberg B, Kotecha A, Murzin AG, Goedert M, Scheres SHW. Assembly of recombinant tau into filaments identical to those of Alzheimer's disease and chronic traumatic encephalopathy. Elife. 2022 Mar 4;11:e76494. doi: 10.7554/eLife.76494. Epub ahead of print. PMID: 35244536.
- Yang Y, Arseni D, Zhang W, Huang M, Lövestam S, Schweighauser M, Kotecha A, Murzin AG, Peak-Chew SY, Macdonald J, Lavenir I, Garringer HJ, Gelpi E, Newell KL, Kovacs GG, Vidal R, Ghetti B, Ryskeldi-Falcon B, Scheres SHW, Goedert M. Cryo-EM structures of amyloid-β 42 filaments from human brains. Science. 2022 Jan 14;375(6577):167-172. doi: 10.1126/science.abm7285. Epub 2022 Jan 13. PMID: 35025654; PMCID: PMC7612234.
- Falcon B, Zhang W, Schweighauser M, Murzin AG, Vidal R, Garringer HJ, Ghetti B, Scheres SHW, Goedert M. Tau filaments from multiple cases of sporadic and inherited Alzheimer's disease adopt a common fold. Acta Neuropathol. 2018 Nov;136(5):699-708. doi: 10.1007/s00401-018-1914-z. Epub 2018 Oct 1. PMID: 30276465; PMCID: PMC6208733.
- Morgan SA, Lavenir I, Fan J, Masuda-Suzukake M, Passarella D, DeTure MA, Dickson DW, Ghetti B, Goedert M. α-Synuclein filaments from transgenic mouse and human synucleinopathy-containing brains are major seed-competent species. J Biol Chem. 2020 May 8;295(19):6652-6664. doi: 10.1074/jbc.RA119.012179. Epub 2020 Mar 24. PMID: 32209651; PMCID: PMC7212628.
- Schweighauser M, Shi Y, Tarutani A, Kametani F, Murzin AG, Ghetti B, Matsubara T, Tomita T, Ando T, Hasegawa K, Murayama S, Yoshida M, Hasegawa M, Scheres SHW, Goedert M. Structures of α-synuclein filaments from multiple system atrophy. Nature. 2020 Sep;585(7825):464-469. doi: 10.1038/s41586-020-2317-6. Epub 2020 May 27. PMID: 32461689; PMCID: PMC7116528.
- Li Q, Babinchak WM, Surewicz WK. Cryo-EM structure of amyloid fibrils formed by the entire low complexity domain of TDP-43. Nat Commun. 2021 Mar 12;12(1):1620. doi: 10.1038/s41467-021-21912-y. PMID: 33712624; PMCID: PMC7955110.
- Masuda-Suzukake M, Suzuki G, Hosokawa M, Nonaka T, Goedert M, Hasegawa M. Dextran sulphate-induced tau assemblies cause endogenous tau aggregation and propagation in wild-type mice. Brain Commun. 2020 Jul 8;2(2):fcaa091. doi: 10.1093/braincomms/fcaa091. PMID: 33005889; PMCID: PMC7519727.