同じアルツハイマー病(Alzheimer's disease, AD) でも、進行の早い人と遅い人がいるのはなぜ?
マサチューセッツ工科大学(MIT)/ハーバード大学のHymanらの研究グループは、進行の早い人ADと多いADのサンプルを生化学的に解析し、その理由を追求しました [1]。
A molecular analysis of tau from patients with sporadic Alzheimer’s disease reveals striking diversity in biochemical properties between patients, which influences seeding activity and correlates with the aggressiveness of the disease.
同じADでも病気の進行が早かったり遅かったりするのはなぜ?
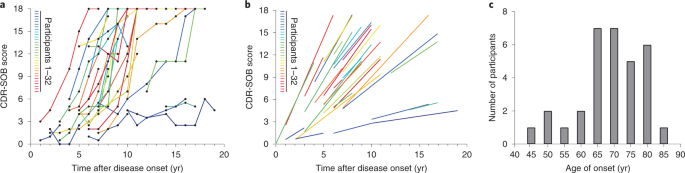
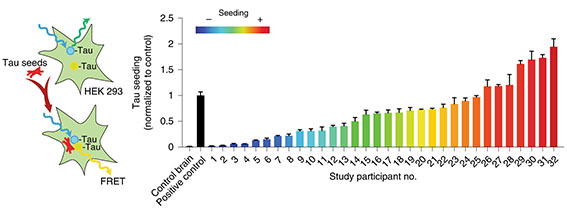
AD進行の多様性について調べるため、著者らは32人のADの剖検脳からタウタンパクを抽出した。
彼らが以前確立したタウシーディングアッセイ
(YFP-tauとGFP-tauをトランスダクションしたHEK293に、抽出したタウシードをかけてFRETで凝集能をみる系)
で32人のサンプルを確認したところ、
タウシード形成能は症例間で大きなばらつきを認めた。
この結果を元に、
- Lowシード群
- Moderateシード群
- Highシード群
に分けたところ、
Highシード群にはPSEN2変異(c.811C>T, p.I271E)が1人含まれており、またAPOE4保有者が多く含まれていた。
プライマリーニューロンやP301Sマウスへそれぞれ抽出したタウを接種すると、
Highシード群のタウがin vitroでもin vivoでもタウ伝播能が強い、という結果になった。
シード形成能の強さはどこからくるのか?
彼らは、size-exclusion chromatography (SEC), プロテアーゼ処置、alphaLISA、mass spectrometory等で検証した。
全体のタウ量は、症例毎に様々だったが、
Highシード群では特に、high molecular weightのタウのオリゴマーが増えていた。
また、Lowシード群とHighシード群では、
- Lowシード群でリン酸化↑:Ser198/Ser199/Ser202/Ser400/Ser404
- Highシード群でリン酸化↑:Ser231/Ser235/Ser262
と、多くリン酸化されている部位に違いがあった。
これらの結果から、
- 同じADでもタウのシード形成能に違いがあり、それがADの進行に影響している可能性
- シード形成能の違いには、タウオリゴマー量の違いが関係している可能性
- タウオリゴマー量の違いは、リン酸化等の翻訳後修飾(post-translational modification, PTM)が影響している可能性
等が考えられた。
My View
Hyman研からの報告。
臨床でADの患者さん達を診察していても、
ある方は何年も認知機能が安定しているのに対し、
ある方は数ヶ月単位で認知機能が低下していく、
というように、症例によってかなりばらつきがあることは感じていました。
今回の報告では、それがタウのPTM→オリゴマー量→シード形成能の違いが関連しているんじゃないか、と示唆する内容でした。
今まで報告されてきた研究結果とも矛盾しない内容だと思います。
ただ、彼らの主張する可能性オリゴマーは、抽出方法だけから考えると、私達が不溶性フィブリルと呼んでいるものと一致するようですが……
まだ定義が完全には統一されていないようです。
以前AD-tauのCryoEMの報告でも、フィブリルの多様性は指摘されていたし [2]、
神経原線維変化のmaturationの過程でタウの構造が変化していく様子も報告されているので [3, 4, 5, 6] 、
同じADでも色々な構造のタウが存在していることはほぼ間違いないように思います。
個人的に興味があったのは、APOE4の保有率とリン酸化部位の違いについて。
APOE4とAβ/タウには様々な機能面から関係性が示唆されていますが、
今回の結果からは、APOE4→タウの凝集亢進、という事を示唆する結果の一つになると思います。
あと、タウのリン酸化部位に関してですが、
以前同じ研究室から、Primary age-related tauopathy(PART)とLow ADを比較する論文が報告されていて、
PARTではS199のリン酸化がLow ADより多い、という結果が出ていました [7]。
今回Lowシード群とHighシード群の比較で、Lowシード群でSer199のリン酸化が多いとなっていました。
pS199抗体は何度か使用しましたが、High ADを染めても染まりが悪いなと思っていました。
抗体のせいかと思っていましたが、もしかしたらLow ADやPARTの方がよく染まっていたのかもしれません。
もう一度見直してみようと思います。
References
- Dujardin, S., Commins, C., Lathuiliere, A. et al. Tau molecular diversity contributes to clinical heterogeneity in Alzheimer’s disease. Nat Med (2020). https://doi.org/10.1038/s41591-020-0938-9
- Fitzpatrick AWP, Falcon B, He S, et al. Cryo-EM structures of tau filaments from Alzheimer's disease. Nature. 2017;547(7662):185-190. doi: 10.1038/nature23002
- García-Sierra F, Ghoshal N, Quinn B, Berry RW, Binder LI. Conformational changes and truncation of tau protein during tangle evolution in Alzheimer's disease. J Alzheimers Dis. 2003;5(2):65-77. doi: 10.3233/jad-2003-5201
- Luna-Muñoz J, García-Sierra F, Falcón V, Menéndez I, Chávez-Macías L, Mena R. Regional conformational change involving phosphorylation of tau protein at the Thr231, precedes the structural change detected by Alz-50 antibody in Alzheimer's disease. J Alzheimers Dis. 2005;8(1):29-41. doi: 10.3233/jad-2005-8104
- Binder LI, Guillozet-Bongaarts AL, Garcia-Sierra F, Berry RW. Tau, tangles, and Alzheimer's disease. Biochim Biophys Acta. 2005;1739(2-3):216-223. doi: 10.1016/j.bbadis.2004.08.014
- Luna-Muñoz J, Chávez-Macías L, García-Sierra F, Mena R. Earliest stages of tau conformational changes are related to the appearance of a sequence of specific phospho-dependent tau epitopes in Alzheimer's disease. J Alzheimers Dis. 2007;12(4):365-375. doi: 10.3233/jad-2007-12410
- Bennett RE, DeVos SL, Dujardin S, et al. Enhanced Tau Aggregation in the Presence of Amyloid β. Am J Pathol. 2017;187(7):1601-1612. doi: 10.1016/j.ajpath.2017.03.011