パーキンソン病(Parkinson's disease, PD)は、黒質緻密部(substantia nigra pars compacta, SNc)のドパミン(DA)神経細胞が障害され、それに伴って振戦・固縮・動作緩慢・姿勢反射障害などのパーキンソン運動神経症状が現れます。
なぜこの部分のDA神経が最も障害されやすいかについては酸化ストレス [1] やカルシウム代謝 [2] 、投射先の多さやエネルギー消費 [3] など諸説ありますが、まだ完全には解明されていません。
今回、アメリカ・マサチューセッツ工科大学(Massachusetts Institute of Technology, MIT)のDr. Macoskoらの研究グループは、シングルセルRNAシークエンスとスライドシークエンスを使って、
「SNcの腹側にある、あるサブグループのDA神経がPD関連神経変性と強い関係がある」
という事を報告しました [4] 。
黒質ドパミン神経細胞の中でも、パーキンソン病で特にやられやすいサブタイプ
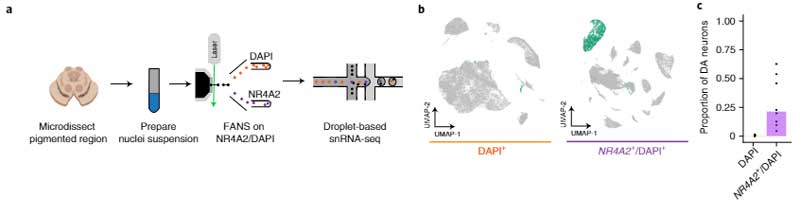
剖検脳からDA神経細胞を単離
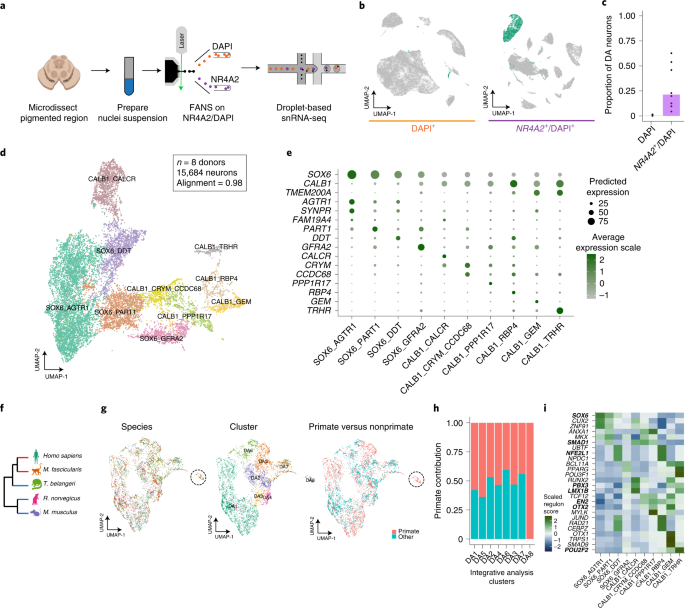
PD特異的なDA神経細胞のプロファイルを調べるため、彼らはまず、健常人8人の剖検脳の黒質から神経核を単離し、哺乳類の中脳DA神経細胞特異的マーカーのNr4α2遺伝子をターゲットにして、florescence-activated nuclei sorting (FANS) という方法でDA神経を抽出しました。
この方法で、彼らは387,483個の核から22,048個のDA神経細胞を採取し、通常よりも70倍多くのDA神経細胞を採取することができました。
DA神経細胞に10のサブタイプ
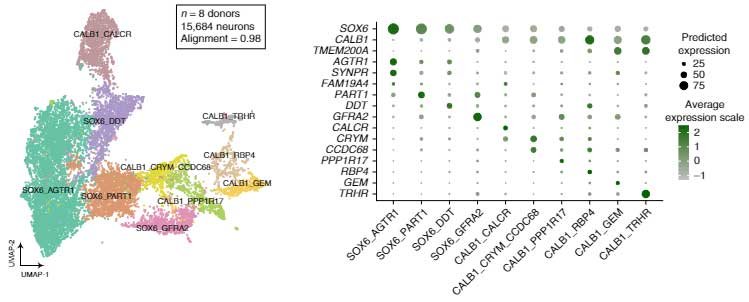
採取した神経細胞核でシングル核RNAシークエンス(snRNA-seq)を行い、LIGERという方法で検証した所、DA神経細胞には、発現マーカーの強さによって、10種類のサブタイプに分類できました。
- SOX6_AGTR1
- SOX6_PART1
- SOX6_DDT
- SOX6_GFRA2
- CALB1_CALCR
- CALB1_CRYM_CCCDC68
- CALB1_PPP1R17
- CALB1_RBP4
- CALB1_GEM
- CALB1_TRHR
10サブタイプのうち4つはSOX6の発現が高く、6つはCALB1を発現しており、DA神経細胞の成熟度によって分かれているように見受けられました。
この10サブタイプのうち、DA8グループに属するCALB1_GEMタイプは、ヒトとマカクザルにのみ保存されており、マウスやラットには見られませんでした。
さらに詳しく調べると、げっ歯類のDA神経細胞には、Fam83bとGemの遺伝子が発現していないことがわかりました。
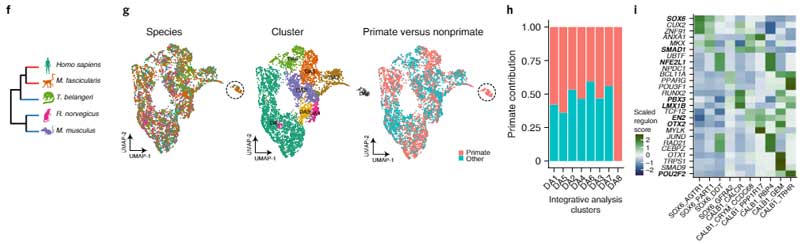
DA神経細胞のサブタイプ毎の局在
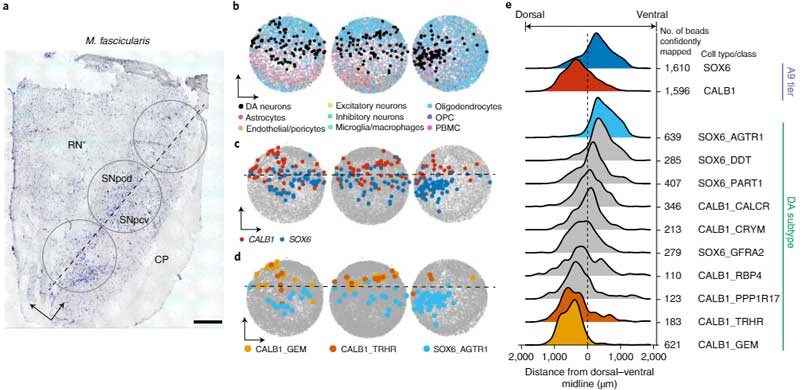
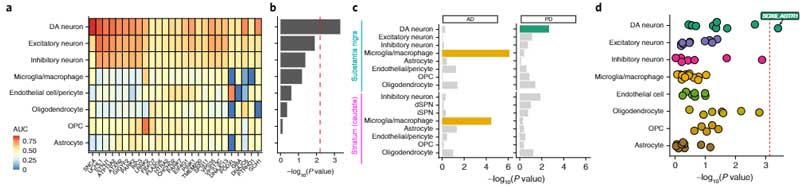
次に彼らは、Slide-seqという方法で、SNcに存在しているDA神経細胞のそれぞれの遺伝子発現のポピュレーションを調べ、sn-RNAseqで明らかになった10のサブタイプのDA神経がそれぞれどのあたりに位置しているのかを調べました。
SNcのA9細胞(黒質のDA神経)は遺伝子発現によって簡単に可視化でき、さらにそれを腹側/背側・前/中/後の6箇所に分けると、
- SOX6_AGTR1のグループは腹側側
- CALB1_GEMとGLAB1_TRHRのグループは背側側
に多く存在していることがわかりました。

PDで脆弱性の高いDA神経細胞は SOX6+AGTR+
PDでは腹側SNcのDA神経が特に変性しやすいので、この部分に多いSOX6_AGTR1細胞群が、PDで特に障害されているかどうか、レヴィ小体病10人(PD 7人、レヴィ小体型認知症(Lewy body dementia, LBD)3人)のSNcから202,810個の核(うち6,343個はDA神経細胞核)を抽出し、コントロール脳と同様の方法で調べてみました。
バルクで調べた所、7つの細胞種で68のサブポピュレーションを同定しました。
PD/DLBでは、DA神経が減少しており、特にSOX6_AGTR1サブグループのDA神経が著明に減少していました。
一方で、CALB1_GEMとCALB1_TRHRサブグループのDA神経は、相対的に増加していました。
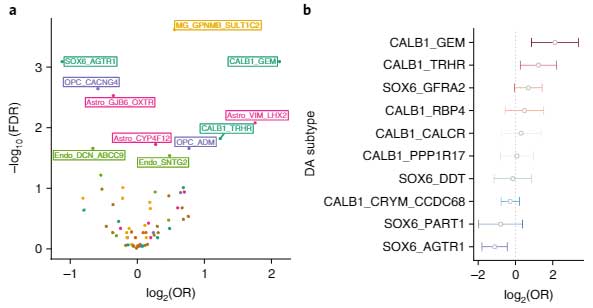
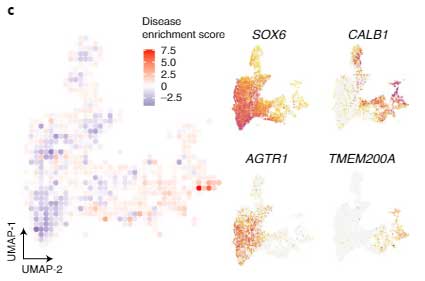
他の測定方法でPD/DLB特異的な増加・減少を可視化すると、
- PD/DLBで減少しているDA神経は、SOX6とARTR1を多く発現
- PD/DLBで増加しているDA神経は、CALB1とTMEM200Aを多く発現
という傾向があることがわかりました。
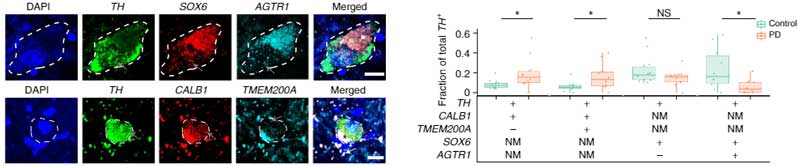
さらに、Single molecule Fluorescence In Situ Hybridization(smFISH)で20症例のPD剖検脳を調べた所、
- CLAB1+/TMEM200A+DA神経はPDで相対的に多い
- SOX6_AGTRサブタイプDA神経はPDで減少
という結果が得られました。
PDに共通の遺伝子多型はSOX6_AGTR1 DA細胞に集中
さらに彼らは、既知のPD関連変異/多型の遺伝子がどの細胞に多く発現しているのか調べました。
すると、PDリスク多型は、SOX6_AGTR1サブタイプのDA細胞に集中しており、
「PDで特に障害されやすい細胞群には、PD関連多型の遺伝子が多く発現している」
という、面白い結果が得られました。
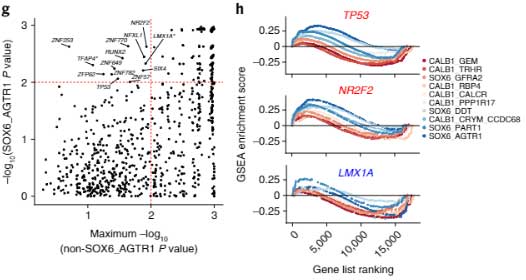
DA細胞変性に関与していそうな転写因子
最後に、SOX6_AGTR1細胞群で特異的に変化した遺伝子制御プログラムを調べるため、既知の転写因子ターゲットの遺伝子セット濃縮解析(gene set enrichment analysiss, GSEA)を行いました。
SOX6_AGTR1集団で有意に濃縮されている転写因子は全部で13あり、
- 中脳DA神経の発生分化に関与する転写因子の遺伝子LMX1Aによってコードされる転写因子のターゲットが枯渇
- TP53とその転写産物はSOX6_AGTR1集団で発現が上昇
- NR2F2とその転写産物はSOX6_AGTR1集団で発現が上昇
という結果が得られ、TP53とNR2F2はPDのマウスモデルで中脳DAの神経変性を調整する転写因子として知られていました [5, 6, 7]。
・
・
・
以上の結果から、
- PD/DLBでは、黒質緻密部のドパミン神経細胞のなかでも特に SOX6+AGTR1+ の細胞群が選択的に変性しており、これらの細胞群は黒質緻密部腹側に多い。
- 逆に、CALB1+TMEM200A+ の細胞群はPD/DLBでも比較的保たれており、これらの細胞群は黒質緻密部背側側に多い。
- 既知のPDのリスク多型関連遺伝子は、SOX6+AGTR+細胞群に濃縮されている
- SOX6_AGTR1神経群では、TP53とNR2F2転写因子とその転写産物の発現が上昇しており、PD/DLBでの神経変性機序に関与している可能性がある。
という事が示唆されました。
The authors used single-cell genomics to profile thousands of human dopamine neurons and identify one uniquely Parkinson’s disease-susceptible population, which was enriched for genetic risk for Parkinson’s disease.
My View
以前から、PDではSNcの中でも特に腹側の、外側1/2が障害されやすいと報告されていましたが [8]、
今回は、まずSNcのDAニューロンを遺伝子発現から10種類のサブグループに分け、さらにSlide-seqで実際にそれらの細胞群がどのあたりに位置しているのかを当てはめ、その結果、特にPD/DLBで障害の強い神経細胞群を特定していました。
MITの各技術もさる事ながら、1つ1つの解析が手堅い印象で、すごいなーと思いました。
今回同定したサブグループや、そこで特に動いている転写因子などをさらに深く調べる事で、PD/DLBのSNc神経変性を止める方法が見つかるかもしれません。
実験系でよくわからなかったのは、最初のDA神経抽出段階のFANSの手法について。
今回は、Nr4a2という転写因子をターゲットに中脳DA神経を捕まえています。
転写因子なので、活性化すると核内に入って転写ターゲットに結合するって認識だったのですが、
核膜を壊しちゃったら個体として回収できないですし、どうやって核内のNr4aに蛍光蛋白を結合させるのか謎でした。
ただUniprotでみたら、"Nr4aは、普段ほとんど核にいて、酸化ストレスに細胞質に局在する" って書いてあったので、核表面にも発現しているって事かもしれません。
ちょっと自信ないので、このあたりに詳しい人がいたら教えてください。
References
- Dias V, Junn E, Mouradian MM. The role of oxidative stress in Parkinson's disease. J Parkinsons Dis. 2013;3(4):461-491. doi: 10.3233/JPD-130230
- Kamath T, Abdulraouf A, Burris SJ, Langlieb J, Gazestani V, Nadaf NM, Balderrama K, Vanderburg C, Macosko EZ. Single-cell genomic profiling of human dopamine neurons identifies a population that selectively degenerates in Parkinson's disease. Nat Neurosci. 2022 May;25(5):588-595. doi: 10.1038/s41593-022-01061-1. Epub 2022 May 5. PMID: 35513515; PMCID: PMC9076534.
- Mamelak M. Parkinson's Disease, the Dopaminergic Neuron and Gammahydroxybutyrate. Neurol Ther. 2018 Jun;7(1):5-11. doi: 10.1007/s40120-018-0091-2. Epub 2018 Jan 24. PMID: 29368093; PMCID: PMC5990513.
- Chan CS, Gertler TS, Surmeier DJ. Calcium homeostasis, selective vulnerability and Parkinson's disease. Trends Neurosci. 2009;32(5):249-256. doi: 10.1016/j.tins.2009.01.006
- da Costa CA, Sunyach C, Giaime E, West A, Corti O, Brice A, Safe S, Abou-Sleiman PM, Wood NW, Takahashi H, Goldberg MS, Shen J, Checler F. Transcriptional repression of p53 by parkin and impairment by mutations associated with autosomal recessive juvenile Parkinson's disease. Nat Cell Biol. 2009 Nov;11(11):1370-5. doi: 10.1038/ncb1981. Epub 2009 Oct 4. PMID: 19801972; PMCID: PMC2952934.
- Qi X, Davis B, Chiang YH, Filichia E, Barnett A, Greig NH, Hoffer B, Luo Y. Dopaminergic neuron-specific deletion of p53 gene is neuroprotective in an experimental Parkinson's disease model. J Neurochem. 2016 Sep;138(5):746-57. doi: 10.1111/jnc.13706. Epub 2016 Jul 15. PMID: 27317935; PMCID: PMC5155515.
- Kao CY, Xu M, Wang L, Lin SC, Lee HJ, Duraine L, Bellen HJ, Goldstein DS, Tsai SY, Tsai MJ. Elevated COUP-TFII expression in dopaminergic neurons accelerates the progression of Parkinson's disease through mitochondrial dysfunction. PLoS Genet. 2020 Jun 24;16(6):e1008868. doi: 10.1371/journal.pgen.1008868. PMID: 32579581; PMCID: PMC7340320.
- Alexander GE. Biology of Parkinson's disease: pathogenesis and pathophysiology of a multisystem neurodegenerative disorder. Dialogues Clin Neurosci. 2004;6(3):259-280. doi: 10.31887/DCNS.2004.6.3/galexander