タンパク質は、通常、20種類のアミノ酸がバランス良く含まれている事が多く、それらのタンパク質はAnfinsenのドグマに従い、特定の構造に折りたたまれます。
しかしながら、20%程度のタンパク質の中には、限られた種類のアミノ酸のみで構成された領域がみられ、これらは低複雑性ドメイン(low-complexity domain, LCD)と呼ばれています。
このLCDは、細胞内での液液相分離(liquie-liquid phase separation, LLPS)に大きく関与している事がわかっており [1, 2, 3]、TDP-43や fused in sarcoma (FUS) の凝集体形成の鍵となる可能性もあることから、最近よく注目されていると思います。
今回、アメリカ・テキサス大学の Dr. Liszczak, Dr. McKnight らの研究グループは、LCD間のアミノ酸主鎖の水素結合が、LLPSや凝集体形成に関与する、という内容を報告しました [4] 。

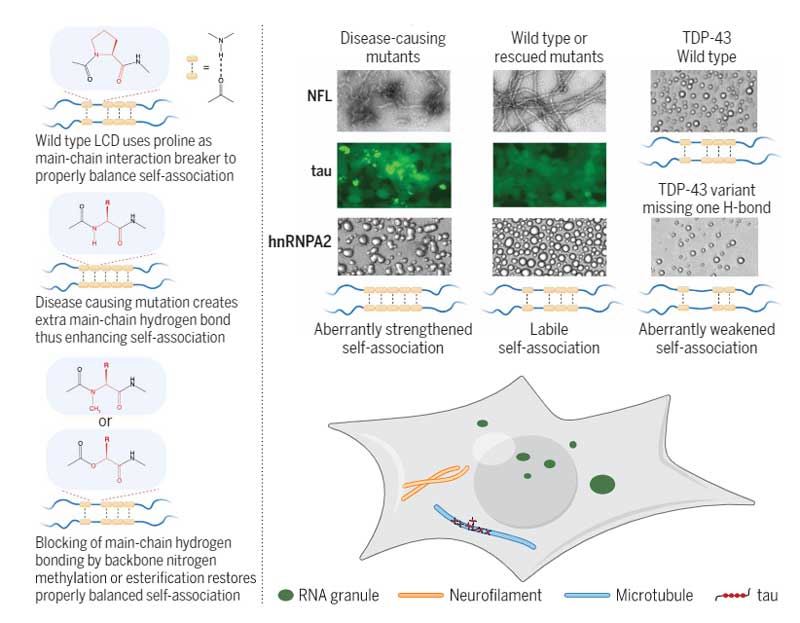
低複雑性ドメインのアミノ酸主鎖同士の水素結合が、特定のタンパクの液液相分離および凝集化に関与
TDP-43のLCD間水素結合を阻害すると、液滴が減る
アミノ酸主鎖のN-メチル化で水素結合を阻害
彼らはまず、TDP-43のLCドメインの各アミノ酸のNH基のHをメチル基に置き換え(N-メチル化)て、その部分で水素結合が起こらないようにしたTDP-43 LCDペプチドを精製しました。
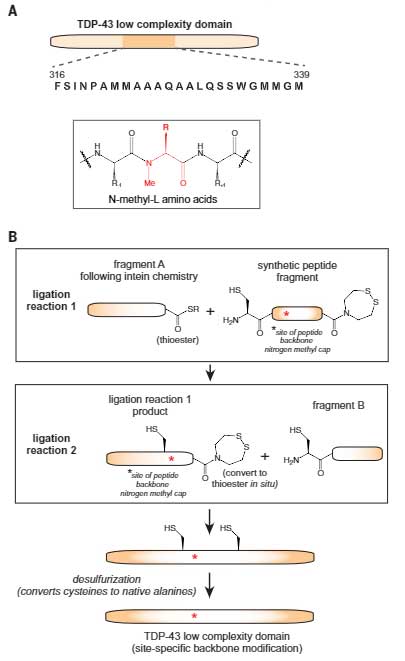
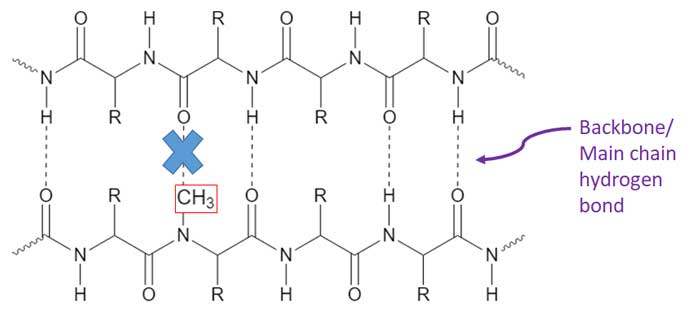
通常のTDP-43 LCDと、23種類のサイト特異的メチル化LCDを、濃度を振った尿素を加えたLLPSバッファーに加え、LLPSの起こり方を比較検討しました。
結果、324AをN-メチル化(324 meA)したTDP-43 LCDは、野生型や337meMのTDP-43 LCDより低濃度の尿素でLLPSが阻害されました。
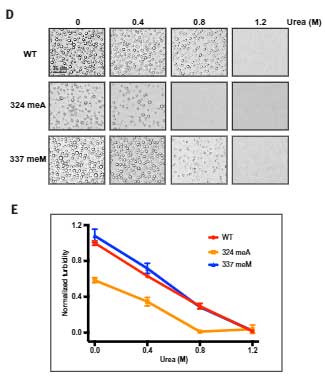
全ての部分の変異LCDを確認したところ、A321からA329のN-メチル化でLLPSが形成されにくくなっていました。
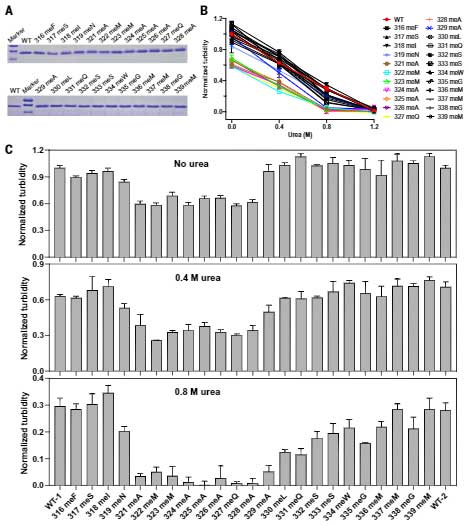
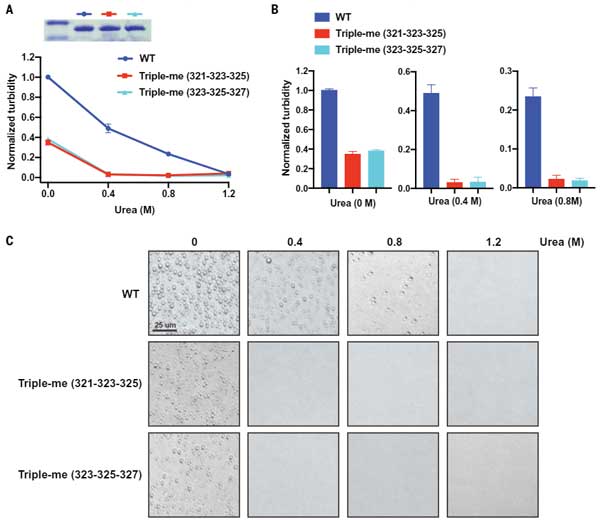
また、3箇所のアミノ酸をN-メチル化(231-232-325と323-325-327)すると、LLPS形成は更に弱まりました。
TDP-43 LCD内の、321aaから326aaのヘキサペプチドは、主鎖同士の水素結合の力でβシート構造をとる事が報告されており [5]、
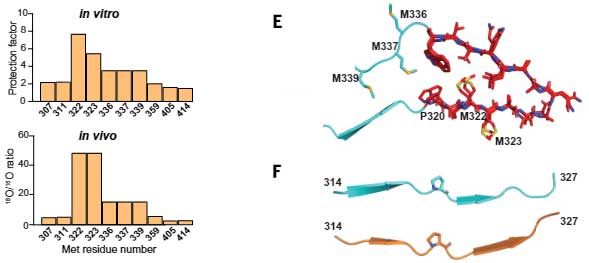
TDP-43 LCD同士の水素結合が、LLPS形成とクロスβシート構造形成の関係に何かしら影響している可能性が考えられました。
アミノ酸の側鎖もTDP-43 LCDの液滴形成に重要
アミノ酸同士の水素結合がTDP-43 LCDの液滴形成に重要であることがわかったので、今度は、TDP-43 LCDの各アミノ酸を、構造が単純なグリシンに置換してみました。
結果、TDP-43 LCDのA324からL330のグリシン置換で、不定形に沈殿するか、変な形の液滴が形成され、この部分は、N-メチル化による水素結合阻害でももっとも影響の大きかった領域でした。
TDP-43 LCDのC末側では、もともとグリシンだった2アミノ酸をセリンに変えると、異常な液滴が形成されました。
TDP-43 LCDのN末側では、N319GとP320Gで液滴形成に変化が起こりました。
特にP320Gでは、バッファーに入れた途端に不定形の沈殿を起こしました。

以上の結果から、TDP-43 LCDの液滴形成には、いくつかのアミノ酸の側鎖が重要な役割を果たしていると考えられました。
TDP-43 LCDのP320は液滴液性に重要
LCDのアミノ酸のうち、P320Gが最も液滴形成に影響があったので、著者らは
- TDP-43のLCD以外の領域にある他のプロリンをグリシンに置換(P280G, P349G, P363G)
- ALSのリスクとなるM337V変異
の液滴形成への影響も調べてみました。
結果、P320以外のプロリンをグリシンに変えても液滴形成に影響はなく、「LCD内のプロリンが重要」だということがわかりました。
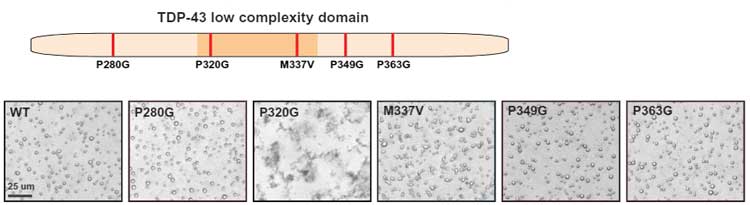
なんでこんなに強力なP320がALSなどのTDP-43プロテイのパチーのリスク変異として報告がなかったのか不思議ですが、
これらの変異TDP-43を細胞に強制発現したところ、P320Gの強制発現で極端に細胞の生存率が悪くなっており、P320の変異は変化が強力過ぎて細胞が生きられないからだと考えられました。
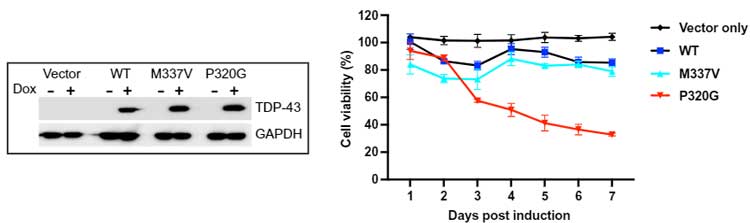
P320をグリシンだけではなくセリンやアラニンに変えても、液滴形成は激しく変化し、P320がプロリンであることが大切だと考えられました。
P320GとP320SをN-メチル化してみると、液滴形成が改善し、このP320のアミノ酸置換による液滴形成障害は、アミノ酸同士の水素結合が関与しているものと考えられました。

NFLのフィラメント形成にも水素結合が関与
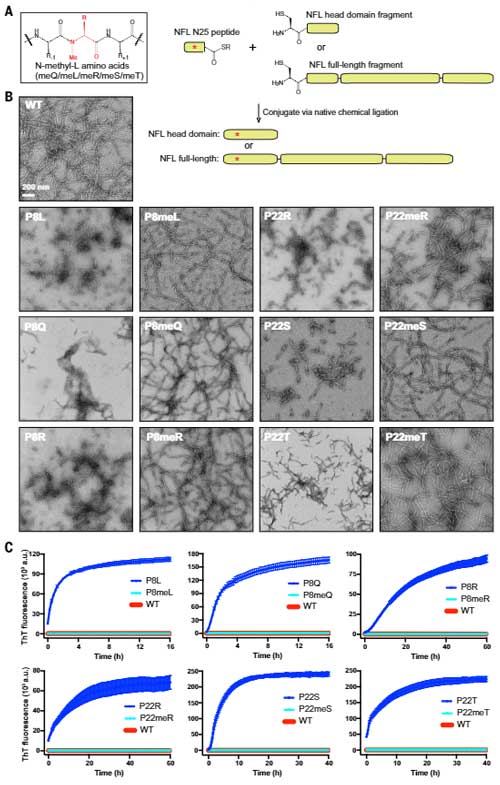
TDP-43以外の他のタンパク凝集にも水素結合が関与しているのかどうかを調べるため、次に著者らは、シャルコー・マリー・トゥース病(Charcot-Marie-Tooth, CMT)の原因遺伝子の一つであるニューロフィラメント軽鎖(neurofilament light chain, NfL)でも同様の実験をしてみました。
これまで、NFLタンパクの2箇所のプロリンの変異でCMTが発症することが報告されています [6, 7]。
すると、P8とP22を他のアミノ酸に置換した時に、フィラメント形成が障害されて凝集体を形成し、これはN-メチル化で改善しました。
タウの凝集体形成にも水素結合が関与
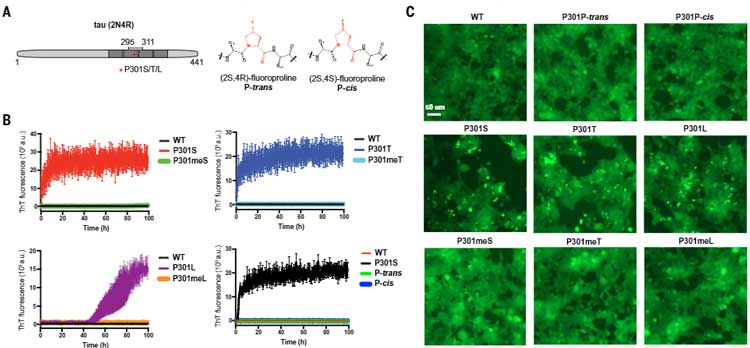
さらに著者らは、同じくLLPSを形成するタウに着目しました。
タウの家族性前頭側頭葉認知症変異の一つにP301の変異(P301L, P301S, P301T)があり [8, 9, 1, 11] 、やはりプロリンの変異による影響が大きそうです。
著者らは、タウの295-311ペプチドを使ってチオフラビンアッセイを行い、P301S, P301T, P301Lのいずれでも凝集体形成が促進さることを確認しました。
この現象に水素結合が関係しているか調べるため、それぞれの変異の場所をN-メチル化したところ、見事に凝集体形成が抑えられ、タウタンパクの不溶化にもアミノ酸主鎖同士の水素結合が関係していると考えられました。
hmRNPA2の凝集化にも水素結合が関与
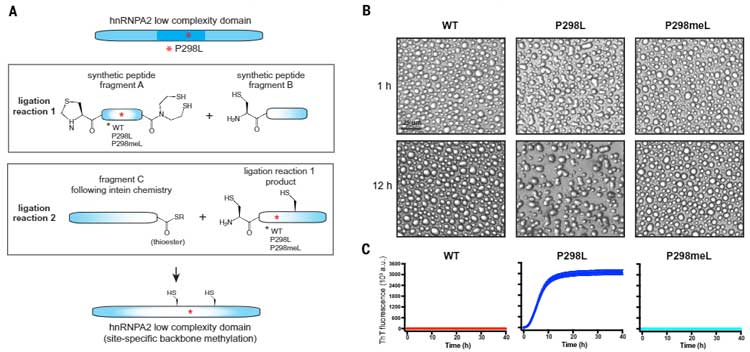
最後に著者らは、パジェット病の原因遺伝子であるhmRNPA2のP298変異に着目しました。
この変異はLCD領域内にあり、クロスβシート構造の中に位置することも知られています [12, 13, 14]。
で、これまでの結果と同様にhnRNPA2のP298L変異で変な形のドロップレットを生じ、凝集化が促進されましたが、
これはP298LのN-メチル化で改善しました。
・
・
・
以上の結果から、
- いくつかの疾患におけるタンパクのLLPSおよびβシート形成に、LCD領域のアミノ酸主鎖同士の水素結合が重要な役割を果たしている
- TDP-43、NfL、タウ、hmRNPA2の疾患関連変異は、主鎖同士の水素結合が強まることでタンパク同士の集簇程度が変化する
- 疾患関連変異によるLLPSの破綻や凝集化は、水素結合を阻害することで改善できる
という可能性が示唆されました。

Zhou et al. show that the LC domain of the RNA-binding protein TDP-43 associates transiently through a labile structure, and that this behavior is required for phase separation, which is key to its normal role of organizing mRNA (see the Perspective by Petsko and Small). Mutation of a proline in the LC domain caused aggregation by stabilizing the labile structure.
References
- Kato M, Han TW, Xie S, Shi K, Du X, Wu LC, Mirzaei H, Goldsmith EJ, Longgood J, Pei J, Grishin NV, Frantz DE, Schneider JW, Chen S, Li L, Sawaya MR, Eisenberg D, Tycko R, McKnight SL. Cell-free formation of RNA granules: low complexity sequence domains form dynamic fibers within hydrogels. Cell. 2012 May 11;149(4):753-67. doi: 10.1016/j.cell.2012.04.017. PMID: 22579281; PMCID: PMC6347373.
- Kato M, Han TW, Xie S, Shi K, Du X, Wu LC, Mirzaei H, Goldsmith EJ, Longgood J, Pei J, Grishin NV, Frantz DE, Schneider JW, Chen S, Li L, Sawaya MR, Eisenberg D, Tycko R, McKnight SL. Cell-free formation of RNA granules: low complexity sequence domains form dynamic fibers within hydrogels. Cell. 2012 May 11;149(4):753-67. doi: 10.1016/j.cell.2012.04.017. PMID: 22579281; PMCID: PMC6347373.
- Molliex A, Temirov J, Lee J, Coughlin M, Kanagaraj AP, Kim HJ, Mittag T, Taylor JP. Phase separation by low complexity domains promotes stress granule assembly and drives pathological fibrillization. Cell. 2015 Sep 24;163(1):123-33. doi: 10.1016/j.cell.2015.09.015. PMID: 26406374; PMCID: PMC5149108.
- Zhou X, Sumrow L, Tashiro K, Sutherland L, Liu D, Qin T, Kato M, Liszczak G, McKnight SL. Mutations linked to neurological disease enhance self-association of low-complexity protein sequences. Science. 2022 Jul;377(6601):eabn5582. doi: 10.1126/science.abn5582. Epub 2022 Jul 1. PMID: 35771920.
- Guenther EL, Cao Q, Trinh H, Lu J, Sawaya MR, Cascio D, Boyer DR, Rodriguez JA, Hughes MP, Eisenberg DS. Atomic structures of TDP-43 LCD segments and insights into reversible or pathogenic aggregation. Nat Struct Mol Biol. 2018 Jun;25(6):463-471. doi: 10.1038/s41594-018-0064-2. Epub 2018 May 21. Erratum in: Nat Struct Mol Biol. 2019 Oct;26(10):988. PMID: 29786080; PMCID: PMC5990464.
- Jordanova A, De Jonghe P, Boerkoel CF, Takashima H, De Vriendt E, Ceuterick C, Martin JJ, Butler IJ, Mancias P, Papasozomenos SCh, Terespolsky D, Potocki L, Brown CW, Shy M, Rita DA, Tournev I, Kremensky I, Lupski JR, Timmerman V. Mutations in the neurofilament light chain gene (NEFL) cause early onset severe Charcot-Marie-Tooth disease. Brain. 2003 Mar;126(Pt 3):590-7. doi: 10.1093/brain/awg059. PMID: 12566280.
- Shin JS, Chung KW, Cho SY, Yun J, Hwang SJ, Kang SH, Cho EM, Kim SM, Choi BO. NEFL Pro22Arg mutation in Charcot-Marie-Tooth disease type 1. J Hum Genet. 2008;53(10):936-940. doi: 10.1007/s10038-008-0333-8. Epub 2008 Aug 29. PMID: 18758688.
- Clark LN, Poorkaj P, Wszolek Z, Geschwind DH, Nasreddine ZS, Miller B, Li D, Payami H, Awert F, Markopoulou K, Andreadis A, D'Souza I, Lee VM, Reed L, Trojanowski JQ, Zhukareva V, Bird T, Schellenberg G, Wilhelmsen KC. Pathogenic implications of mutations in the tau gene in pallido-ponto-nigral degeneration and related neurodegenerative disorders linked to chromosome 17. Proc Natl Acad Sci U S A. 1998 Oct 27;95(22):13103-7. doi: 10.1073/pnas.95.22.13103. PMID: 9789048; PMCID: PMC23724.</li>
- Sperfeld AD, Collatz MB, Baier H, Palmbach M, Storch A, Schwarz J, Tatsch K, Reske S, Joosse M, Heutink P, Ludolph AC. FTDP-17: an early-onset phenotype with parkinsonism and epileptic seizures caused by a novel mutation. Ann Neurol. 1999 Nov;46(5):708-15. doi: 10.1002/1531-8249(199911)46:5<708::aid-ana5>3.0.co;2-k. PMID: 10553987.
- Lossos A, Reches A, Gal A, Newman JP, Soffer D, Gomori JM, Boher M, Ekstein D, Biran I, Meiner Z, Abramsky O, Rosenmann H. Frontotemporal dementia and parkinsonism with the P301S tau gene mutation in a Jewish family. J Neurol. 2003 Jun;250(6):733-40. doi: 10.1007/s00415-003-1074-4. PMID: 12796837.
- Lladó A, Ezquerra M, Sánchez-Valle R, Rami L, Tolosa E, Molinuevo JL. A novel MAPT mutation (P301T) associated with familial frontotemporal dementia. Eur J Neurol. 2007 Aug;14(8):e9-10. doi: 10.1111/j.1468-1331.2007.01763.x. PMID: 17662000.
- Qi X, Pang Q, Wang J, Zhao Z, Wang O, Xu L, Mao J, Jiang Y, Li M, Xing X, Yu W, Asan, Xia W. Familial Early-Onset Paget's Disease of Bone Associated with a Novel hnRNPA2B1 Mutation. Calcif Tissue Int. 2017 Aug;101(2):159-169. doi: 10.1007/s00223-017-0269-0. Epub 2017 Apr 7. PMID: 28389692.
- Murray DT, Zhou X, Kato M, Xiang S, Tycko R, McKnight SL. Structural characterization of the D290V mutation site in hnRNPA2 low-complexity-domain polymers. Proc Natl Acad Sci U S A. 2018 Oct 16;115(42):E9782-E9791. doi: 10.1073/pnas.1806174115. Epub 2018 Oct 2. PMID: 30279180; PMCID: PMC6196502.
- Lu J, Cao Q, Hughes MP, Sawaya MR, Boyer DR, Cascio D, Eisenberg DS. CryoEM structure of the low-complexity domain of hnRNPA2 and its conversion to pathogenic amyloid. Nat Commun. 2020 Aug 14;11(1):4090. doi: 10.1038/s41467-020-17905-y. PMID: 32796831; PMCID: PMC7427792.


とても興味深い論文ですね。N-メチル化と「同等の」生理的な変化(修飾?)は何が推定されるのでしょうか?RNAも結合するでしょうけど、それだけで説明は難しそうですし。
どうなんでしょう……私も化学に明るくなくて、さっぱりです苦笑
今回割愛しちゃったんですが、NfLの実験のところで、アミドをエステルに置換してもN-メチル化と同様にP8Lの変化を改善しているので、水素結合を阻害する修飾は似たような働きをするんじゃないかと思います。
PTMとしてのメチル化はタウでも数か所言われていますが、それらの酵素では問題の場所をピンポイントでメチル化してはくれないですよね。でもまだ機能のよくわかっていない酵素がたくさんあるみたいだし、もしヒトの力で変異アミノ酸をメチル化とかできるようになったら治療法に繋がりそうですね。
ありがとうございます。アミノ酸の生理的なメチル化はアルギニンとリジンしか知らないのですが、もっとわかっていないものがあるのでしょうか?? そういうのが解明されたら、制御系の構築→治療法へとなるのかな。
私も詳しくはないんですが、他にはヒスチジンとプロリンもメチル化が報告されていると思います。
あと、どこに書いてあったか覚えていないんですが、メチル化酵素とはわかっているけど具体的な作用点がわかっていないってゆー酵素が半分くらいあると書いてあったような……記憶違いだったらすみません💦ちょっと文献探してみます。