先日、TDP-43の凝集体はアミロイドフィブリル状の構造をしておらず、もっとグチャッとしている……のような内容の論文 [1] について考察しましたが、
TMEM106B凝集体のcryo-EM解析第3段。 前回までのおさらいですが、最近、TMEM106B凝集体に関する論文がCellに1報、Natureに2報掲載されました。 Cellの論文は、アメリカ・コロンビア大学のDr …
それに関連して……今回は、TDP-43のC末断片(TDP-25)凝集体のお話。
TDP-43凝集体の構成成分の中に25-35kDaのTDP-43C末断片が多く存在しているという報告があり、これはTDP-43封入体を持つ前頭側頭葉変性症(Frontotemporal lobar degeneration with TDP-43 inclusions, FTLD-TDP)や、筋萎縮性側索硬化症 (Amyotrophic Lateral Sclerosis, ALS) のTDP-43病理内の他 [2]、
limbic-predominant age-related TDP-43 encephalopathy (LATE) の患者さんのTDP-43凝集体でも認められます [3]。
また、このTDP-25のみをマウス脳内で過剰発現すると、変異がなくても神経変性を誘発する事も報告されており [4]、このCTDP-25の意義について、色々と注目されていました。
一方、TDP-43を含めた多くの神経変性疾患の主要病理タンパク達は、細胞内封入体を作るときに、
- クロスβシート構造を持つ、不溶性アミロイドフィブリルの形成 [5]
- 液液相分離(liquid-liquid phase separation, LLPS)から非常に動的な液体様液滴(liquid-like droplets) [6]
の2つの形態を取ることが報告されています。
でも、凝集体形成の過程はそれだけではないようです……。
ドイツ・マックス・プランク研究所のDr. Fernandez-Busnadiego, ドイツ神経変性疾患研究所(German Center for Neurodegenerative Diseases, DZNE)のDr. Edbauer らの研究グループは、
「TDP-43のC末断片(TDP-25)はゲル状の構造物を作る」
という内容を報告しました [7]。

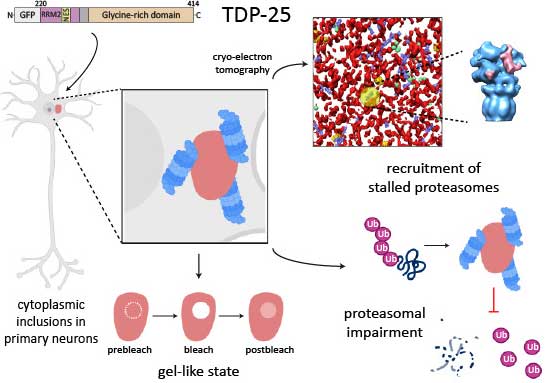
TDP-43のC末断片はゲル状の細胞内封入体を作る
TDP-25凝集体は不定形な構造
彼らは、GRPでタグ付けしたTDP-25を初代培養神経細胞に発現させ、リン酸化された細胞内封入体を作成しました。
野生型(WT)と、既存のALS変異
- G290A
- G294V
- G298S
- A315T
- M337V
- G348C
- N352S
- A382T
でコンストラクトを作製しましたが、RIPA不溶性画分のTDP-25の量は、WTと変異とで有意差はありませんでした。
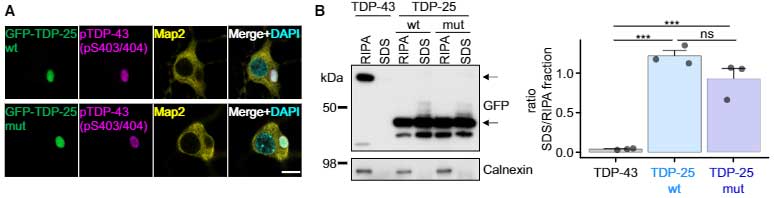
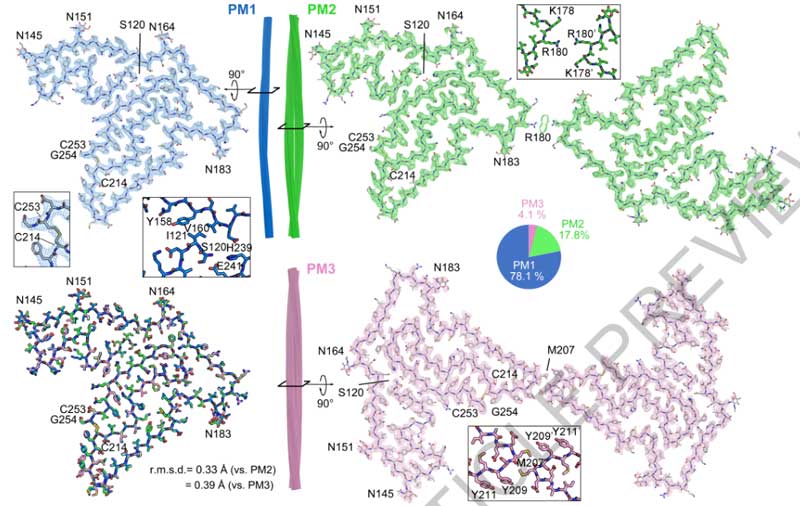
で、この凝集体をクライオ電子線トモグラフィー(cryo-electron tomography, cryo-ET)で見ると、GFP-TDP-25凝集体は、細胞質とは一線を画すものの、中は不定形で、アミロイドフィブリル構造はありませんでした。
また、そのTDP-25凝集体の中に入り込むような形で環状の構造物を認め、~20Åの解像度で詳しく見ると、それはプロテアソームの構造をしていました。
プロテオームにはアダプタータンパクと思われいる exta-density を認め、プロテアソーム活性を調整中の状態と考えられました。

TDP-25凝集体はゲル状
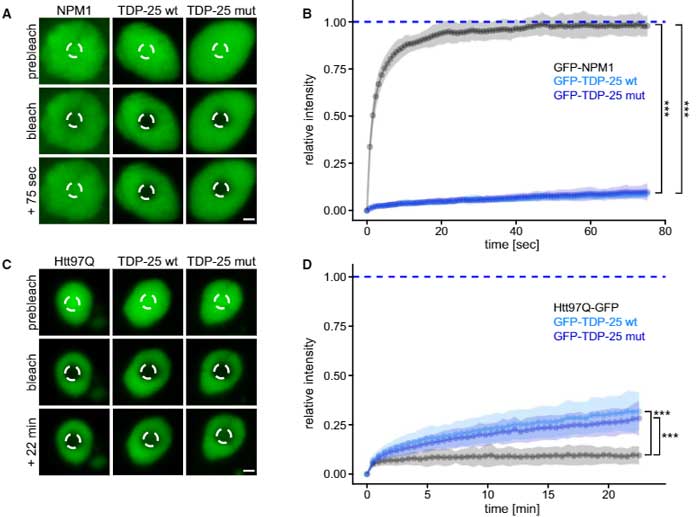
cryo-ETで、TDP-25が不定形な構造をしていたので、これが相分離した液滴(phase-separated liquid droplets)か調べるため、彼らは光退色後の蛍光回復(fluorescence recovery after photobleaching, FRAP)という方法で、TDP-25凝集体の状態を調べてみました。
既存の2種類の凝集体
- GFP-NPM1: 液状をしてタンパクに動きがあるので、bleachで部分的に蛍光を消退させても、数十秒で蛍光が戻る
- GFP-Htt97Q: アミロイド構造をしていてタンパクに動きがないので、bleachして消退した蛍光は元に戻りにくい
をそれぞれ液状コンロール、アミロイドフィブリル状コントロールにおいてGFP-TDP-25の状態を確認したところ、
GFP-TDP-25凝集体は、75病後の時点でGFP-NPM1のように蛍光が回復する事はなく(液状ではない)、
GFP-Htt97Qと違って、22分後くらいから蛍光が戻ってきたので(アミロイドフィブリル状ではない)、
「TDP-25凝集体は、液状でもフィブリル状でもなく、その中間の、ゲル状の状態(gel-like stage)で存在している」
と考えられました。
TDP-25はプロテアソームを隔離して機能を阻害する
このTDP-25ゲル状凝集体の機能を調べるため、
- GFP-TDP-25
- GFP-TDP-43
- GFPのみ
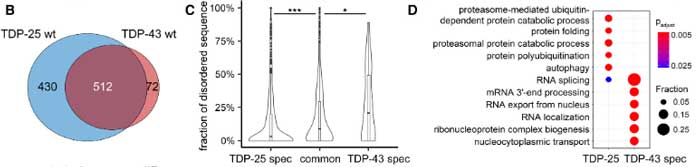
のコンストラクトをそれぞれ発現させた初代培養神経細胞を、質量分析法 (mass spectrometry, MS)ベースのプロテオミクス解析にかけ、機能変化を調べました。
結果、GFP-TDP-25では、GFP-TDP-43よりも430ほどのインターラクトームが検出されました(逆は72)。
TDP-25でインターラクトームが上がっているタンパクにはプロテアソーム系タンパクが多く含まれており、cryo-ETでみられたプロテアソームの結果と一致する内容でした。
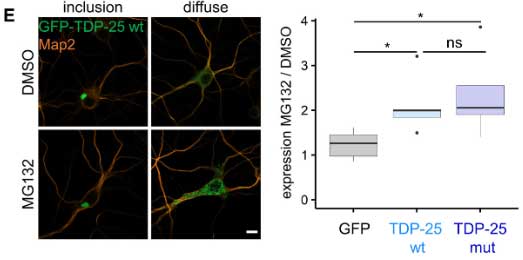
このTDP-25とプロテアソームの関係が、プロテアソームの基質なのか、プロテアソーム阻害物質なのかを調べるため、彼らはGFP-TDP-25を発現したニューロンにプロテアソーム阻害剤のMG132を処置して変化を調べました。
結果、GM132処置で、ニューロン内のGFP-TDP-25の点状凝集体の数が増えたものの、細胞内封入体の大きさは変わりませんでした。
この結果から、プロテアソームは可溶性のGFP-TDP-25を分解していると考えられました。
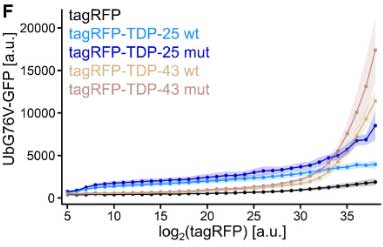
また、TDP-25がプロテアソーム機能に影響しているかどうかを調べるため、彼らは
- RFPでタグ付けしたTDP-25
- GFPでタグ付けしたユビキチンG76V変異
をHEK細胞に発現させ、UPSレポーターが蓄積する量を、
- RFP-TDP-25
- RFP-TDP-43
- RFPのみ
で比較しました。
結果、RFP-TDP-43やRFP-TDP-25を発現させた細胞ではGFP-UbG76VのGFPシグナルが発現量依存的に増加しており、TDP-25, TDP-43はプロテアソーム系を阻害すると考えられました。
・
・
・
以上の結果から、
「TDP-43のC末断片(TDP-25)は、細胞内でゲル状の構造物を作り、プロテアソーム機能を阻害する」
という可能性が考えられました。

TDP-25, a C-terminal fragment of TDP-43 found in ALS and FTD patients, forms cytoplasmic inclusions with gel-like properties in primary neurons. Proteasome enrichment and impaired proteostasis support the relevance of proteasome dysfunction in ALS/FTD.
My View
以前、LATEのTDP-43病理をみたときに、neurites の病変はほとんどC末断片で構成されていたようだったので、このTDP-25の機能について個人的に興味がありました。
TDP-43凝集体がフィブリル構造をとるか否か、について、両方を示唆する論文が出ており [1, 8]、研究者にとって意見が分かれるところかもしれませんが、
今回の報告によると、TDP-25についてはゲル状の構造体になる、という事のようです。
ただ、「FRAPの結果が液体とフィブリルの中間だったからゲル状!」というのはちょっと強引な気もします。
また、実験系でもう1つ気になったのは、cryo-ETでGFPなしのTDP-25凝集体を見ていないこと。
他の系ではGFPやRFPが必要がかもですが、少なくとも一回はGFPなしのTDP-25凝集体を観察し、GFPありの時と形態が変わらないことを示したほうがいいんじゃないかと思いました。
GFPって~27kDaくらいだし、TDP-25とほぼ同じ大きさと考えると、TDP-25凝集体の形にも影響しちゃう可能性もあるんじゃないでしょうか……?
References
- Jiang YX, Cao Q, Sawaya MR, Abskharon R, Ge P, DeTure M, Dickson DW, Fu JY, Ogorzalek Loo RR, Loo JA, Eisenberg DS. Amyloid fibrils in FTLD-TDP are composed of TMEM106B and not TDP-43. Nature. 2022 May;605(7909):304-309. doi: 10.1038/s41586-022-04670-9. Epub 2022 Mar 28. PMID: 35344984.
- Neumann M, Sampathu DM, Kwong LK, Truax AC, Micsenyi MC, Chou TT, Bruce J, Schuck T, Grossman M, Clark CM, McCluskey LF, Miller BL, Masliah E, Mackenzie IR, Feldman H, Feiden W, Kretzschmar HA, Trojanowski JQ, Lee VM. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science. 2006 Oct 6;314(5796):130-3. doi: 10.1126/science.1134108. PMID: 17023659.
- Uemura MT, Robinson JL, Cousins KAQ, Tropea TF, Kargilis DC, McBride JD, Suh E, Xie SX, Xu Y, Porta S, Uemura N, Van Deerlin VM, Wolk DA, Irwin DJ, Brunden KR, Lee VM, Lee EB, Trojanowski JQ. Distinct characteristics of limbic-predominant age-related TDP-43 encephalopathy in Lewy body disease. Acta Neuropathol. 2022 Jan;143(1):15-31. doi: 10.1007/s00401-021-02383-3. Epub 2021 Dec 2. PMID: 34854996.
- Walker AK, Tripathy K, Restrepo CR, Ge G, Xu Y, Kwong LK, Trojanowski JQ, Lee VM. An insoluble frontotemporal lobar degeneration-associated TDP-43 C-terminal fragment causes neurodegeneration and hippocampus pathology in transgenic mice. Hum Mol Genet. 2015 Dec 20;24(25):7241-54. doi: 10.1093/hmg/ddv424. Epub 2015 Oct 16. PMID: 26476406; PMCID: PMC5007600.
- Knowles TP, Vendruscolo M, Dobson CM. The amyloid state and its association with protein misfolding diseases. Nat Rev Mol Cell Biol. 2014 Jun;15(6):384-96. doi: 10.1038/nrm3810. Erratum in: Nat Rev Mol Cell Biol. 2014 Jul;15(7):496. PMID: 24854788.
- Gomes E, Shorter J. The molecular language of membraneless organelles. J Biol Chem. 2019 May 3;294(18):7115-7127. doi: 10.1074/jbc.TM118.001192. Epub 2018 Jul 25. PMID: 30045872; PMCID: PMC6509512.
- Riemenschneider H, Guo Q, Bader J, Frottin F, Farny D, Kleinberger G, Haass C, Mann M, Hartl FU, Baumeister W, Hipp MS, Meissner F, Fernández-Busnadiego R, Edbauer D. Gel-like inclusions of C-terminal fragments of TDP-43 sequester stalled proteasomes in neurons. EMBO Rep. 2022 Apr 19:e53890. doi: 10.15252/embr.202153890. Epub ahead of print. PMID: 35438230.
- Li Q, Babinchak WM, Surewicz WK. Cryo-EM structure of amyloid fibrils formed by the entire low complexity domain of TDP-43. Nat Commun. 2021 Mar 12;12(1):1620. doi: 10.1038/s41467-021-21912-y. PMID: 33712624; PMCID: PMC7955110.