記憶の形成というのは色々と複雑な機序が絡み合っているという印象がありますが、「最初に入ってきた記憶が、そのちょっと後に入ってきた記憶の整理に影響する」というのは、私達の実社会でもなんとなく実感が湧くと思います。
マウスでも、ブザーがなった後に電気刺激を与えると、そのブザーと電気刺激の記憶がリンクして、ブザーがなるだけで「あの怖いヤツだ」と思って体が竦んでしまいます。
Fear Conditioning Test と呼ばれるこのテストは、前後の記憶を関連付ける「contextual memory(文脈記憶)」を調べるバッテリーとしてよく利用されていますが、
この時の記憶形成に海馬のCA1領域が重要な役割を持つ、という事が以前から報告されていました [1, 2]。
一方、エイズの原因ウイルス、ヒト免疫不全ウイルス(human immunodeficiency virus, HIV)の細胞への感染窓口の受容体として有名な C-C chemokine receptor type 5 (CCR5) は、この海馬CA1で多く発現しており [3, 4, 5]、 記憶に重要な cAMP-response element binding protein (CREB) の活性化やニューロンの興奮性を負に制御するなどの機能が報告されていることから [4, 6]、
このCCR5がなんらかの記憶形成機序に関与する可能性も推測されていました。
今回、アメリカ・カリフォルニア大学ロサンゼルス校(UCLA)のDr. Silva, Dr. Zhou らの研究グループは、
「CCR5が記憶形成後に海馬の背側CA1で遅れて発現し、それによって記憶同士のリンクが途切れる」
という内容を報告しました [7] 。

CCR5は、記憶同士をリンクする時間枠の窓(temporal window)を閉じる
CCR5は、文脈記憶形成後に遅れて発現が上がる
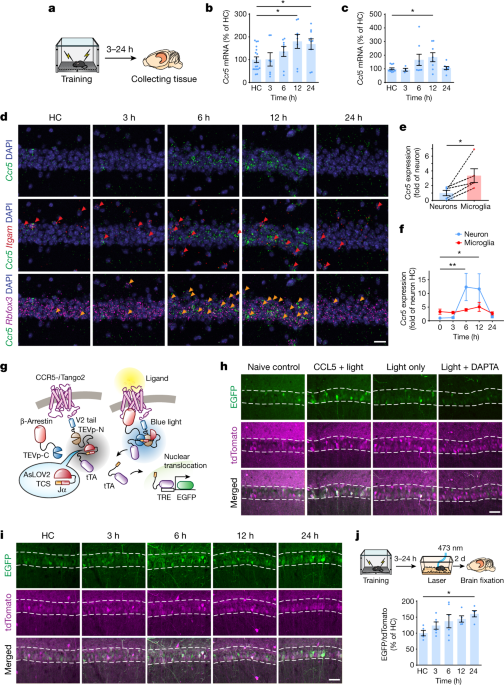
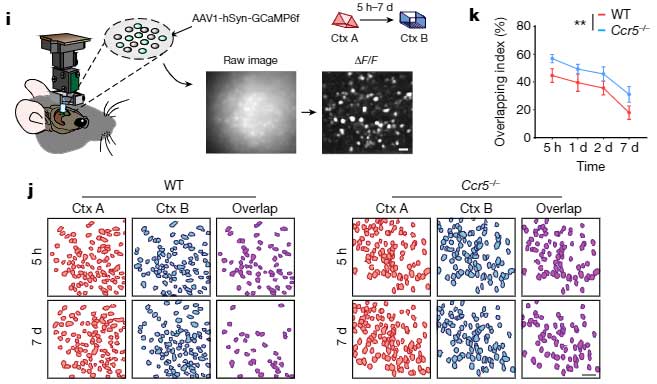
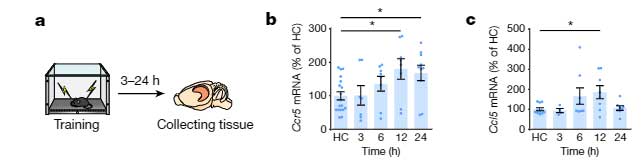
彼らはまず、野生型マウスに対して冒頭で紹介した Fear Conditioning Test を行い、トレーニングの12時間後に、脳内でCcr5や、そのリガンドであるCcl5のmRNAの発現が上昇することを確認しました。
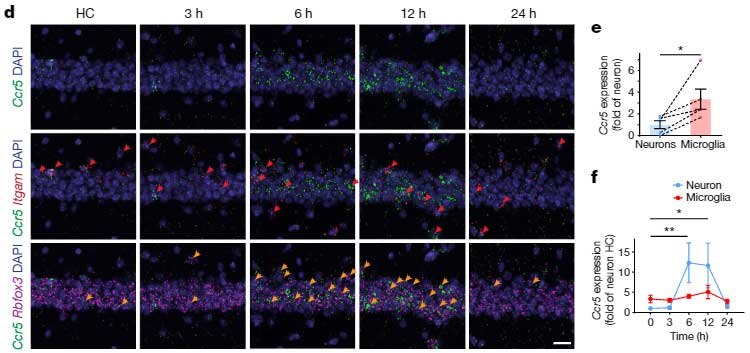
マウスの海馬CA1領域で、Ccr5はニューロンよりもミクログリアで多く発現していましたが、Fear Conditioning のトレーニング後、Ccr5は、主にニューロンで著明に増加していました。
さらに彼らは、
- cFos-tTA マウス+TRE-mCerry を組み込んだAAVベクター脳内注入
- ニューロンに ChR2 (E12T/T159C) を発現させてオプトジェネティクスで刺激(ChR2ETTC)
の2種類のマウスに Fear Conditioning test のトレーニングを行い、トレーニング後遅れて、海馬CA1のメモリーアンサンブル細胞でCcr5が発現することを確認しました。
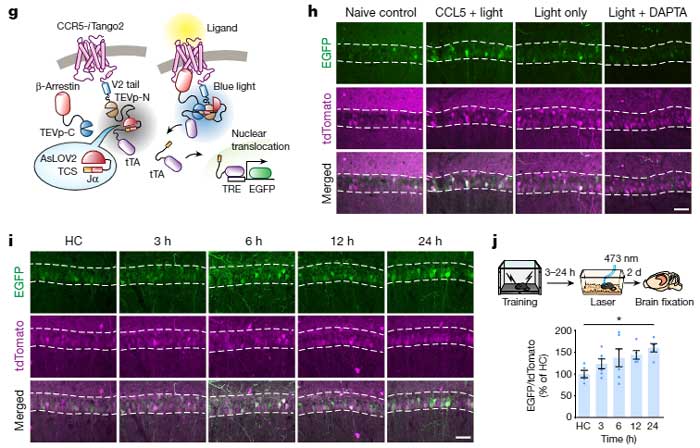
CCR5は、文脈記憶の関連付けを調節する
次に彼らは、文脈記憶において、イベント同士の関連付けがどの時間枠まで可能か調べました。
- マウスに Context A のイベントを経験させる。
- 5時間後、1日後、2日後、7日後に、それぞれ Context B のイベントを経験させる。
- さらにその2日後に、Context B のイベントと共に電気ショックを与える。
- さらにその2日後に、Context A のイベントを経験させ、
- "Context B + 電気ショック" の恐怖記憶
- "Context A" の記憶
この記憶リンクテストで、Context A と Context B のリンクは、最初の Context A のイベントから5時間後に最も高く、1日、2日、7日後にはこのリンクが減少することがわかりました。
時間経過的には、
「Context A と Context B の記憶リンク → CCR5の発現上昇(12-24h) → 記憶の関連付けが低下」
という事になります。
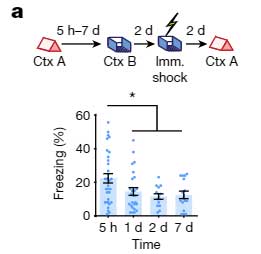
そこで彼らは、CCR5の発現上昇が、この時間枠(temporal window)を調節しているかどうか、
- CCR5の発現↑
- CCR5の発現↓
の2つの方法で、同じバッテリーを課し、temporal window の長さを調べてみました。
CCR5の活動を上げると、temporal windowが閉じる
彼らはまず、CCR5の活動を上げるため、Context A の4時間後にCCR5のリガンドであるCCL5を背側CA1に注入し、5時間後に Context B を経験させ、その2日後に電気ショックを経験させました。
すると、その後の記憶リンクテスト中、5時間後のContext A 時のフリージング時間の割合は低下しました。
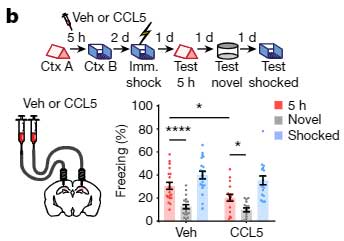
また、オプトジェネティクスでCA1のCCR5を直接刺激しても同じようにフリージング時間の割合は低下し、
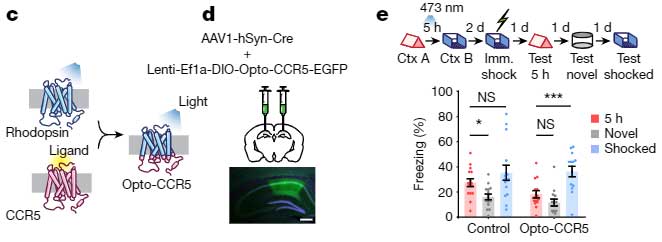
「CCR5の活動を上げると、temporal window が閉じる」
可能性が示唆されました。
CCR5の発現を下げると、temporal window が閉じにくくなる
今度は逆に、shCCR5でCCR5の発現を下げ、Context A から2日あけて Context B を経験させ、さらにその2日後に電気ショックを与えました。
その条件で記憶リンクテストを行うと、リンクが切れているはずの2日後でも、shCCR5注入マウスの方は Context A と電気ショックがリンクされており、フリージング時間の割合が増えていました。
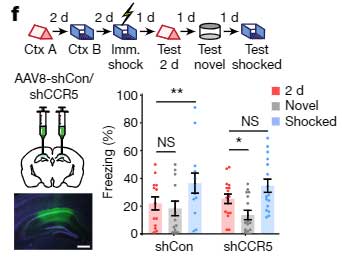
また、CCR5ノックアウトマウスで同様の検証(Contextは A, B, C の3種類)を行うと、Ccr5-/-マウスでは7日経っても Context A と Context C + 電気ショックの記憶がリンクされており、
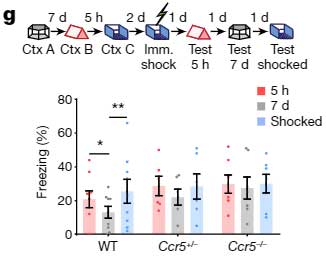
「CCR5は、temporal windowの閉鎖に重要」
だと考えられました。
CCR5は、学習記憶の記憶細胞群への共配置を調節する
続いて彼らは、CCR5が文脈記憶のリンクに対してどのように temporal window を調節するのか調べました。
これまで、学習後、神経活動が上がり、対象となる神経細胞群への記憶の割り当てに影響することが報告されていたので、彼らは、CCR5がこの機序に関与するのではないかと考えました。
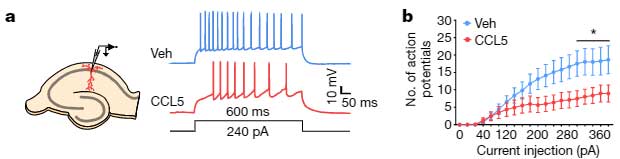
マウス海馬のスライスカルチャーの背側CA1部分にCCL5を処置すると、神経発火が抑制され、
「CCR5は神経活動を抑制する」
可能性が示唆されました。
さらに、オプトジェネティクスでCCR5の発現を上げると、学習後の背側CA1のc-Fos発現は下がり、
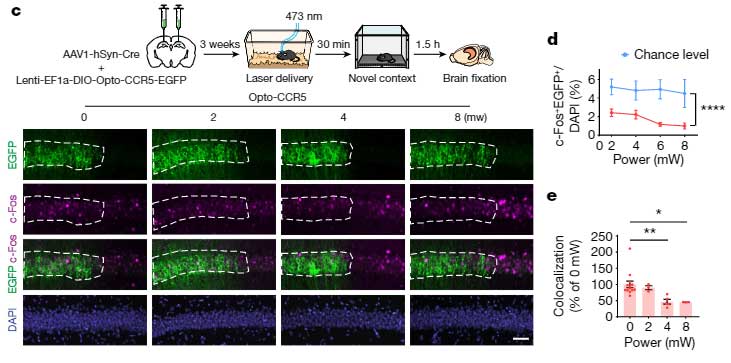
反対にAAV-shCCR5でCCR5の発現を下げたり、Ccr5ノックアウトマウスを使用すると、学習後の神経活動は保たれていました。
「CCR5の発現上昇で、学習による記憶神経細胞群の神経活動が抑えられる」
可能性が示唆されました。
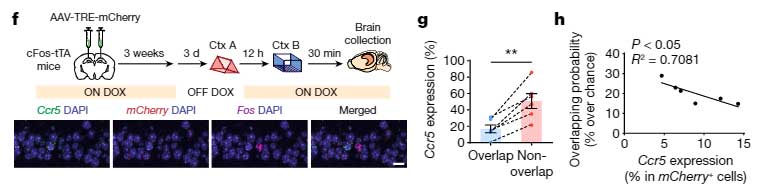
記憶細胞の神経活動が下がる事で、最初の学習記憶と次の学習記憶が同じ記憶細胞に配置される割合が減っているのではないかと考え、彼らは cFos-tTA/TRE-mCherry システムと Fos mRNA の in situ ハイブリダイゼーションを行い、
- 学習後のCcr5の発現
- 2つのイベントの学習後に、同じ細胞群で c-Fos が発現する割合
の関係を調べてみました。
すると、学習後のCcr5の発現と、神経活動が上昇する細胞群が2つのイベントでオーバーラップする割合に負の相関を認め、
「CCR5によって2つの学習記憶が同じ記憶細胞群へ配置されななり、それにより2つの学習記憶がリンクされなくなる」
という可能性が示唆されました。
さらに彼らはカルシウムイメージングを用いて、学習記憶後の1細胞あたりの神経活動を、
- 野生型マウス
- Ccr5-/-マウス
で比較しました。
すると、野生型マウスでは、Context A と Context B の後に活動がオーバーラップする細胞が時間経過とともに減少するのに対して、Ccr5-/-マウスではその割合が多く保たれており、
「CCR5の発現によって、2つの学習記憶の記憶細胞への共配置が妨げられる」
という彼らの仮説を裏付ける結果となりました。

CCR5の発現は加齢とともに増加し、関連記憶障害につながる
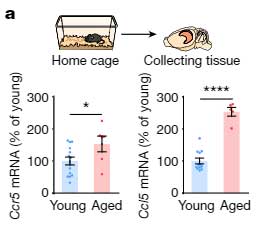
CCR5は末梢の免疫細胞で加齢とともに発現が上がることが報告されていたので [8, 9] 、彼らは、同じことが脳内でも起こっているかどうかについて調べました。
16-18ヶ月の老齢マウスの脳内では、若齢マウスに比べて Ccr5 や Ccl5 の発現が上昇していました。
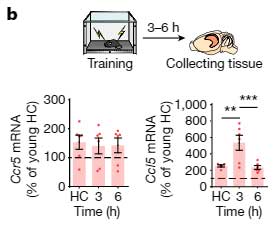
また、Fear Conditioning Test 後の一時的な Ccl5 上昇の程度も、若年マウスより増加しており、
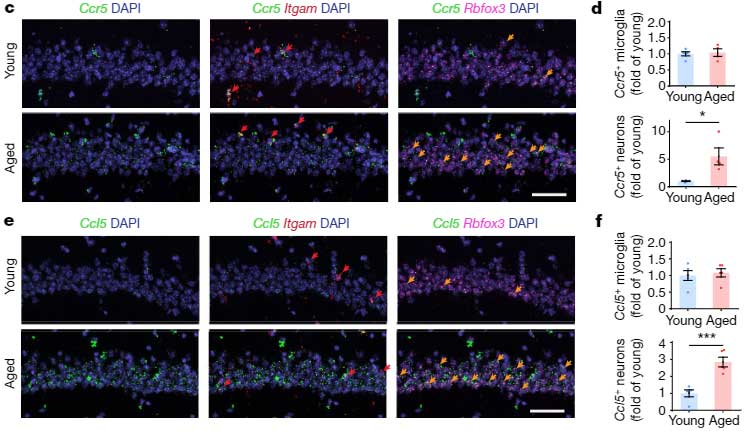
Ccr5 と Ccl5 の発現は、海馬の背側CA1のニューロンで上昇していました。
記憶リンクテストを行うと、老齢マウスでは、電気刺激から3時間後の記憶でも最初の記憶とリンクされず、フリージング時間の割合が低下しました。
しかしながら、
- Ccr5-/-マウス
- Maraviroc(FDA承認のHIV治療薬で、CCR5の阻害薬)でCCR5を阻害したマウス
では、同じ老齢マウスでも2つの Context の記憶がリンクされており、
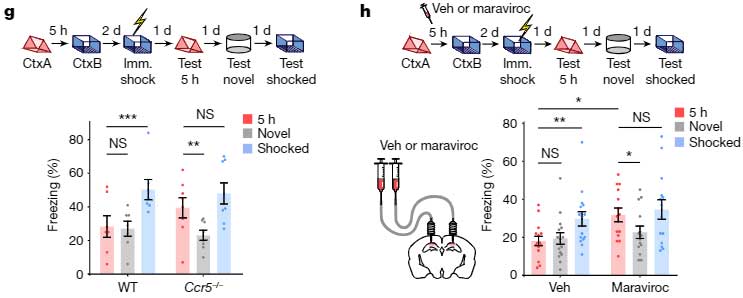
「CCR5を阻害すると、2つの学習記憶をリンクさせる能力が長時間保たれる」
可能性が示唆されました。
・
・
・
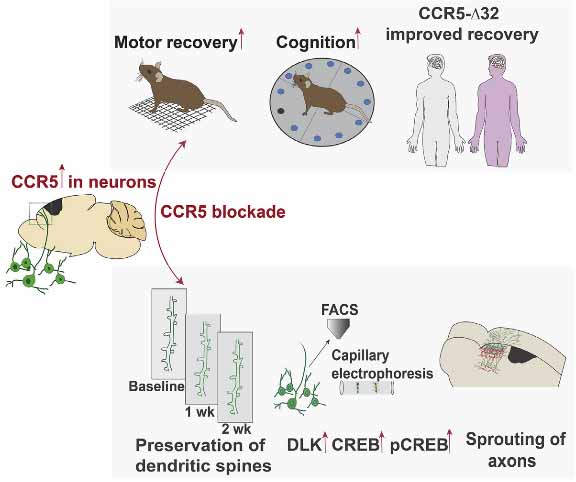
以上の結果から、
-
学習記憶の12-24時間後に、海馬の背側CA1の神経細胞で、CCR5の発現が遅れて上昇してくる。
↓
一定時間内で同時に学習した記憶は、同じ記憶細胞群への配置されるが、CCR5はこの機序を抑制する。
↓
2つの学習記憶の関連付けが障害される。 - CCR5のベースラインの発現および学習記憶後の一過性の発現は加齢とともに上昇し、文脈記憶障害に関与する。
という可能性が示唆されました。
A molecular mechanism involving CCR5 and CCL5 determines the temporal window in which a memory can be linked with subsequent memories, and in aged mice an increase in CCR5 is associated with defects in memory linking.
My View
CCR5に関する論文を見つけると、2018年に問題になった中国のゲノム編集ベビー達が心配で、できるだけ目を通すようにしています。
CCR5とゲノム編集ベビーについては以前まとめました(こちらの記事)が、CCR5を欠失した子供たちに悪い作用がないか、いつも気になってしまいます。
脳卒中や外傷性脳損傷(Traumatic brain injury:TBI)後の運動機能や認知機能障害は、生活の質を大幅に低下させる。 脳卒中/TBI後の機能回復をいかに促進させるかは、重要な課題である。 近年、C-C …
ただ、以前紹介した論文の結果も、今回の論文の結果も、CCR5を欠失することで、脳内では記憶力の向上や脳障害に対する耐性アップなどに繋がり、どちらかというと良い方向に影響がありそうな感じがしました。
……まあ、それがベビー達にとって吉と出るかどうかはわからないですけど……PTSDとかにはなりやすそうですし……
References
- Roy DS, Kitamura T, Okuyama T, Ogawa SK, Sun C, Obata Y, Yoshiki A, Tonegawa S. Distinct Neural Circuits for the Formation and Retrieval of Episodic Memories. Cell. 2017 Aug 24;170(5):1000-1012.e19. doi: 10.1016/j.cell.2017.07.013. Epub 2017 Aug 17. PMID: 28823555; PMCID: PMC5586038.
- Sakimoto Y, Kida H, Mitsushima D. Temporal dynamics of learning-promoted synaptic diversity in CA1 pyramidal neurons. FASEB J. 2019 Dec;33(12):14382-14393. doi: 10.1096/fj.201801893RRR. Epub 2019 Nov 5. PMID: 31689120; PMCID: PMC6894079.
- Lanfranco MF, Mocchetti I, Burns MP, Villapol S. Glial- and Neuronal-Specific Expression of CCL5 mRNA in the Rat Brain. Front Neuroanat. 2018 Jan 12;11:137. doi: 10.3389/fnana.2017.00137. PMID: 29375328; PMCID: PMC5770405.
- Zhou M, Greenhill S, Huang S, Silva TK, Sano Y, Wu S, Cai Y, Nagaoka Y, Sehgal M, Cai DJ, Lee YS, Fox K, Silva AJ. CCR5 is a suppressor for cortical plasticity and hippocampal learning and memory. Elife. 2016 Dec 20;5:e20985. doi: 10.7554/eLife.20985. PMID: 27996938; PMCID: PMC5213777.
- Torres-Muñoz JE, Van Waveren C, Keegan MG, Bookman RJ, Petito CK. Gene expression profiles in microdissected neurons from human hippocampal subregions. Brain Res Mol Brain Res. 2004 Aug 23;127(1-2):105-14. doi: 10.1016/j.molbrainres.2004.05.017. PMID: 15306126.
- Shepherd AJ, Loo L, Mohapatra DP. Chemokine co-receptor CCR5/CXCR4-dependent modulation of Kv2.1 channel confers acute neuroprotection to HIV-1 glycoprotein gp120 exposure. PLoS One. 2013 Sep 24;8(9):e76698. doi: 10.1371/journal.pone.0076698. PMID: 24086760; PMCID: PMC3782454.
- Shen Y, Zhou M, Cai D, Filho DA, Fernandes G, Cai Y, de Sousa AF, Tian M, Kim N, Lee J, Necula D, Zhou C, Li S, Salinas S, Liu A, Kang X, Kamata M, Lavi A, Huang S, Silva T, Do Heo W, Silva AJ. CCR5 closes the temporal window for memory linking. Nature. 2022 May 25. doi: 10.1038/s41586-022-04783-1. Epub ahead of print. PMID: 35614219.
- Mello Coelho Vd, Bunbury A, Rangel LB, et al. Fat-storing multilocular cells expressing CCR5 increase in the thymus with advancing age: potential role for CCR5 ligands on the differentiation and migration of preadipocytes. Int J Med Sci. 2009;7(1):1-14. Published 2009 Dec 4. doi: 10.7150/ijms.7.1
- Yung R, Mo R, Grolleau-Julius A, Hoeltzel M. The effect of aging and caloric restriction on murine CD8+ T cell chemokine receptor gene expression. Immun Ageing. 2007 Nov 14;4:8. doi: 10.1186/1742-4933-4-8. PMID: 18001471; PMCID: PMC2200663.