私が研究を始めた頃は、ある疾患からiPS細胞を樹立したり、別の細胞に分化させたりするだけで3大誌に載っていましたが、
今では手軽に購入できるようになり、遺伝子編集も簡単……
そして今回は、
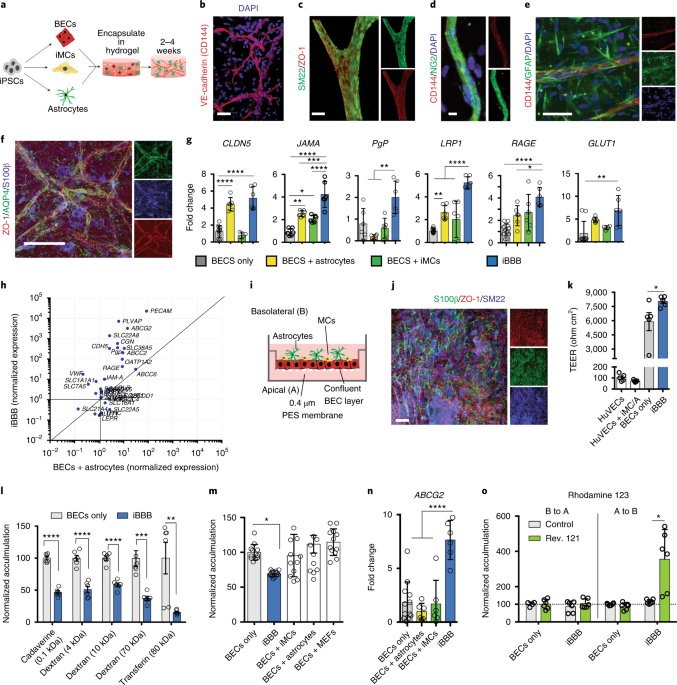
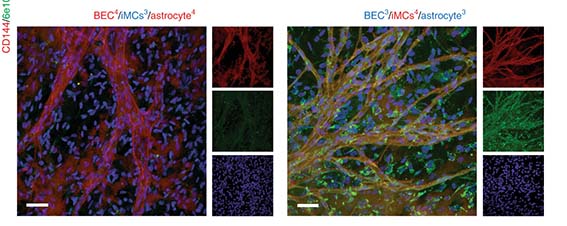
iPS細胞から分化させた内皮細胞、ペリサイト、アストロサイトの3D培養で毛細血管が作れた、
とのこと[1]。
An iPSC-based three-dimensional model of the human blood–brain barrier reveals that NFAT and APOE dysregulation in pericyte-like mural cells contributes to cerebral amyloid angiopathy and can potentially be targeted to treat Alzheimer’s disease.
毛細血管を作ってCAAを再現
アメリカ・マサチューセッツ大学(MIT)のTsaiらの研究グループは、
ヒトiPS細胞をそれぞれ内皮細胞、ペリサイト、アストロサイトに分化させ、3D培養をして毛細血管を再現した。
毛細血管では、血液脳関門(blood-brain barrier, BBB)の構築も認めた。
この毛細血管を使って脳アミロイドアンギオパチー(cerebral amyloid angiopathy, CAA)を再現するため、
家族性アルツハイマー病 (familial Alzheimer's disease, FAD) の変異(APP重複、PSEN1M146I)の入ったニューロンと、この毛細血管の共培養を行った。
APOE3とAPOE4のiPSから毛細血管を作製し、ニューロンと共培養したところ、 APOE4-iPS細胞由来の毛細血管でアミロイドβ(Amyloid beta, Aβ)の蓄積を認め、capillary-CAAが再現された。
このAβの蓄積は、ペリサイトがAPOE4のときだけ起こり、内皮細胞/アストロサイトだけがAPOE4のとき、この現象は認めなかった。
なぜペリサイトがAPOE4のときだけCAAをが再現できるのか、それぞれの細胞のRNAシークエンスを行い、遺伝子発現の変化を調べた。
すると、APOE4ペリサイトではAPOEの発現が上がっているのに対し、アストロサイトAPOE4では逆にAPOEの発現が下がっていた。
ヒト剖検脳でも、APOE4を持つ人達は、前頭前野/海馬のペリサイトでAPOE4の発現が上がっていた。
一方、細動脈の平滑筋細胞では、APOE4の発現症状は認められなかった。
ペリサイトでAPOE4の発現を上げているものは何だろうか?
RNAシークエンスのデータを分析したところ、 APOEのプロモーターと相互作用する報告のある2つの転写因子、 calcineurin-nuclear factor of activated Tcells (NFAT) とC/EBPの発現上昇が確認された。
NFATの上流にあるカルシニューリンの阻害剤(cyclosporineA(CsA)、FK506、INCA6)を処置したところ、 ペリサイトのAPOE4発現、および血管のAβ蓄積を抑制することができ、
カルシニューリン-NFATのシグナリングが、ペリサイトのAPOE4発現上昇とそれに伴う血管のAβ沈着に関与している事が示唆された。
同様の結果は、APOE4ノックイン(knockin, KI)マウスでも確認できた。
APOE4KIマウスから単離したペリサイトにCsAとFK506を処置すると、APOEmRNA量が減少した。
また、APOE4KIマウスをFADマウスと交配させ、CsAを投与したところ、
APOEの発現量および血管Aβ沈着が抑制された。
今後、カルシニューリン-NFATシグナリングがAPOE4関連CAAの治療ターゲットとして注目される。
My View
1. 毛細血管/BBBの再現について
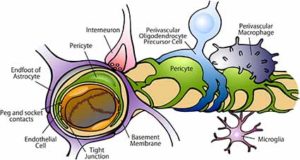
毛細血管の基本構成成分は、内皮細胞、ペリサイト、アストロサイトで、
さらに介在ニューロン、ミクログリア、血管周囲マクロファージ等、色々な細胞が介在してきます[2]。
今までもin vitroで毛細血管のBBBを再現した研究はあり、
皮細胞のタイトジャンクションを構築するためにはペリサイトとアストロサイトとの存在が必要だと認識されていました [3]。
今回は、3D培養という方法を取ることで、より本物に近い毛細血管が出来上がったという印象です。
私の中のざっくりとしたイメージとしては、
内皮細胞がチューブを作る
↓
内皮細胞がPDGF-BB分泌
↓
ペリサイトがPDGFRβで信号をキャッチして 内皮細胞周辺に集まる
↓
TGFβやNotchシグナリングで血管が安定
↓
ペリサイト由来のlaminin211が基底膜に分泌される
↓
アストロサイトのendofeetにAQP4が局在する
↓
毛細血管の完成
という感じ [4]。
この論文ではそれら毛細血管構築のポイントをある程度確認していて、
その上でBBBが出来上がっている事を証明しているので、
脳内の毛細血管をかなり近い感じに再現できているんじゃないかと思いました。
2. capillary-CAAについて
CAAといえば動脈や細動脈へのAβ沈着が真っ先に思いつきますが、毛細血管(capillary)にもAβは沈着します。
- 動脈/細動脈のCAA:CAA type2
- 毛細血管にもCAAあり:CAA type1
そして、このcapillary-CAA(type1)は、
- 微小梗塞
- 認知機能低下
- APOE4保有率
との相関が、type2に比べて強いと言われています[5][6][7]。
そう考えると、今回のペリサイト-APOE4がcapillary-CAAに関連している、というのは矛盾しないように思います。
ただ、アストロサイト-APOE4がほとんど関係ない、いうのはちょっとひっかかりました。
APOEはアストロサイトで最も多く発現しているので、 もし発現が落ちていたとしてもアストロサイトAPOE4がAβの蓄積とほとんど関係がないというのは……ほんとかな?
でも今回のデータはそう示しているようです。
そして、APOE4ペリサイトで同じく発現が上がっているNFATに注目します。
NFATはカルシニューリンによって脱リン酸化され、核内に移行して転写因子として働きます。
これによって転写の影響をうける分子の一つがAPOEということです。
著者らは、すでに免疫抑制剤として臨床応用されているカルシニューリン阻害剤のFK506(タクロリムス)とCsA(シクロスポリン)を使ってNFATの上流を阻害することで、
NFATの核内移行を防ぐという方法を試しました。
結果、in vitroでもin vivoでもカルシニューリン阻害剤で ペリサイト-APOE4の発現およびcapillary-CAAを抑制できました。
うーん、さすが。
前述のとおりcapillary-CAAを防げると、 これによるmicroinfarction→認知機能低下を抑制できる可能性があり、 ADの治療ターゲットとして注目できると思いました。
なんでAPOE4ペリサイトだけNFATが上がるのかなど、まだまだ不明な点は多いですが、これから解明されるんじゃないでしょうか。
免疫抑制剤と考えるとちょっと怖くはありますが、
FK506がAD/dementiaの発症率を抑えたという報告もあるので[8]、
近い将来、カルシニューリン阻害剤がAD/CAA治療薬として再配置される日がくる……かもしれません。
References
- Blanchard, J.W., Bula, M., Davila-Velderrain, J. et al. Reconstruction of the human blood–brain barrier in vitro reveals a pathogenic mechanism of APOE4 in pericytes. Nat Med 26,952–963 (2020). https://doi.org/10.1038/s41591-020-0886-4
- Uemura MT, Maki T, Ihara M, Lee VMY and Trojanowski JQ (2020) Brain Microvascular Pericytes in Vascular Cognitive Impairment and Dementia. Front. Aging Neurosci. 12:80. doi: 10.3389/fnagi.2020.00080
- Nakagawa S, Deli MA, Kawaguchi H, et al. A new blood-brain barrier model using primary rat brain endothelial cells, pericytes and astrocytes. Neurochem Int. 2009;54(3-4):253-263. doi: 10.1016/j.neuint.2008.12.002
- Winkler EA, Bell RD, Zlokovic BV. Central nervous system pericytes in health and disease. Nat Neurosci. 2011;14(11):1398-1405. Published 2011 Oct 26. doi: 10.1038/nn.2946
- Thal DR, Ghebremedhin E, Rüb U, Yamaguchi H, Del Tredici K, Braak H. Two types of sporadic cerebral amyloid angiopathy. J Neuropathol Exp Neurol. 2002;61(3):282-293. doi: 10.1093/jnen/61.3.282
- Mäkelä, Mira et al. ‘Capillary Amyloid-β Protein Deposition in a Population-Based Study (Vantaa 85+)’. 1 Jan. 2016 : 149 – 157.
- Hecht M, Krämer LM, von Arnim CAF, Otto M, Thal DR. Capillary cerebral amyloid angiopathy in Alzheimer's disease: association with allocortical/hippocampal microinfarcts and cognitive decline. Acta Neuropathol. 2018;135(5):681-694. doi: 10.1007/s00401-018-1834-y
- Taglialatela G, Rastellini C, Cicalese L. Reduced Incidence of Dementia in Solid Organ Transplant Patients Treated with Calcineurin Inhibitors. J Alzheimers Dis. 2015;47(2):329-333. doi: 10.3233/JAD-150065