アルツハイマー病 (Alzheimer's disease, AD) では、アミロイドβ (Amyloid beta, Aβ) プラークと神経原線維変化 (neurofibrillary tangle, NFT) が病理学的な特徴です。
NFTは、過剰にリン酸化したタウが、神経細胞内で凝集して生じますが、
剖検脳の解析(Braak et al., JNEN, 2011; Braak et al., Acta Neuropathol, 2006) や、動物モデルの解析 (Iba et al., JNS, 2015; Calignon et al., Neuron, 2012) から、
このタウは、近接の細胞というよりは、主に軸索を介して細胞間を伝播するという事が考えられてきました。
今回、カナダ・モンテリオール神経研究所のVogelやスウェーデンのHansson, Evansらの研究グループは、Diffusion tensor imaging (DTI) 、resting-state functional MRI (rs-fMRI) 、タウPETetc.を組み合わせ、ADの患者さんの脳内でのタウの伝播を解析しました。
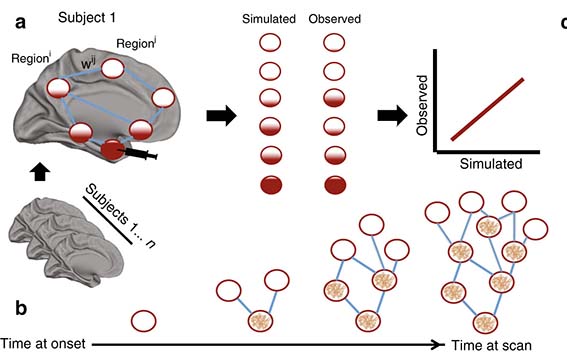
The tau protein is theorized to spread transneuronally in Alzheimers disease, though this theory remains unproven in humans. Our simulations of epidemic-like protein spreading across human brain networks support this theory, and suggest the spreading dynamics are modified by β-amyloid
タウは軸索を介して広がる
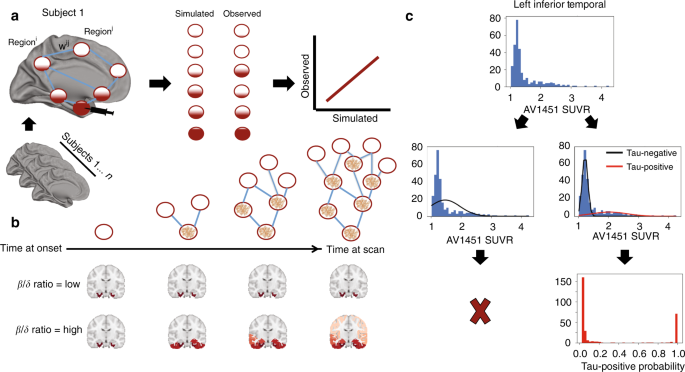
彼らは、認知機能正常 (n = 162), 軽度認知機能障害 (mild cognitive impairment, n = 89), AD (n = 61) の計312人の被験者を対象に、Flortaucipir (AV1451)-PETを行い、NFTの広がりを解析した。
In silicoで、タウ伝播の中心点とその広がりを予測し、実際のタウPETのデータと照合した所、中心点は嗅内皮質で、その後軸索を介して脳内を伝播しているようだった。
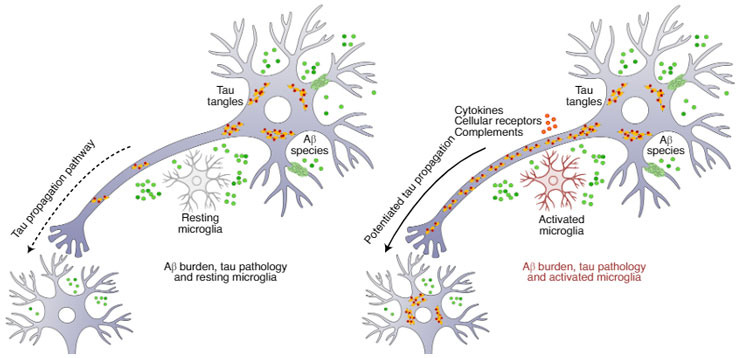
アミロイドPET (18F-florbetapir, or AB45) で脳内のAβ蓄積とタウの伝播との関係を調べた所、Aβ↑の検体ではタウの伝播の程度が予測よりも大きく、またAβの存在するところにタウが広がっているようだった。
また、タウの伝播は左右非対称で、中心点が左嗅内皮質の場合は左半球優位に広がり、右嗅内皮質の場合は右半球優位に広がっていた。
My View
これまでの解析結果から、タウは最初の頃は軸索を介して綺麗に広がり、あちこちに軸索を伸ばす新皮質まで広がるとごちゃごちゃと広がっていく、というイメージでしたが、今回のタウPETでの結果も同じような結果になったようです。
今までのタウPETの結果とどう違うの?
とも思いましたが、DTIで直接的、rs-fMRIで間接的なコネクトームを確認し、タウPETの結果と照合することで、コネクトームの信頼性を上げているってところでしょうか。
ただ、タウの伝播は青斑核が出発点と考えられています (Braak et al., JNEN, 2011; Iba et al., JNS, 2015) が、タウPETではそこまで小さな領域はとらえられないために、嗅内皮質スタートという結果になったのかもしれません。
個人的に興味深いのは、Aβがあるとタウの伝播が促進されるだけでなく、タウがAβの方に向かって伝播していっているようだ、という事。
以前、これを他の方法で検証したいなーと思って色々考えていたのですが、結局今のボスからGoサインがでずに断念しました。
アミロイド仮説から時が経ち、Aβはタウ伝播のエンハンサーだ、という証拠が次々と報告されてきていますが (He et al., Nat Med, 2018; Pooler et al., Acta Neuropathol, Commun, 2015) 、どうやってAβがタウの伝播を促進させるのか、Aβのリン酸化を促したりする以外に何かありそうな気がしてやみません。
References
- Vogel JW, Iturria-Medina Y, Strandberg OT, et al. Spread of pathological tau proteins through communicating neurons in human Alzheimer's disease. Nat Commun. 2020;11(1):2612. Published 2020 May 26. doi: 10.1038/s41467-020-15701-2
- Heiko Braak, MD, Dietmar R. Thal, MD, Estifanos Ghebremedhin, MD, Kelly Del Tredici, MD, PhD, Stages of the Pathologic Process in Alzheimer Disease: Age Categories From 1 to 100 Years, Journal of Neuropathology & Experimental Neurology, Volume 70, Issue 11, November 2011, Pages 960–969, https://doi.org/10.1097/NEN.0b013e318232a379
- Braak H, Alafuzoff I, Arzberger T, Kretzschmar H, Del Tredici K. Staging of Alzheimer disease-associated neurofibrillary pathology using paraffin sections and immunocytochemistry. Acta Neuropathol. 2006;112(4):389‐404. doi: 10.1007/s00401-006-0127-z
- Iba M, McBride JD, Guo JL, Zhang B, Trojanowski JQ, Lee VM. Tau pathology spread in PS19 tau transgenic mice following locus coeruleus (LC) injections of synthetic tau fibrils is determined by the LC's afferent and efferent connections. Acta Neuropathol. 2015;130(3):349‐362. doi: 10.1007/s00401-015-1458-4
- de Calignon A, Polydoro M, Suárez-Calvet M, et al. Propagation of tau pathology in a model of early Alzheimer's disease [published correction appears in Neuron. 2012 Oct 18;76(2):461]. Neuron. 2012;73(4):685‐697. doi: 10.1016/j.neuron.2011.11.033
- He Z, Guo JL, McBride JD, et al. Amyloid-β plaques enhance Alzheimer's brain tau-seeded pathologies by facilitating neuritic plaque tau aggregation. Nat Med. 2018;24(1):29‐38. doi: 10.1038/nm.4443
- Pooler AM, Polydoro M, Maury EA, et al. Amyloid accelerates tau propagation and toxicity in a model of early Alzheimer's disease. Acta Neuropathol Commun. 2015;3:14. Published 2015 Mar 24. doi: 10.1186/s40478-015-0199-x