ミクログリアは脳内のお掃除屋さんで、アミロイドβ(Amyloid beta, Aβ)、タウ、αシヌクレイン(α-synuclein, α-syn)など、神経変性疾患に関わる様々な病的蛋白を貪食・分解・除去してくれています。
でも、ミクリグリアにだってキャパシティがあり、あまりにたくさんの病的蛋白を処理しなければならないと、お腹いっぱいですぐにキャパ超えしてしまいます。
そんな時、ミクログリア達はどうしているのでしょうか?
今回、ドイツ・Bonnメディカルセンターの Dr. Heneka らの研究グループは、
ミクログリア同士がナノチューブを介して α-syn フィブリル(PFF)を受け渡し、お互い助け合ってα-syn PFFを除去している、という事を報告しました [1]。

ミクログリアはナノチューブを介して、お隣さんにα-synをおすそ分けする
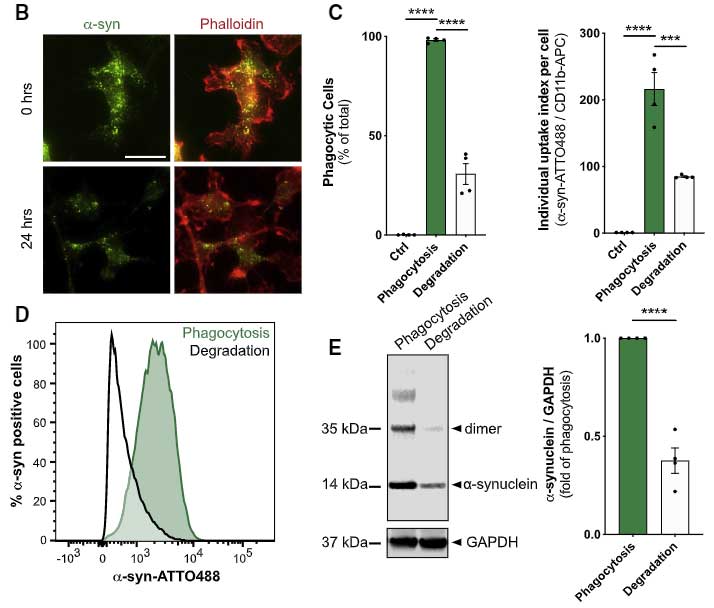
ミクログリアは α-syn PFF を貪食する
彼らはまず、α-syn PFF を初代培養ミクログリアに処置し、ミクログリアが α-syn PFF を貪食すること、それによって炎症系のカスケードが動いている事を確認しました。
しばらく観察していると、ミクログリアの α-syn 除去機能が落ちてきているようにみえ、
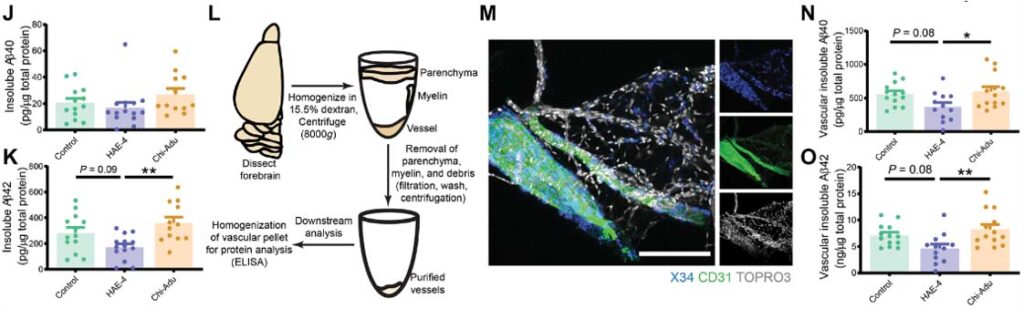
実際、24時間経っても 40-50% の α-syn が分解されずに残っていました。
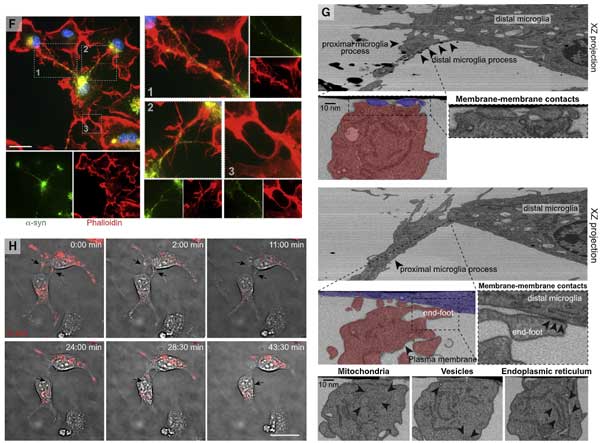
α-syn でお腹いっぱいになったミクログリアは、ナノチューブを介して隣のミクログリアに α-syn を受け渡している
タイムラプスイメージングや電験で詳しく観察すると、
ミクログリアは隣のミクログリアとナノチューブで繋がっており、
α-syn を取り込んだドナー細胞から空のレシピエント細胞へ、ナノチューブを介して、3-60 min くらいかけて α-syn を移動させている様子が確認できました。
この現象は、α-syn が少ない状態では起こらず、処置した α-syn の量が多い(>0.25 μM)時にのみ起こっていました。
Aβ やタウではどうなるのか調べてみたところ、Aβ やタウも僅かには受け渡しがあったものの、α-syn に比べるとずっと少ない割合でした。
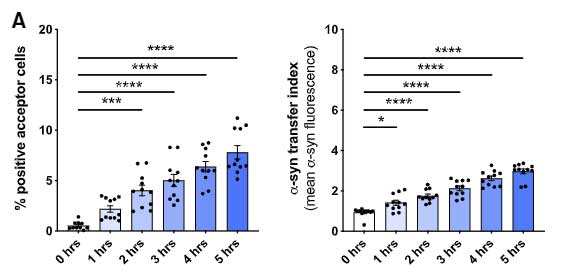
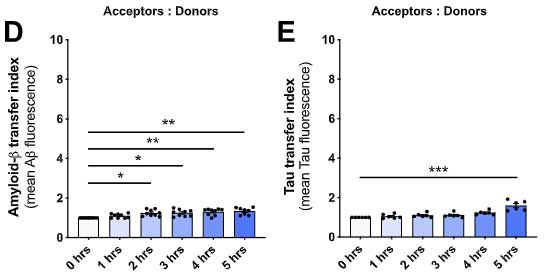
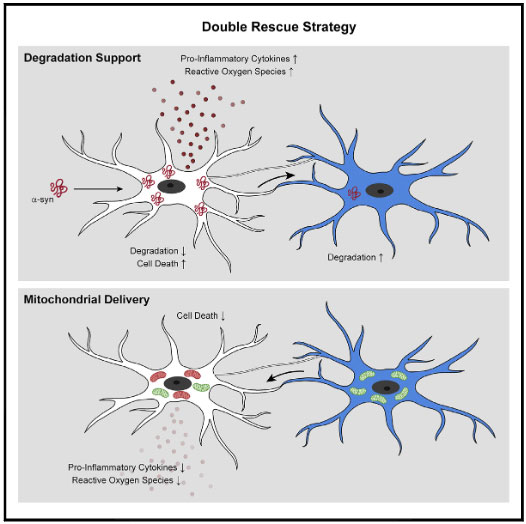
以上の結果から、ミクログリアは処理すべき α-syn の量が多くなると、ナノチューブを介して隣のミクログリアに α-syn をおすそ分けし、
α-syn 分解を協力してもらう、という可能性が示唆されました。

ナノチューブによるα-synの受け渡しに F-アクチンが必要
最初の FACS の解析で、α-syn 処置 ミクログリアでは Rho の発現が上がっていたので、
著者らは、細胞骨格形成に重要なアクチン-ミオシン複合体を調節する、Rho キナーゼの ROCK に注目しました。
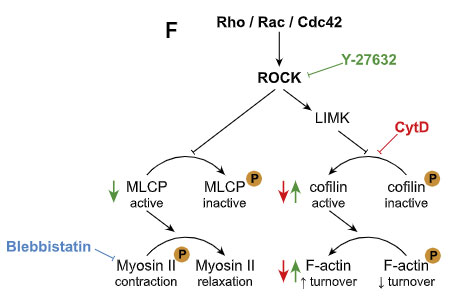
選択的 ROCK 阻害薬(Y-27632)や、ミオシンII阻害薬(Blebbistatin)で処置すると、ミクログリア間の α-syn 受け渡しが増え、
CytD で F-アクチンのターンオーバーを阻害すると、ミクログリア間の α-syn 受け渡しが減りました。
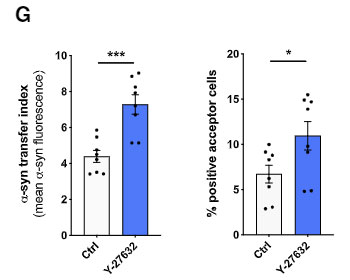
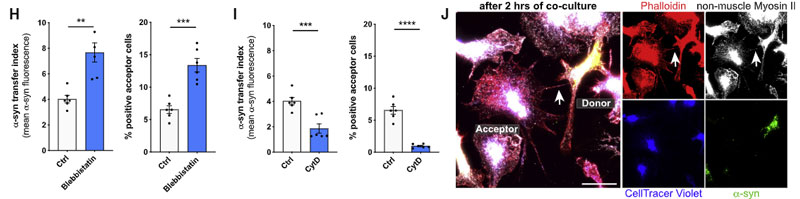
また、Cre-loxP システムで ROCK1 を阻害したマウス由来のミクログリアでは変化がありませんでしたが、ROCK2 を阻害したマウス由来のミクログリアでは α-syn の受け渡しが増えていました。
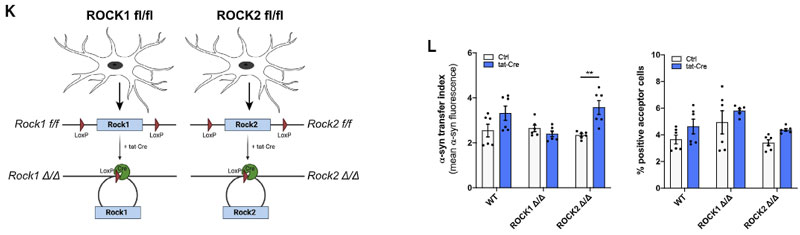
以上の結果から、ナノチューブを介した α-syn の受け渡しには、F-アクチンが必要で、
ROCK が活性化されると、下流のアクチンーミオシン複合体を調整して、ミクログリア間の α-syn の受け渡しを阻害する可能性が示唆されました。
α-syn を受け渡すと、炎症反応が落ち着く
α-syn を受け渡したミクログリアに、なにか変化はあるでしょうか?
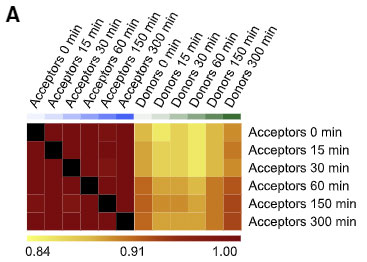
著者らは、共培養した α-syn ドナー細胞と α-syn レシピエント細胞を FACS でソートして RNAシークエンスで確認しました。
ドナー細胞とレシピエント細胞は、共培養直後(0 min)には、いくつか遺伝子発現に違いがありましたが、
共培養5時間後(α-syn 受け渡し後)には、その違いが小さくなっていました。
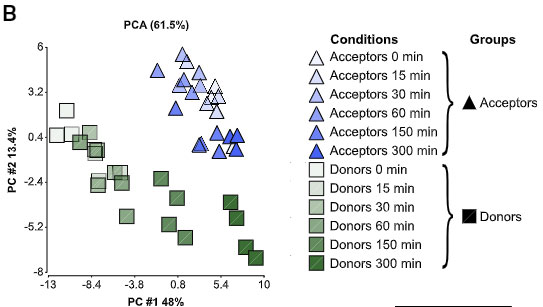
GO解析でみると、
- 炎症反応の調節
- アポトーシスシグナル経路
関連の遺伝子プロファイル etc. が、α-Syn 処置後のドナー細胞で上がっており、それらの変化は、レシピエント細胞との共培養5時間後に落ち着いてきていました。

レシピエント細胞からはミトコンドリアを受け渡し、ドナー細胞をα-SynによるROSと細胞毒性から守っている
α-syn の受け渡しの他に、ドナー/レシピエント細胞間でどのような事が起こっているのでしょうか?
著者らは、ドナー細胞の脆弱性(SYTOXの染色性↑)が、α-syn 処置後に上がり、レシピエント細胞との共培養で改善する事を発見しました。
それと並行して、ミトコンドリアの密度と活性酸素種(Reactive Oxygen Species, ROS)も同様に変動していました。
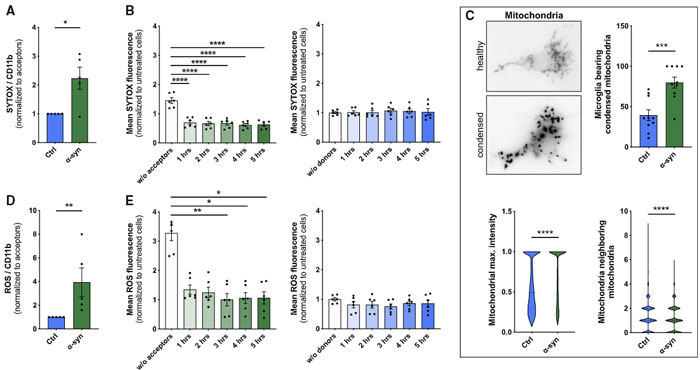
ROS スカベンジャーの N-Acetylcystein(NAC)と、ROS を発生させる過酸化水素(H2O2)で確認したところ、
- ROS↑ で α-Syn の受け渡しも増える
- ROS↓ で α-Syn の受け渡しも減る
という結果が得られ、
ROS が α-Syn の移動に影響を及ぼしている可能性が示唆されました。
ROS といえばミトコンドリア!とゆーことで、著者らは MitoTracker でミトコンドリアを標識し、上記の系で観察したところ、
レシピエント細胞からドナー細胞へ(健全な)ミトコンドリアが移動しており、
それと呼応するようにドナー細胞のアポトーシス関連シグナルも減少していきました。
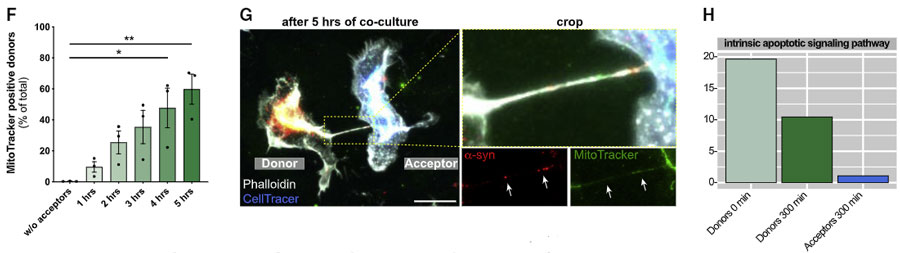
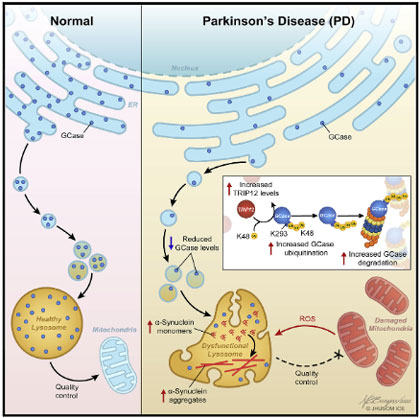
LRRK2 G2019S 変異では、ミトコンおリアの受け渡しが障害されている
家族性パーキンソン病で最もよくみられる変異である、LRRK2遺伝子のG2019S変異では、ミトコンドリア障害との関連が示唆されています。
著者らは、ナノチューブによるミトコンドリアの受け渡しが、LRRK2 G2019S 変異で影響を受けるかどうか調べてみました。
すると、
- 両方ともWT:レシピエント細胞からドナー細胞へ健全なミトコンドリアが移動し、ドナー細胞の ROS は下がる
- ドナー細胞がG2019S:レシピエント細胞からドナー細胞へ健全なミトコンドリアが移動し、ドナー細胞の ROS は下がる
- 両方ともG2019S:レシピエント細胞のミトコンドリア機能が障害されており、ドナー細胞の ROS は上がる
- レシピエント細胞がG2019S:レシピエント細胞のミトコンドリア機能が障害。ドナー細胞には変化なし
という結果が観察されました。
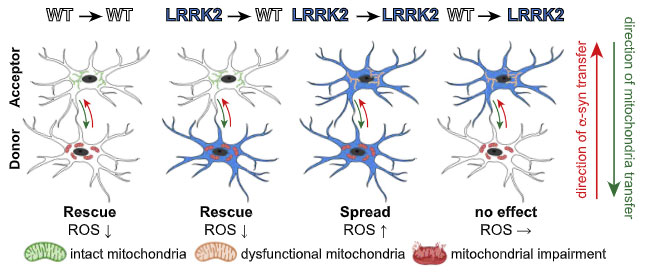
レシピエント細胞から健全なミトコンドリアを受け取ったドナー細胞は、細胞膜の脆弱性(SYTOX で評価)が回復しており、
ミクログリアは、
- キャパ超えした α-Syn を隣のミクログリアに受け渡し、
- お隣からは健全なミトコンドリアを受け取って自身の機能回復を図り、
- そしてその一連の機能はレシピエント側の LRRK2 G2019S 変異で障害される
という可能性が示唆されました。
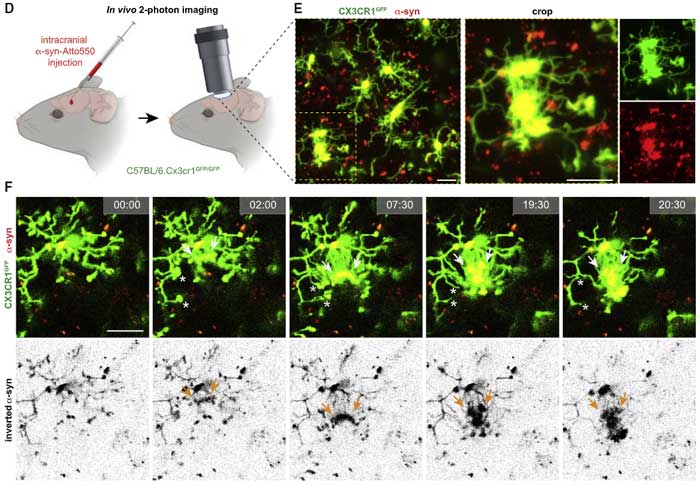
マウスでも確認
上記のメカニズムをもっと上位の系でも確認するため、
著者らは、マウスのスライスカルチャーに α-Syn PFF を処置した初代培養ミクログリア(トレーサー付き)を注入し、
ミクログリア同士がナノチューブで繋がって α-Syn を受け渡す様子を観察しました。

また、Cx3cr1GFP でミクログリアを緑色に蛍光標識したマウスに、Atto550 で赤色に蛍光標識した α-Syn を注入し、
- α-Syn 注入箇所のミクログリアが周囲のミクログリアとコネクションを作り、α-Syn を受け渡している様子
- α-Syn を受け渡したドナー細胞がその後チューブを引っ込める様子
- また近くに適当なミクログリアを探せなかったドナーミクログリアが、α-Syn を自身の細胞体まで戻す様子
などが観察されました。
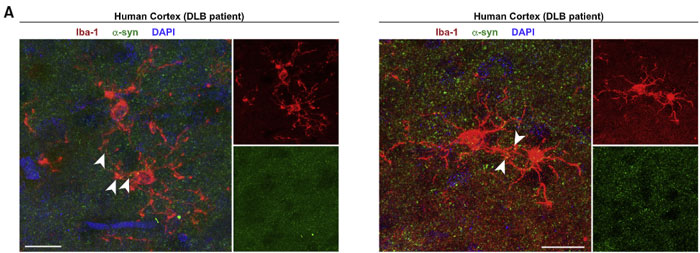
ヒトでも確認
シヌクレイノパチーの代表である レヴィ小体型認知症(Dementia with Lewy bodies, DLB)や 多系統萎縮症(Multiple system atrophy, MSA)の患者さんの剖検脳を観察すると、
α-Syn をいっぱい溜め込んだミクログリアが近隣のミクログリアとコネクションを作っている様子が観察されました。
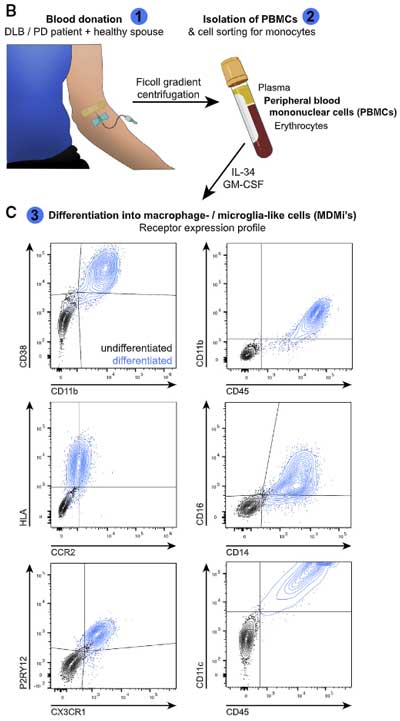
そこで著者らは、DLB 患者さんと健常人の末梢血単核細胞(peripheral blood mononuclear cells, PMBCs)からマクロファージ/ミクログリア様細胞(macrophage-/microglia-like cells, MDMi's)を単離して、上記と同様の共培養実験を行いました。
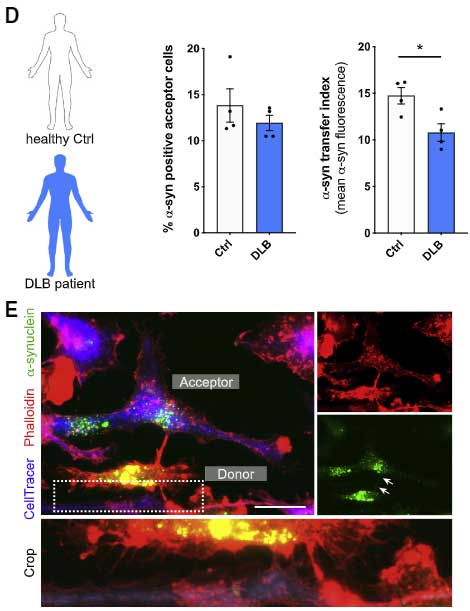
すると、DLB 患者さん由来の PBMCs では、健常人と比べて α-Syn の受け渡しの程度が下がっており、ROS の産生が上がっていました。
以上、in vitro, ex vivo, in vivo モデルの結果から、
α-Syn をミクログリアが貪食
↓
キャパ超えになると、ナノチューブを介して隣のミクログリアに α-Syn をお裾分け
↓↑
お隣からは健全なミトコンドリアをもらって自身の機能回復に努める
:
LRRK2 G2019S 変異があると、このメカニズムが狂う
という機序が考えられました。

Microglia are the CNS resident immune cells that react to misfolded proteins through pattern recognition receptor ligation and activation of inflammat…
My View
ナノチューブって、私は実際に見たことはないのですが、
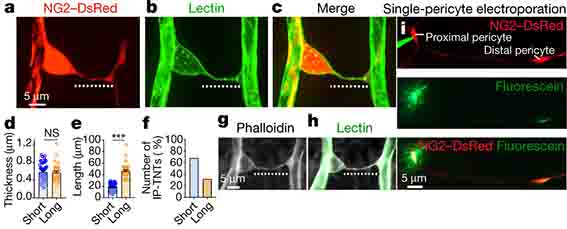
神経細胞同士のナノチューブはタウやα-Synの伝播に関与すると言われていたし [2]、ペリサイト同士のナノチューブは連携して血流調節に関与するという報告もあり [3]、
細胞間同士のナノチューブの存在は、in vitroやex vivoの実験で以前から指摘されていましたが、 今回、カナダ・モンテリオール大学のAlarcon-Martinezらの研究グループは、 マウスの網膜と脳内でペリサ …
「細胞同士がお互い繋がって影響しあっている感じが面白いな。」と思っています。
今回は、ミクログリア同士がナノチューブで繋がり、α-Syn やミトコンドリアを受け渡している、という内容でした。
ビデオがわかりやすく、何度も再生して見てしまいました。
Aβ やタウでもちょっとは受け渡しが行われていたようですが、α-Syn に比べるとずっと少なかったようで、
「なんでかなー。特に Aβ とか、めっちゃ関係してそうだけど。」
とちょっと不思議に思いました。
実験系で最後までよくわからなかったところは、Rho-ROCK のあたり。
最初に α-Syn を処置したミクログリアの RNAseq では Rho が上がっているから ROCK は活性化されている、という事だと思うんですが、
ROCK の活性化は逆にF-アクチンのターンオーバーを抑えるから、この論文で示している結果が本当なら、F-アクチン↓ でナノチューブを介した α-Syn の受け渡しは減る、という事になると思います。
ネガティブフィードバックって事かな?
こんな感じで矛盾する結果がでた場合、たいてい "regulate" という言葉を使う事が多いですが、この論文でもそんな感じで表現されていて、ちょっとすっきりしませんでした。
私の解釈が間違っているのかなー。もしそうなら誰か指摘していただけると嬉しいです。
あと最後にヒトのデータで補強しようとしていると思うんですが、
ちょっとこのヒトデータは「うーん……」と思いました。
まず免染の画像がちょっとわかりにくく、DLB 患者さんの免染は、たまたまα-Syn(と主張する)緑のドットが Iba-1の赤に重なったところをピックアップしているだけに見えるとゆーか……
MSA 患者さんの方は Suppl で 3D 再構成でも示してくれてはいるんですが……どうなのかな……?
細胞培養やα-Synの局所注入でそのような現象が起こるのは確かかもしれないですが、
普通に考えて、無処置の脳内で α-Syn がそんな極狭な局所に分布するわけないので、あるミクログリアはお腹がいっぱいで、すぐ隣のミクログリアはスカスカって状況が本当に起こりうるのでしょうか?
しかも細胞培養では、高用量の α-Syn 処置時にしかこの現象が起こらないみたいなので、そんな高勾配な状況がヒトの脳内で起こっている可能性は更に低そうに思います。
あと一番最後に DLB患者さんから単離した MDMi's では ナノチューブを介した α-Syn 受け渡し機能が落ちている、という結果を出していますが、
この現象を、DLBの発症と関連付けるのはちょっと無理があるように思います(もちろん、彼らもそこまで言及はしていないですが)。
この論文の現象が本当に起こっていたとしても、DLB 全体の病態に寄与する割合はかなり低いんじゃないかと思うので。
コントロールとDLB患者さんの年齢がマッチしているかどうかとか、そこらへんの情報がないので、この結果だけ見せられてもなんとも言えないなー……と思いました。
References
- Scheiblich H, Dansokho C, Mercan D, Schmidt SV, Bousset L, Wischhof L, Eikens F, Odainic A, Spitzer J, Griep A, Schwartz S, Bano D, Latz E, Melki R, Heneka MT. Microglia jointly degrade fibrillar alpha-synuclein cargo by distribution through tunneling nanotubes. Cell. 2021 Sep 30;184(20):5089-5106.e21. doi: 10.1016/j.cell.2021.09.007. Epub 2021 Sep 22. PMID: 34555357.
- Guo JL, Lee VM. Cell-to-cell transmission of pathogenic proteins in neurodegenerative diseases. Nat Med. 2014 Feb;20(2):130-8. doi: 10.1038/nm.3457. PMID: 24504409; PMCID: PMC4011661.
- Alarcon-Martinez L, Villafranca-Baughman D, Quintero H, Kacerovsky JB, Dotigny F, Murai KK, Prat A, Drapeau P, Di Polo A. Interpericyte tunnelling nanotubes regulate neurovascular coupling. Nature. 2020 Sep;585(7823):91-95. doi:10.1038/s41586-020-2589-x. Epub 2020 Aug 12. PMID: 32788726.