「オートファジー」は、生態系の恒常性を維持する為になくてはならないものであり、アルツハイマー病(Alzheimer's disease, AD)を含む数々の変性疾患でオートファジー機能障害との関連性が示唆されています [1]。
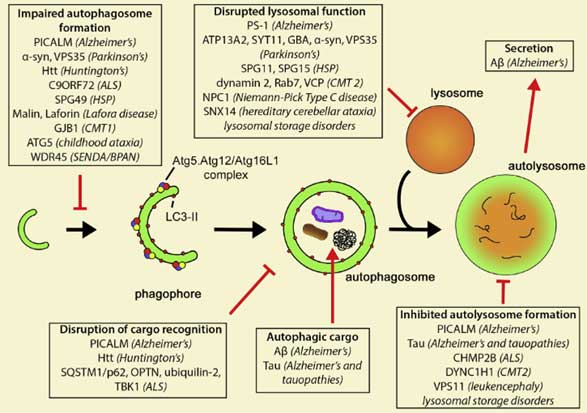
オートファジーは、ノーベル賞を受賞された大隅先生らが酵母で多くの関連遺伝子を同定され、 最近では、発生と分化、がんや神経変性疾患、廊下、免疫応答、抗原提示、細胞死、病原体の排除など、実に多くの機構に関与している事がわかっ …
アルツハイマー病 (Alzheimer's disease, AD) の主要病理の一つ、タウは、リン酸化の他、アセチル化、ユビキチン化、SUMO化、ニトロ化など、色々な翻訳後修飾(post-translational m …
ゴーシェ病の原因遺伝子 GBA1。 GBA1 はリソソーム脂質加水分解酵素グルコセレブロシダーゼ(Glucocerebrosidase, GCase)をコードする遺伝子で [1] 、GBA1のホモ変異でGCaseの活性が …
ミスフォールドされたタンパクは、ユビキチン・プロテアソーム系(ubiquitin proteasome system, UPS)やマクロオートファジー、シャペロン介在性オートファジー(chaperone‐mediated autophagy, CMA)などの様々な分解機構で分解されますが [2] 、アミロイドβ(amyloid beta, Aβ)やタウの凝集体のような大きな塊は、マクロオートファジー(狭義のオートファジー)と呼ばれる機構でガバッと取り込まれて分解される事が多いと言われています [1, 3] 。
オートファジーとADとの関係については他にも、
- ADのリスク遺伝子変異の中に、オートファジー関連遺伝子が含まれている [1]。
- AD患者さんやADマウスモデルの脳内ではオートファゴソームが増えていて、その後のリソソームのクリアランスが障害されている [4, 5]
など、数多くの報告があります。
今回、アメリカ・ニューヨーク大学の Dr. Lee, Dr. Nixonらの研究グループは、
「細胞内のオートリソソーム異常が細胞外のアミロイドプラーク形成の起源だった」
という内容を報告しました。

"細胞外"のAβプラークの起源は"細胞内"のオートリソソームだった
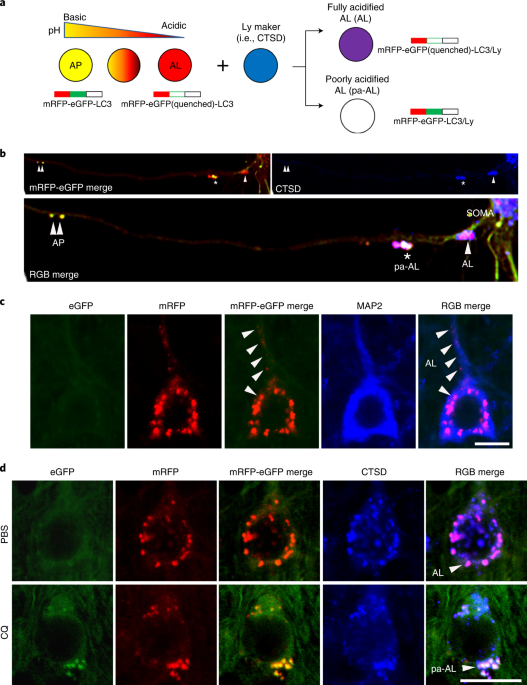
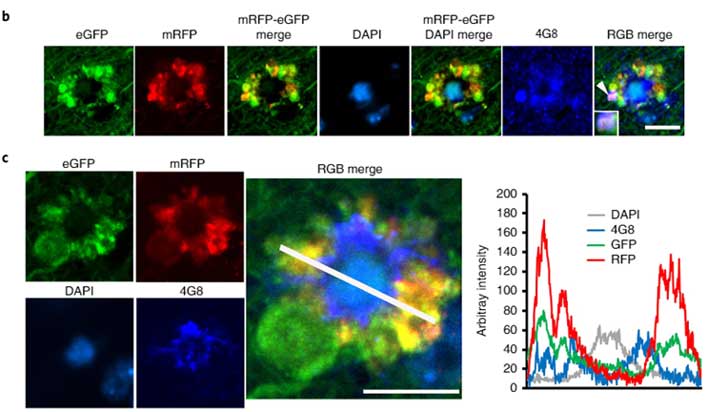
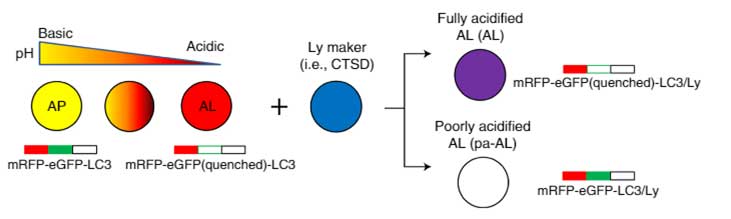
pHの変化をセンサーするコンストラクトの作成
彼らは、
- pH抵抗性のmRFP
- pH感受性のeGFP(pH6.0以下で消える)
- LC3(オートファゴソーム/オートリソソームをモニターするため)
の配列を3つ繋げたコンストラクトを作製しました。
このコンストラクトを発現した細胞では、
- pH6.0以下では赤色のシグナル(緑が消えて、赤のみ発現)
- pH6.0以上では黄色のシグナル(赤と緑が両方発現)
として可視化されます。
リソソームタンパクを青色で標識して蛍光をmergeさせると、
- pH6.0以下のオートリソソーム内ではマゼンダのシグナル(赤+青)
- pH6.0以上のオートリソソーム内では白色のシグナル(黄色+青)
というように、シグナルの色でオートリソソーム内のpHを可視化することができます。
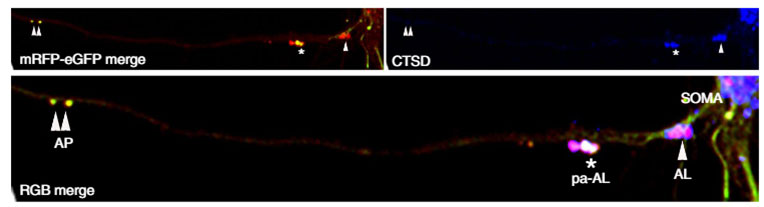
彼らはこのコンストラクト(tandem fluorescence-tagged LC3, tfLC3)をプライマリーニューロンに形質導入し、
- オートファゴソーム(リソソームと融合前)は黄色
- pHが6.0以下の正常なオートリソソームはマゼンダ
- pHが6.0以上の異常なオートリソソームは白
と、それぞれの小胞をシグナルの色で見分けられる事を示しました。
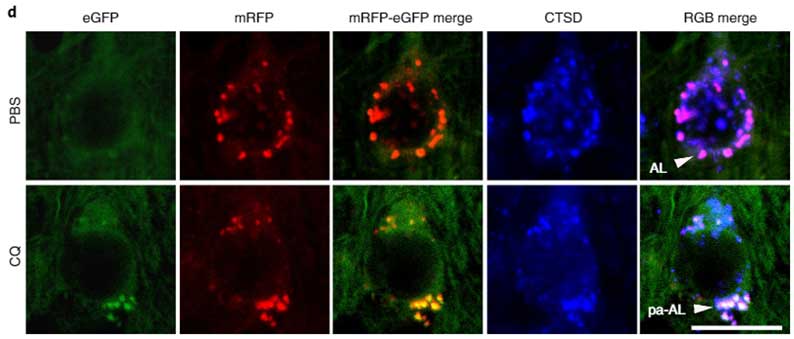
彼らは、このコンストラクトを導入したトランスジェニックマウスを作製しました。
クロロキン(Chloroquine, CQ)投与でリソソーム内のpHを上げると、緑色のシグナルが現れます。
APPトランスジェニックマウスでは、オートリソソーム内のpH低下が不十分
彼らは、このtfLC3マウスと、Tg2576マウス(APP KM670/671NL(Swedish変異)を導入)を交配させました。
このマウスは11-13ヶ月で細胞外Aβプラークが沈着しますが、そのもっと前の5ヶ月齢を観察すると、コントロールと比べて、pHが高いオートリソソーム(白色)が多くなっており、小胞のサイズも大きくなっていました。
またそれと呼応するように、小胞内のATPase活性も落ちていました。
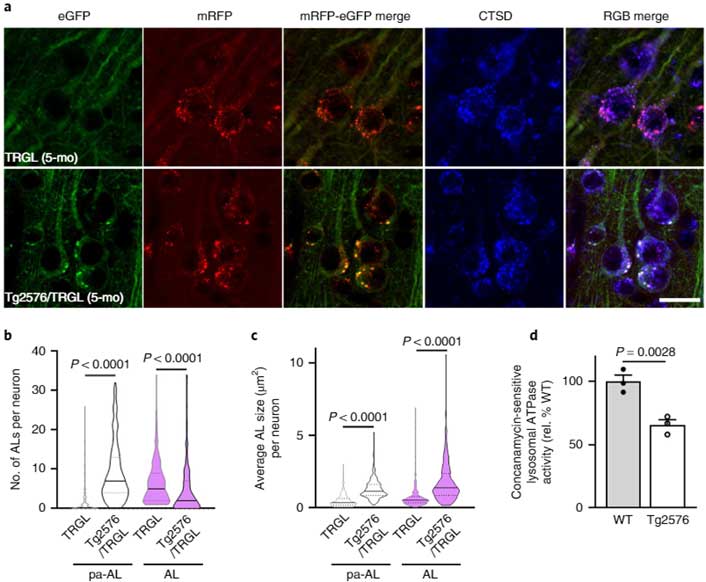
12ヶ月齢ではその割合はもっと高くなっており、小胞内のATPase活性も月齢依存的に下がっていました。
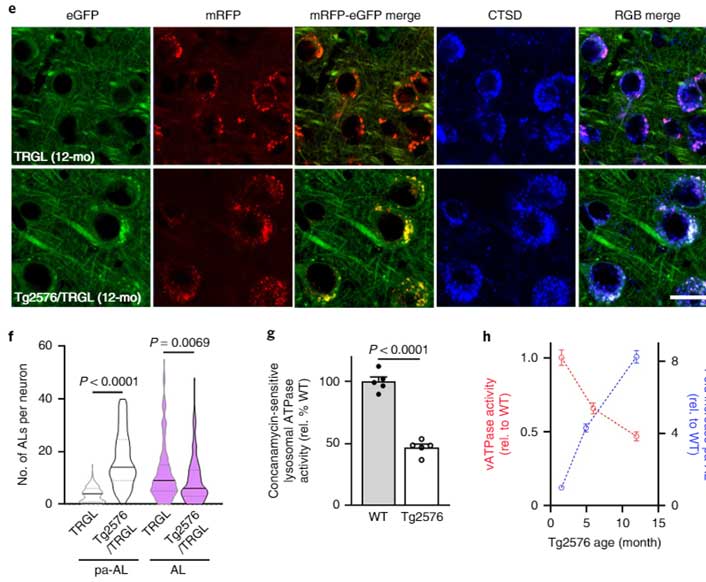
異常なオートリソソーム内にはAPP-βCTF/Aβ
彼らのラボは以前から、膨らんだオートリソソーム内にAPP-βCTF/Aβが溜まっている事を報告していたので [6, 7, 8]、彼らはこのオートリソソーム内にAPP-βCTF/Aβが溜まっているかどうか確認しました。
すると予想通り、pHの高い、異常なオートリソソーム内で、APP-βCTF/Aβの蓄積を認めました。
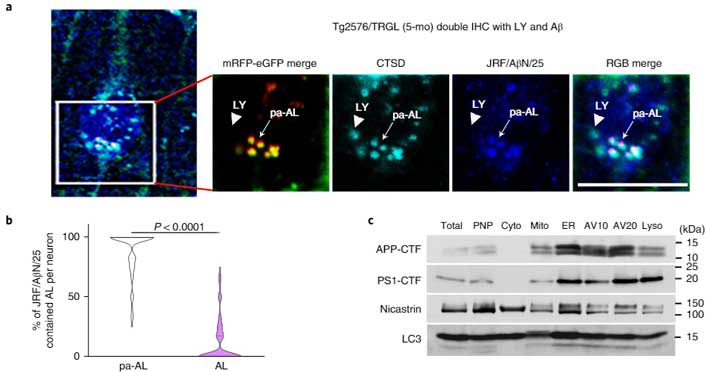
異常なオートリソソームはどんどん膨らむ
このマウスの10ヶ月齢を観察すると、pH↑の異常オートリソソームはどんどん大きくなっており、核周辺から細胞膜の外側に突き出すような形のものが多くなっていました。
色々なAPP/PS1マウスで確認
以上の現象がTg2576マウスだけでないことを確認するために、彼らはさらに4種類のAPP/PS1マウスを解析しました。
- D5XFAD (2.7 mo):
- APP KM670/671NL (Swedish)
- APPV717I
- PSEN1 M146L (A>C)
- PSEN1 L286V
- APP1716V
- TgCRND8 (1.9 mo):
- APP KM670/671 NL (Swedish)
- APP V717F (Indiana)
- PSAPP (3.1 mo):
- APP KM670/671NL (Swedish)
- PSEN1 M146L (A>C)
- APP51 (20 mo):
- human wild-type APP751
結果、全てのマウスで同様の以上リソソームを認めました。
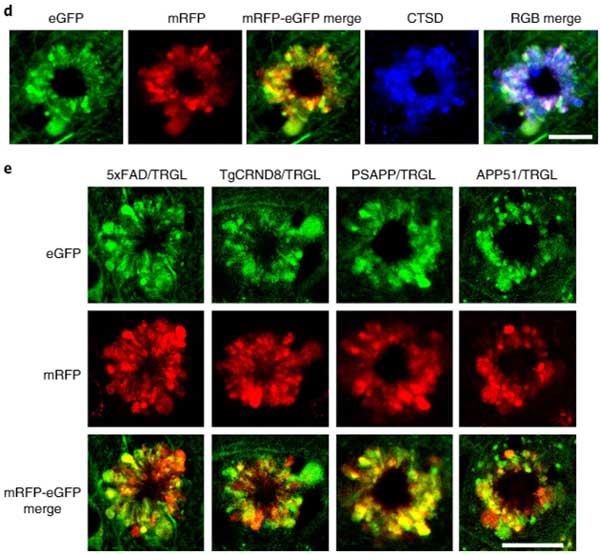
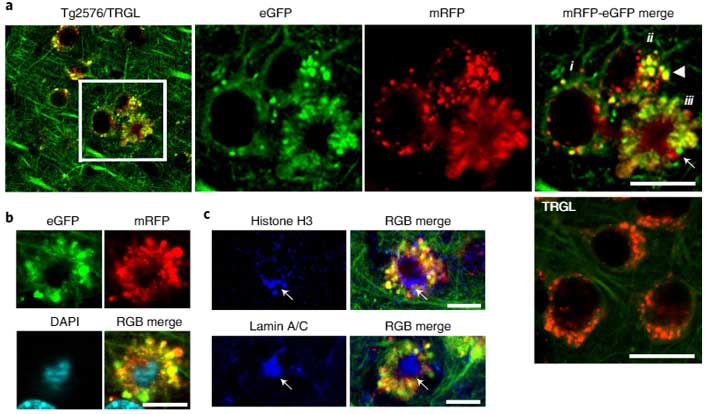
"PANTHOS"と命名
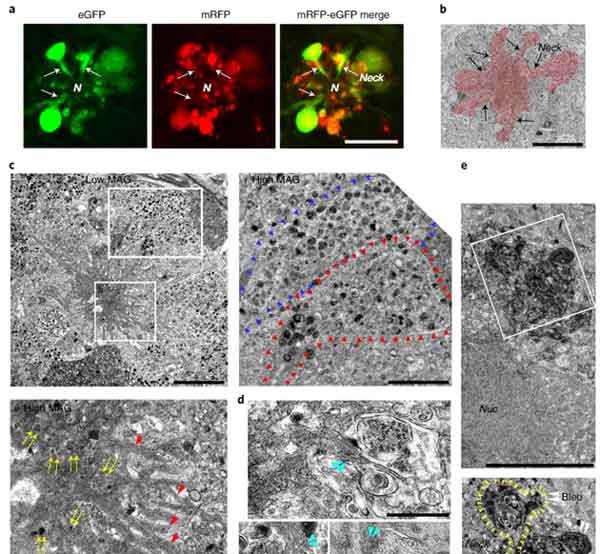
外に突き出た異常リソソームが花びらのようにみえることから、彼らはこの構造を ”毒のある花” という意味の "PANTHOS" と名付け、この構造を持つ神経細胞を "PANTHOS neuron" と名付けました。
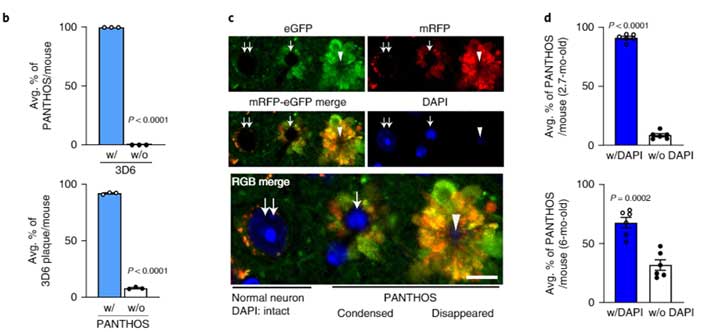
PANTHOSニューロンは、細胞の真ん中に核が残っており、そこから放射状に膨らんだ構造物の中に、たくさんの異常オートリソソームが含まれていました。
このPANTHOSの中に、たくさんのAβが蓄積していました。

PANTHOSとAβの関係を調べると、ほとんどのPANTHOSはAβを含んでいて、Aβ+細胞のほとんどはPANTHOS構造を持っていました。
またマウスを経時的に追っていくと、若齢では核を含むPANTHOSが多いのに対して、5XFAD;tfLC3の6ヶ月齢では、核が凝縮されたPANTHOSや、核のないPANTHOSが多く観察されました。
PANTHOS細胞ではリソソーム内成分の漏出が起こっている
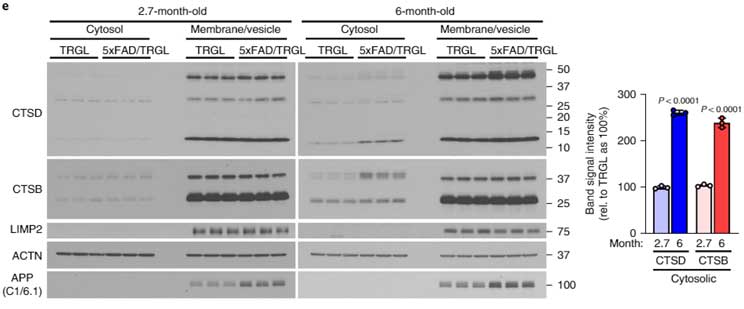
PANTHOS内のオートリソソームの状態を調べるため、彼らはマウス脳を
- 細胞質
- 細胞膜/小胞
の各画分にわけ、
- カテプシンD
- カテプシンB
などのリソソーム内酵素の量を調べました。
すると、5XFAD;tfLC3マウスの6ヶ月齢では、細胞質画分にリソソーム内酵素が増えており、リソソームから漏出している可能性が示唆されました。
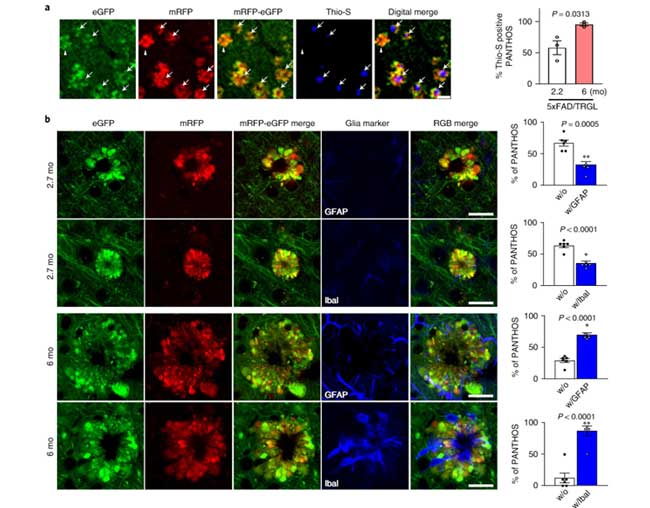
PANTHOS細胞→老人斑形成にグリアが関与?
Aβがアミロイドプラークを作っているかどうかを調べるため、彼らはチオフラビンSで共染色しました。
PANTHOS細胞内に見られる、チオフラビンS陽性(のアミロイドプラーク)は、月齢依存的に増えており、それと呼応するようにPANTHOS細胞にGFAP+アストロサイトやIba1+ミクログリアの浸潤が起こっていました。
これらの観察結果から、PANTHOS細胞が大きくなると同時にグリアが侵入してきて、アミロイドプラーク形成や細胞成分の除去を行っている可能性が考えられました。
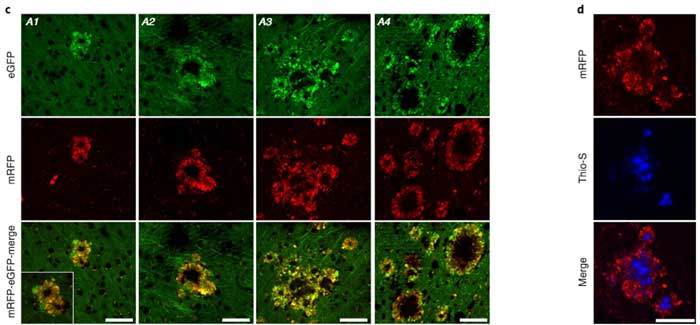
また、近くのPANTHOS細胞同士がジョジョに結合して大きくなり、真ん中にチオフラビンS陽性のアミロイドコアを形成している印象の像もたくさん見受けられました。
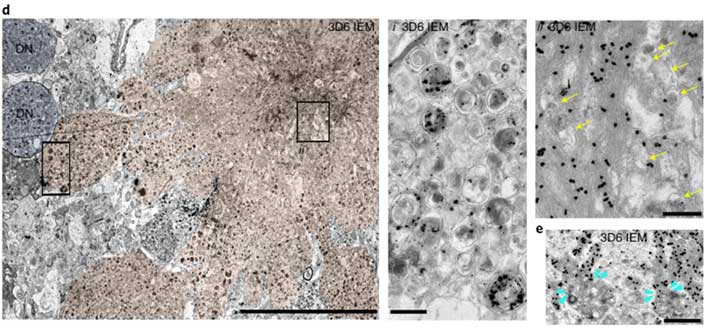
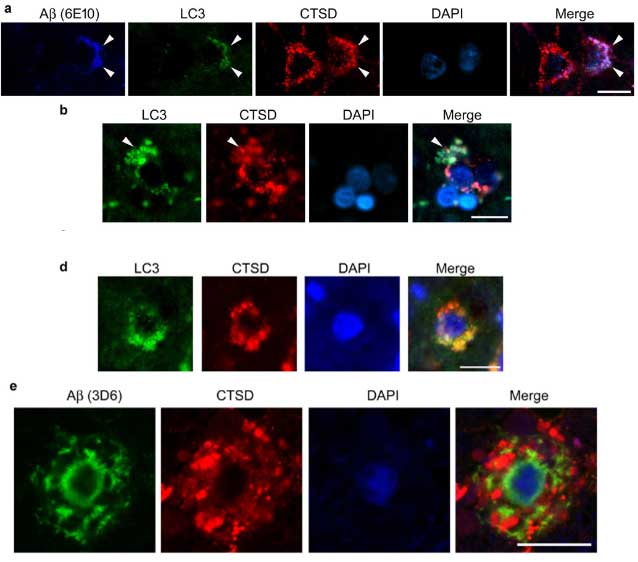
ヒトの脳内でもそれっぽい像が
彼らはヒト脳でも同じ現象が起こっているかどうか、BraakIIの海馬をLC3(オートファゴソーム), CTSD(リソソーム), 3D6(Aβ)などで多重染色してみました。
その結果、細胞内のオートリソソーム内にAβが蓄積している様子が観察され、PANTHOS様の構造内にAβが溜まっている様子も観察されました。
・
・
・
以上の結果から、
APP-βCTF/Aβ存在下で、オートリソソーム内のpH低下が障害される
↓
APP-βCTF/Aβを含んだオートリソソームが膨らみ、お互い結合してPANTHOS構造を作る
↓
リソソームからの酵素漏出が起こり、細胞が障害される
↓
グリアが侵入して細胞成分を処理し、Aβをアミロイド化してコアプラークを作る
↓
老人斑の完成
というメカニズムが考えられました。
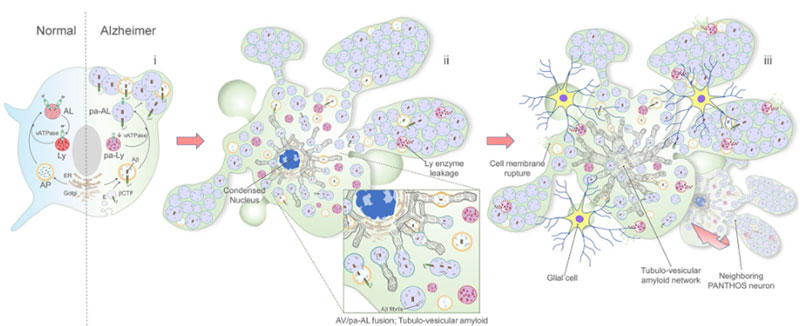
Interrogation of neuronal autophagy in vivo in Alzheimerʼs disease mouse models identified deficient autolysosome acidification as the basis for extreme autophagic stress, yielding β-amyloid accumulation within intact neurons, which are the main source of senile plaques.
My View
今まで「Aβプラークは細胞外」という認識が多かったと思いますが、その起源について、以前から細胞内のAβ蓄積説は度々耳にしていました [10, 11, 12]。
3xFADマウスでも「細胞外Aβプラークが貯まる前に細胞内にAβが蓄積する」と報告されており [13]、私自身も、人の病理を見ていて「細胞内にAβが溜まってそうだなー」と思う事が何度かあったので、今回の結果には納得しました。
今回の場合は、5種類のAPP/PS1マウスを使って、「pH低下が不十分な異常オートリソソーム内にAβが溜まり、それがどんどん膨らんでいく」ということを各ポイント毎の観察で示していました。
いやはや、5種類も作らなくて良かったんじゃないか、とも思いましたが……相当な労力じゃないでしょうか。
結構同じ遺伝子が入っていたりしているし、2,3種類に絞っても十分な気がします。
個人的には、せっかく二光子顕微鏡を使っているので、「同じPANTHOSニューロンを追いかけて、それが老人斑になるまでををずっと観察していく」という手法を取り入れてくれると、説得力が増していいんじゃないかと思いした。
最後あたりの、「グリアが侵入してきて細胞成分を処理し、Aβプラークをdense-coredプラークにまとめていく」という部分は、cross-sectionalに観察しただけですが、特にこの「PANTHOS形成→グリア侵入→老人斑形成」あたりを二光子顕微鏡で経時的に追えたら、もっとよかったなー、と思います。
……高望みし過ぎかもしれませんが。
References
- Ciechanover A, Kwon YT. Degradation of misfolded proteins in neurodegenerative diseases: therapeutic targets and strategies. Exp Mol Med. 2015 Mar 13;47(3):e147. doi: 10.1038/emm.2014.117. PMID: 25766616; PMCID: PMC4351408.
- Guo JL, Buist A, Soares A, Callaerts K, Calafate S, Stevenaert F, Daniels JP, Zoll BE, Crowe A, Brunden KR, Moechars D, Lee VM. The Dynamics and Turnover of Tau Aggregates in Cultured Cells: INSIGHTS INTO THERAPIES FOR TAUOPATHIES. J Biol Chem. 2016 Jun 17;291(25):13175-93. doi: 10.1074/jbc.M115.712083. Epub 2016 Apr 18. PMID: 27129267; PMCID: PMC4933232.
- Menzies FM, Fleming A, Caricasole A, Bento CF, Andrews SP, Ashkenazi A, Füllgrabe J, Jackson A, Jimenez Sanchez M, Karabiyik C, Licitra F, Lopez Ramirez A, Pavel M, Puri C, Renna M, Ricketts T, Schlotawa L, Vicinanza M, Won H, Zhu Y, Skidmore J, Rubinsztein DC. Autophagy and Neurodegeneration: Pathogenic Mechanisms and Therapeutic Opportunities. Neuron. 2017 Mar 8;93(5):1015-1034. doi: 10.1016/j.neuron.2017.01.022. PMID: 28279350.
- Nixon RA, Wegiel J, Kumar A, Yu WH, Peterhoff C, Cataldo A, Cuervo AM. Extensive involvement of autophagy in Alzheimer disease: an immuno-electron microscopy study. J Neuropathol Exp Neurol. 2005 Feb;64(2):113-22. doi: 10.1093/jnen/64.2.113. PMID: 15751225.
- Yang DS, Stavrides P, Mohan PS, Kaushik S, Kumar A, Ohno M, Schmidt SD, Wesson DW, Bandyopadhyay U, Jiang Y, Pawlik M, Peterhoff CM, Yang AJ, Wilson DA, St George-Hyslop P, Westaway D, Mathews PM, Levy E, Cuervo AM, Nixon RA. Therapeutic effects of remediating autophagy failure in a mouse model of Alzheimer disease by enhancing lysosomal proteolysis. Autophagy. 2011 Jul;7(7):788-9. doi: 10.4161/auto.7.7.15596. Epub 2011 Jul 1. PMID: 21464620; PMCID: PMC3359468.
- Cataldo AM, Petanceska S, Terio NB, Peterhoff CM, Durham R, Mercken M, Mehta PD, Buxbaum J, Haroutunian V, Nixon RA. Abeta localization in abnormal endosomes: association with earliest Abeta elevations in AD and Down syndrome. Neurobiol Aging. 2004 Nov-Dec;25(10):1263-72. doi: 10.1016/j.neurobiolaging.2004.02.027. PMID: 15465622.
- Jiang Y, Sato Y, Im E, Berg M, Bordi M, Darji S, Kumar A, Mohan PS, Bandyopadhyay U, Diaz A, Cuervo AM, Nixon RA. Lysosomal Dysfunction in Down Syndrome Is APP-Dependent and Mediated by APP-βCTF (C99). J Neurosci. 2019 Jul 3;39(27):5255-5268. doi: 10.1523/JNEUROSCI.0578-19.2019. Epub 2019 May 1. PMID: 31043483; PMCID: PMC6607756.
- Wirths O, Multhaup G, Czech C, Blanchard V, Moussaoui S, Tremp G, Pradier L, Beyreuther K, Bayer TA. Intraneuronal Abeta accumulation precedes plaque formation in beta-amyloid precursor protein and presenilin-1 double-transgenic mice. Neurosci Lett. 2001 Jun 22;306(1-2):116-20. doi: 10.1016/s0304-3940(01)01876-6. PMID: 11403971.
- Okazawa H. Intracellular amyloid hypothesis for ultra-early phase pathology of Alzheimer's disease. Neuropathology. 2021 Apr;41(2):93-98. doi: 10.1111/neup.12738. PMID: 33876503; PMCID: PMC8251586.
- Tanaka H, Homma H, Fujita K, Kondo K, Yamada S, Jin X, Waragai M, Ohtomo G, Iwata A, Tagawa K, Atsuta N, Katsuno M, Tomita N, Furukawa K, Saito Y, Saito T, Ichise A, Shibata S, Arai H, Saido T, Sudol M, Muramatsu SI, Okano H, Mufson EJ, Sobue G, Murayama S, Okazawa H. YAP-dependent necrosis occurs in early stages of Alzheimer's disease and regulates mouse model pathology. Nat Commun. 2020 Jan 24;11(1):507. doi: 10.1038/s41467-020-14353-6. PMID: 31980612; PMCID: PMC6981281.
- Shoji M, Iwakami N, Takeuchi S, Waragai M, Suzuki M, Kanazawa I, Lippa CF, Ono S, Okazawa H. JNK activation is associated with intracellular beta-amyloid accumulation. Brain Res Mol Brain Res. 2000 Dec 28;85(1-2):221-33. doi: 10.1016/s0169-328x(00)00245-x. PMID: 11146125.
- Oddo S, Caccamo A, Shepherd JD, Murphy MP, Golde TE, Kayed R, Metherate R, Mattson MP, Akbari Y, LaFerla FM. Triple-transgenic model of Alzheimer's disease with plaques and tangles: intracellular Abeta and synaptic dysfunction. Neuron. 2003 Jul 31;39(3):409-21. doi: 10.1016/s0896-6273(03)00434-3. PMID: 12895417.