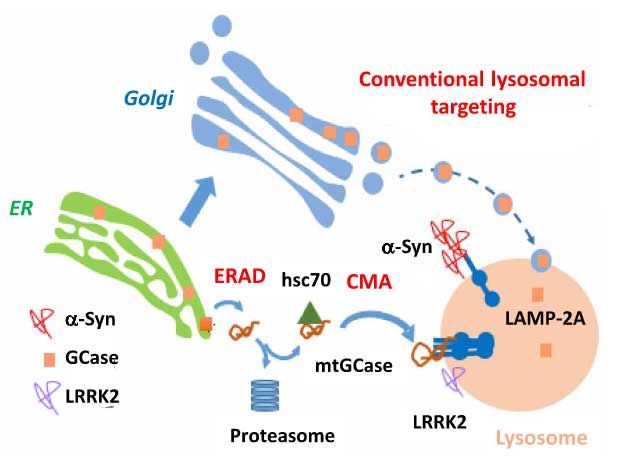
α-シヌクレイン(α-synuclein, α-Syn)は、パーキンソン病(Parkinson's disease, PD)やレヴィ小体型認知症(dementia with Lewy bodies, DLB)の主要病理であるレヴィ小体の構成蛋白の一つで、この蛋白をコードする遺伝子 SNCA の変異は、家族性PDの原因遺伝子の一つにもなっています。
- SNCAの点変異
- SNCAの二重・三重化変異
……の変異は有名で、点変異に関してはほとんどが amphipathic region にありますが [11] 、
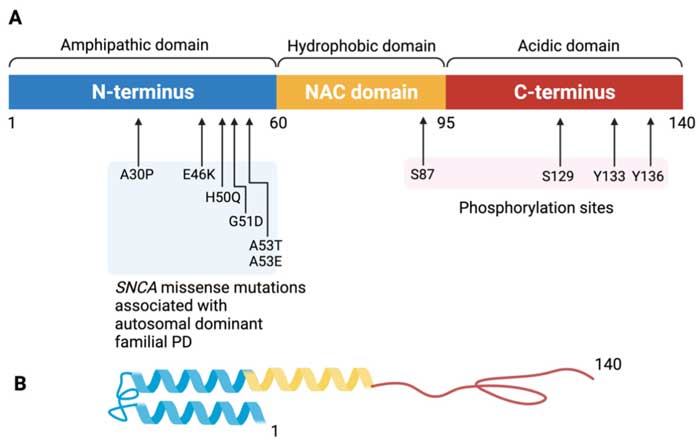
実は2年程前に SNCA の non-amyloid-β component (NAC)ドメインに新たな点変異(E83Q)が報告されていました [12] 。

この症例報告は、臨床的にピック病(Pick's disease, PiD)と診断された1家系の解析で、患者は脳の海馬と側頭葉に強い萎縮をきたします。
病理学的には,強い前頭側頭葉の神経障害を認めるものの、タウもTDP-43も陰性で、代わりに多くのα-Syn陽性レヴィ病理を認めました。
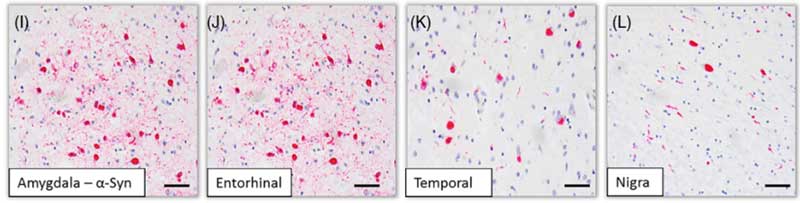
このレヴィ病理は、扁桃体、海馬、側頭葉などに多く、PDに特徴的な黒質緻密部にはむしろ少なめだったそうです。
そしてゲノム解析でSNCA の non-amyloid-β component (NAC)領域にE83Q点変異を認め、家族性レヴィ小体病(Lewy body disease, LBD)の新規遺伝子変異として報告されました。
また、多系統萎縮症(multiple system atrophy, MSA)でもこのE83Q変異でレヴィ病理をきたす症例が報告されており [13] 、この症例では特に海馬にレヴィ病理を多く認めました。
このNAC領域は、α-Synの凝集形成への関与も示唆されており [14]、E82Q が α-Syn の病理病態機序に対してどのような機能を持つのか、気になるところです。
とゆーことで、今回、スイス・Brain Mind 研究所 Ecole Polytechnique Fédérale de Lausanne (EPFL) の Dr.Lashel らの研究グループは、α-Syn E83Q 変異の病態機序について調べました [15] 。

新たに登場した家族性パーキンソン病のα-シヌクレイン変異:NAC領域変異(E83Q)の解析
E83Qはα-Synのモノマーの動きにちょっと影響する
彼らはまず、野生型(wild-type, WT)とE83Q変異のリコンビナントα-Synを作製し、モノマーの状態での動きや、他のモノマーとの集まり方などを、円偏光二色性(circular dichroism, CD)(Glossary 参照) で調べました。
α-Synは、モノマーの状態では特定の構造を示さない natively unfolded proteins (NUPs) として知られていますが、今回作製した リコンビナントα-Synモノマーも、液体の中でダイナミックな動きをしていました。
彼らは、イオンモビリティーで平均の形やサイズなど、液体の電荷によっての変化を調べました。
ある特定の電荷で、WTもE83Qも4つの特徴的な形態を示し、E83Qはその形態が少しだけシフトしていました。
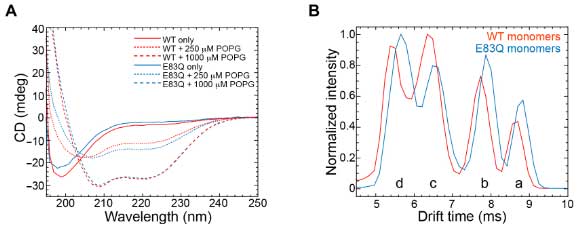
E83Q変異がモノマーの安定化などに影響あるか調べるましたが、ある特定の電荷で、構造は安定化したり不安定化したりと、どっちつかずの結果でした。
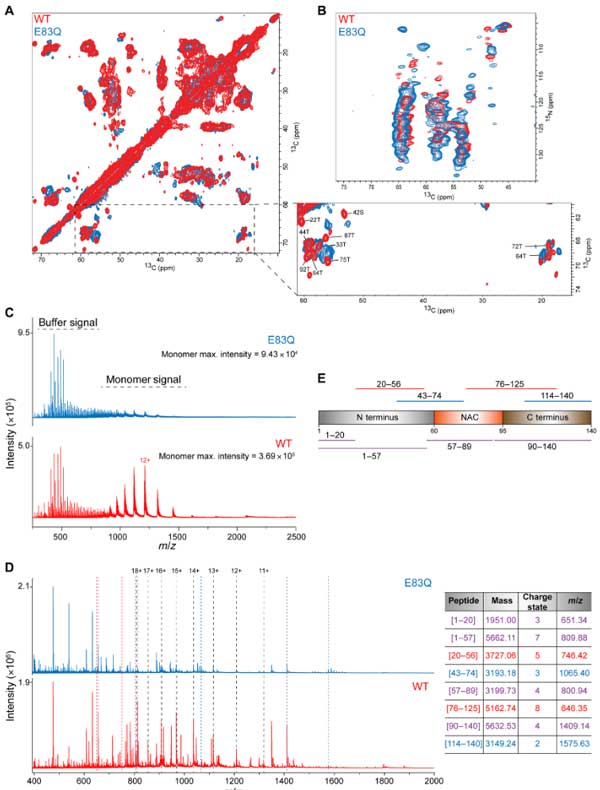
彼らはさらに核磁気共鳴(nuclear magnetic resonance, NMR)で、モノマーの構造についてより詳しく調べました。
chemical shifts perturbations (CSPs) を調べると、変異部(グルタミン酸→グルタミン)で -OH → -NH2 、という僅かな変化がある以外に、その近くのQ79でも変化が起こっており、N末の 1-29aa のNMRシグナル強度が上がっていました。
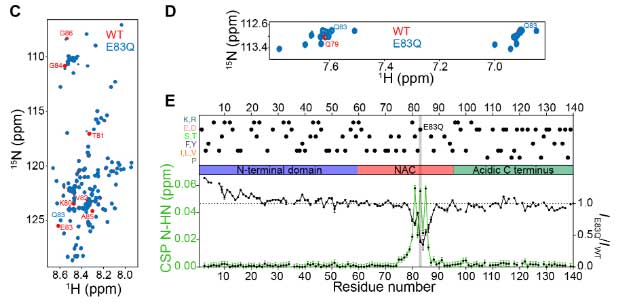
以上、CDとNMRの結果から、E83Q変異によって、モノマーの動きに若干の変化があることがわかりました。
E83Qは脂質二重膜との相互関係にはあまり影響しない
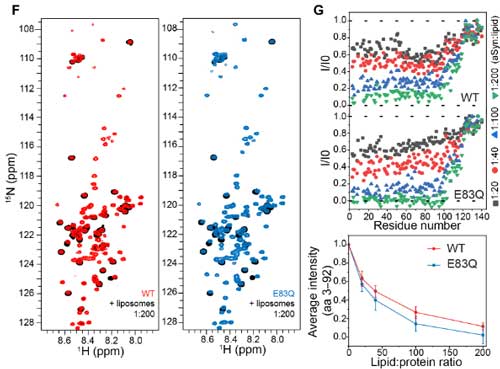
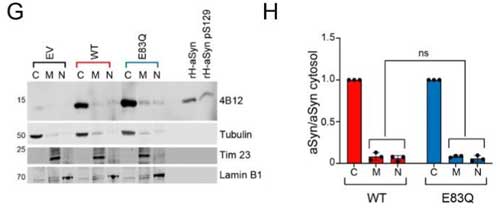
E83Qのあたりはα-Synが脂質二重膜との結合部分の遠位部に当たるので、彼らはこの変異が脂質二重膜との関係に影響するかどうか調べました。
NMRでは、E83Qは膜結合をちょっとだけ強くするという結果でしたが、
実際に細胞(HEK293)にE83QとWTを過剰発現させて細胞質、膜、核の画分をそれぞれウェスタンブロッティング(western blotting, WB)で調べると、そこまで違いはなさそうでした。
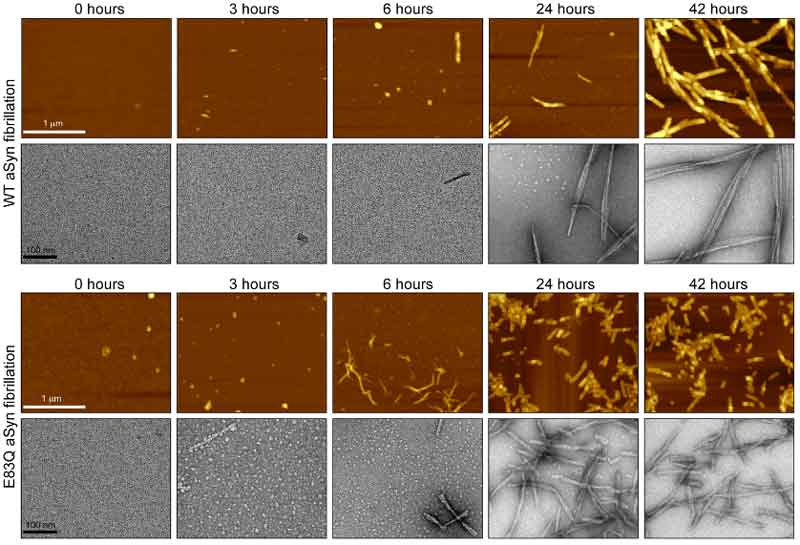
E83Qはフィブリル化が速く、小さくてねじれた形のフィブリルになる
次に彼らは、WTとE83Qのα-Synをフィブリル化して、原子力間顕微鏡(atomic force microscope, AFM)と透過電子顕微鏡(transmission electron microscope, TEM)を使って、フィブリル化のキネティクスを調べました。
結果、全ての蛋白濃度の条件下で、E83Qは、WTと比べてフィブリル化の速度が速く、
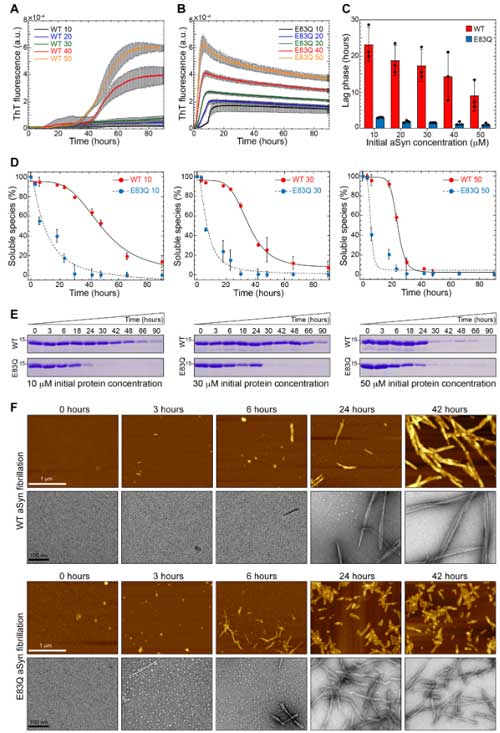
またできあがったフィブリルはWTよりも短く、ねじれの多い構造になっていました。
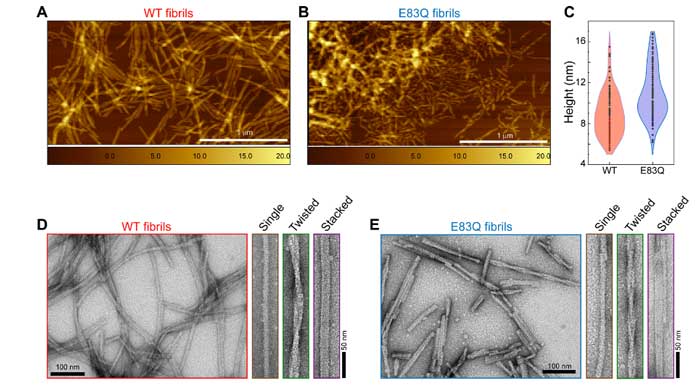
| フィブリルの長さ | ~1 µm | 180 ± 97 nm | |
| ねじれ間の長さ | 124.7 ± 28.2 nm | 75.2 ± 14.3 nm | |
| フィブリルの種類 | |||
| Single | ~53% | ~45% | |
| Twisted | ~18% | ~39% | |
| Stacked | ~29% | ~16% | |
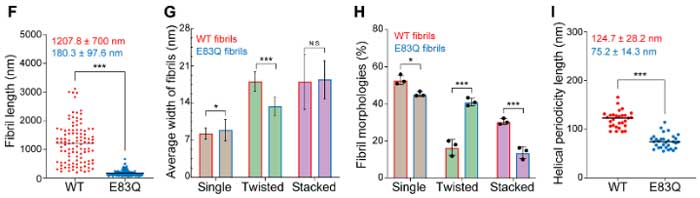
E83はα-Synフィブリルコア内にあるので、ここのグルタミンへの変異がフィブリル構造に影響を与えると考えられました。
E83Qフィブリルは安定性が高い
E83Qでできたフィブリルの安定性を調べる為、彼らはプロテイナーゼK(proteinase K, ProK)を0-2.0 μg/mlの濃度に振ってWTとE83Qのフィブリルをそれぞれ30分間ずつ処置し、フィブリル分解の速度を調べました。
結果、E83Qフィブリルの方はProK抵抗性を示し、WTとくらべてフィブリルが分解されにくい事が示唆されました。
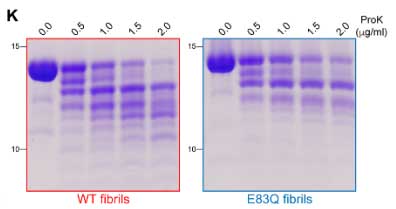
さらに彼らはssNMRを使ってProK処置前後の構造の違いを調べ、こちらでもE83Qの方が安定化が高い事が示されました。
E83Qは細胞内でオリゴマーを形成しやすく、細胞毒性が高い
次に、E83Qが細胞内のα-Syn凝集体形成に影響するかどうか、
- M17
- HEK283
- HeLa
の3種類の細胞株にWT or E83Qのα-Synを過剰発現させ、凝集体ができるかどうか調べました。
過剰発現だけでは、WTもE83Qも大きな凝集体は作らず、小さな puncta ができる程度で、S129のリン酸化も認めませんでした。
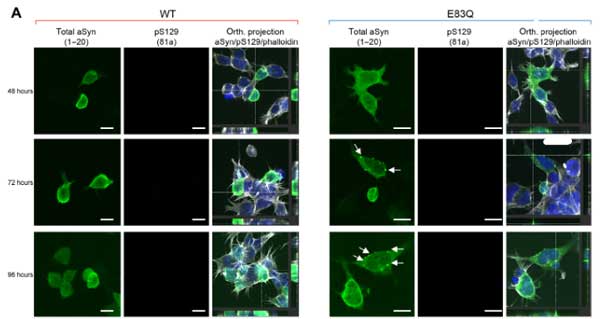
WBでもRIPA不溶画分のα-SynはE83Qで増えていませんでしたが、RIPA可溶画分では全体のα-Syn量、リン酸化α-Syn(S129)、puncta のある細胞の割合などが増えており、
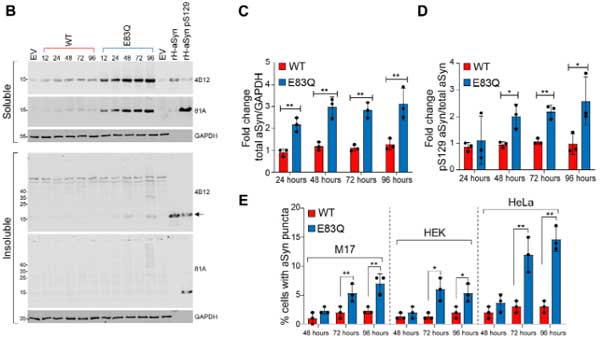
オリゴマーと思われる高分子量(high molecular weight, HMW)のバンドも増えていました。
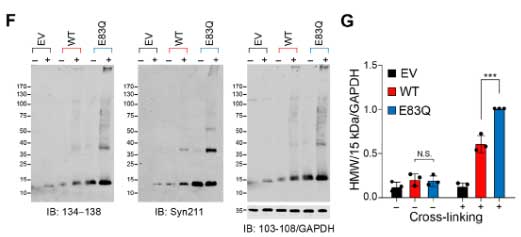
また、E83Q α-Syn では、細胞死も多くなっており、WT α-Syn よりも細胞毒性が強いと考えられました。
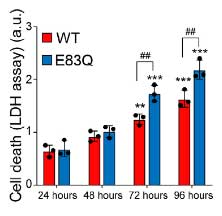
E83QフィブリルはWTのα-Synを凝集させる
報告されていたα-Syn(E83Q)の家系は heterogygous だったので、著者らは、E83QがWTのα-Synも凝集化させる機能があるかどうか調べました。
- E83Q 100%
- WT 100%
- E83Q:WT = 1:4
- E83Q:WT = 4:1
- E83Q:WT = 1:1
の5種類のα-Synの凝集化の速度をチオフラビンアッセイで測定したところ、E83QとWTが混在しているとWTだけのときよりも凝集化が速く、
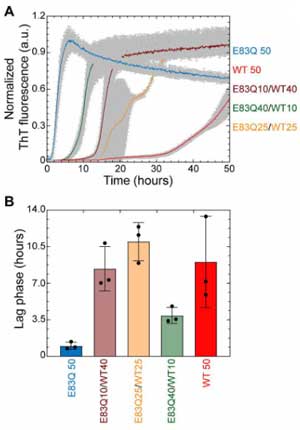
そのフィブリルは、E83QとWTが混在した形になっていました。

WTのフィブリルシードはWTモノマーを、E83QのフィブリルシードはE83Qモノマーを、より効率的に凝集化させましたが、
E83QシードはWTモノマーも凝集化することができ、またE83Qのα-Synが存在していると、フィブリルの形が短くなりました。
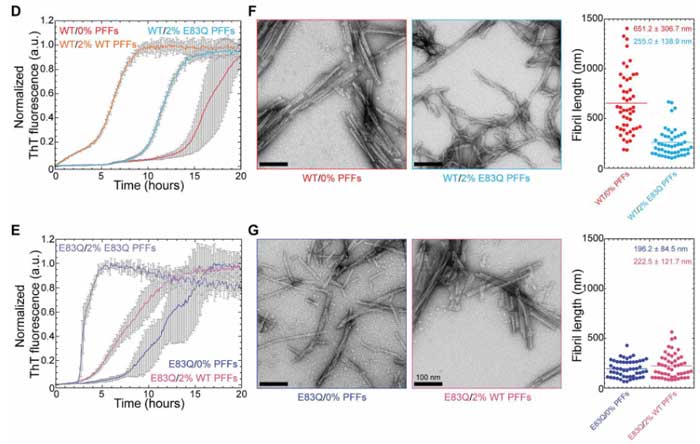
以上の結果から、E83QはWTのα-Synをリクルートして、"E83Qフィブリル" の形に変えていく可能性が示唆されました。
E83Q α-Synフィブリルは、海馬・皮質ニューロンへの凝集体形成能が高く、神経毒性が強い
E83QフィブリルはWTのα-SynをE83Qフィブリル様に凝集化させることがわかったので、彼らは各フィブリルの細胞内での動きを調べることにしました。
α-Synノックアウトニューロンでフィブリルの取り込みを検証
まずはα-Synノックアウト(KO)ニューロンにWT/E83Qα-Synフィブリルを処置し、細胞内への取り込みに違いがあるかどうか調べました。
結果、E83Qフィブリルの方が細胞内に多く取り込まれておりましたが、C末断端などの割合は変わっておらず、プロセッシングなどには影響しない事がわかりました。
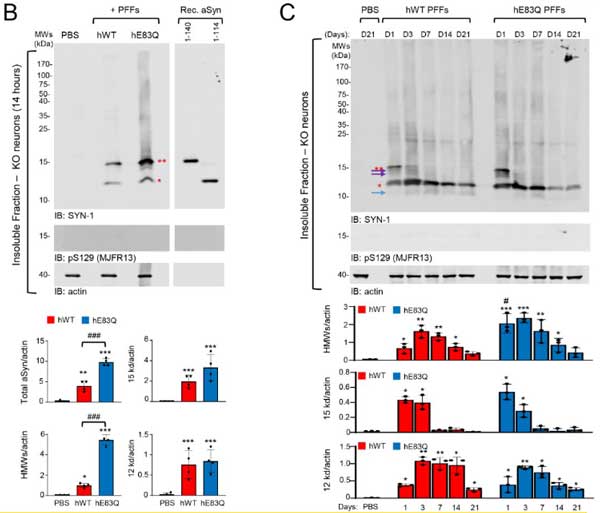
WTマウスニューロンで内因性α-Syn凝集化能を検証
次に彼らは、WTマウスの海馬/皮質のプライマリーニューロンにWTとE83Qのα-Synフィブリルを処置して、内因性α-Synの凝集形成能を調べました。
E83Qフィブリルは、WTフィブリルよりもリン酸化α-Syn(S129)、RIPA不溶性の凝集体を多く作り、とくに皮質由来のプライマリーニューロンでその差が顕著でした。
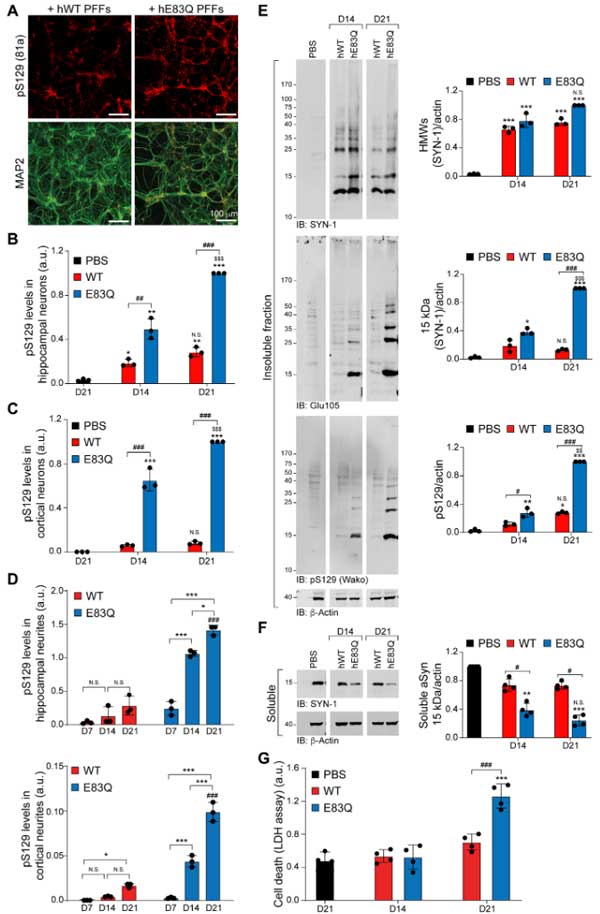
凝集体の形を
- Granular-like
- Granular + filamentous
- Filamentous
- Ribbon-like
- Dense-like LB
- Ring-like LB
の6種類に分けて、WTとE83Qを比較すると、WTフィブリルで誘発された凝集体はGranular-likeタイプが多いのに対し、E83Qフィブリルで誘発された凝集体はよりFilmentousのものが多く、凝集体の形に違いを生じる事もわかりました。
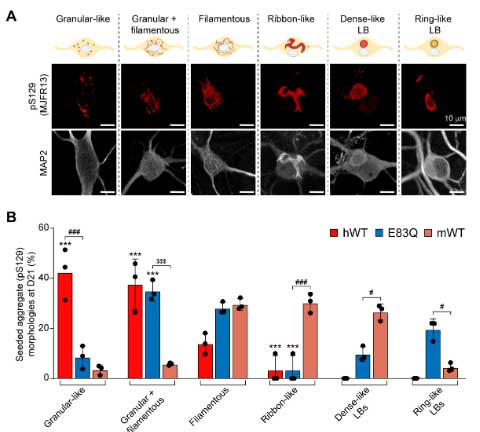
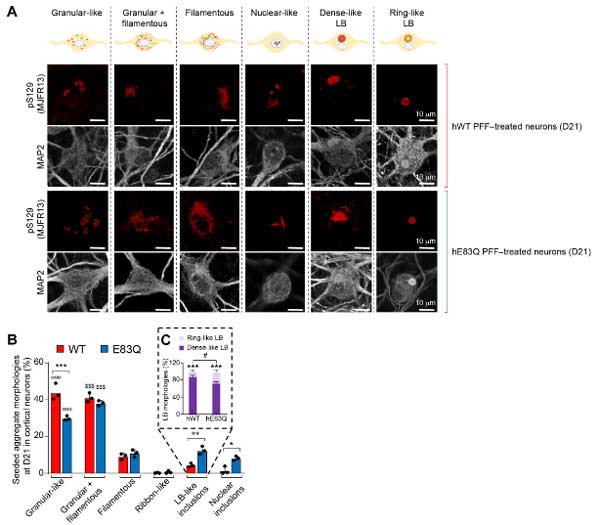
また、皮質ニューロンでも同様に検証したところ、E83Qでは上記形態に加えて核内封入体を形成するものもあり、
- WTはGranular-likeが多いが、E83QはよりFilamentousな形態の混在が多い
- WTよりもE83Qの方が、脳幹LBのようなリング状のLB凝集体の割合が多い
- WTよりもE83QQの方が、核内封入体の割合が多い
という結果になりました。
・
・
・
以上の結果から、α-SynのE83Q変異は、
- 凝集体を形成しやすい
- フィブリルは通常よりも短い
- フィブリルは細胞内に取り込まれやすい
- WT α-Synを自身の形にフィブリル化する
- フィブリルは細胞内での凝集体形成能が高い
- フィブリルは細胞毒性が強い
- 海馬ニューロンよりも皮質ニューロンで凝集化しやすい
- 細胞内凝集体の形がWT α-Synフィブリルと異なる
などの違いが示唆されました。
Kumar ST, Mahul-Mellier AL, Hegde RN, Rivière G, Moons R, Ibáñez de Opakua A, Magalhães P, Rostami I, Donzelli S, Sobott F, Zweckstetter M, Lashuel HA. A NAC domain mutation (E83Q) unlocks the pathogenicity of human alpha-synuclein and recapitulates its pathological diversity. Sci Adv. 2022 Apr 29;8(17):eabn0044. doi: 10.1126/sciadv.abn0044. Epub 2022 Apr 29. PMID: 35486726; PMCID: PMC9054026.
My View
NAC領域の変異というのは今まで聞いたことがなかったので、大変興味深く読ませてもらいましたが、
読み終えての最初の感想は
「なんとまあ、よくここまで細かく調べたな。」
とゆー感じでした。
様々な技術を用いて様々な角度から検証しており、データ量も膨大でした。
動物実験などは行っていませんが、ちょっとお腹いっぱいになりました。
あまりにも vitro のデータが多いので、動物実験は別論文で報告するのかもしれません。
症例報告によると、E83Qの家系ではα-Syn病理をきたしますが、孤発性PDと違って黒質の病理は少なく、海馬や皮質に強いレヴィ病理と萎縮をきたし、臨床的にはFTDの症状を呈するそうです。
細胞実験で、普通(WTのα-Syn PFF)は海馬ニューロンの方が凝集体を形成しやすいのですが、
E83Qは逆に皮質ニューロンに凝集体を形成しやすかったようで、このような特徴的なレヴィ病理と対応しているようで面白いと思いました。
今後FTDの家系を見たら、タウやTDP-43だけじゃなくてE83Q α-Syn 病理、というオプションも追加しておこうと思います。
Glossary
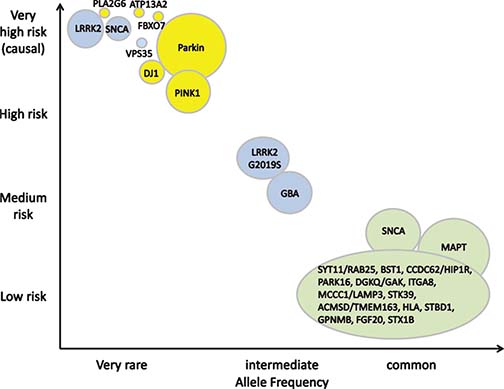
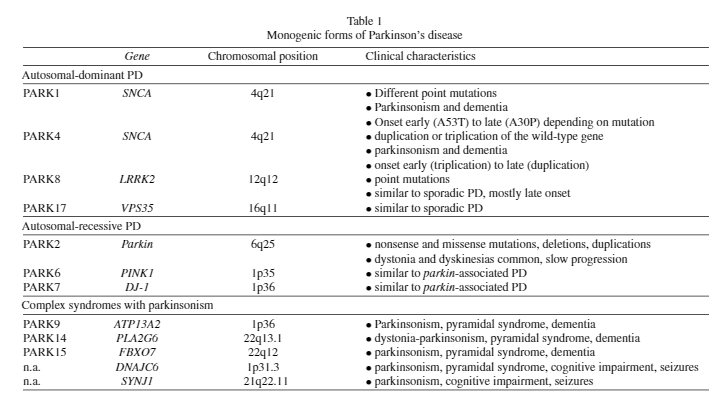
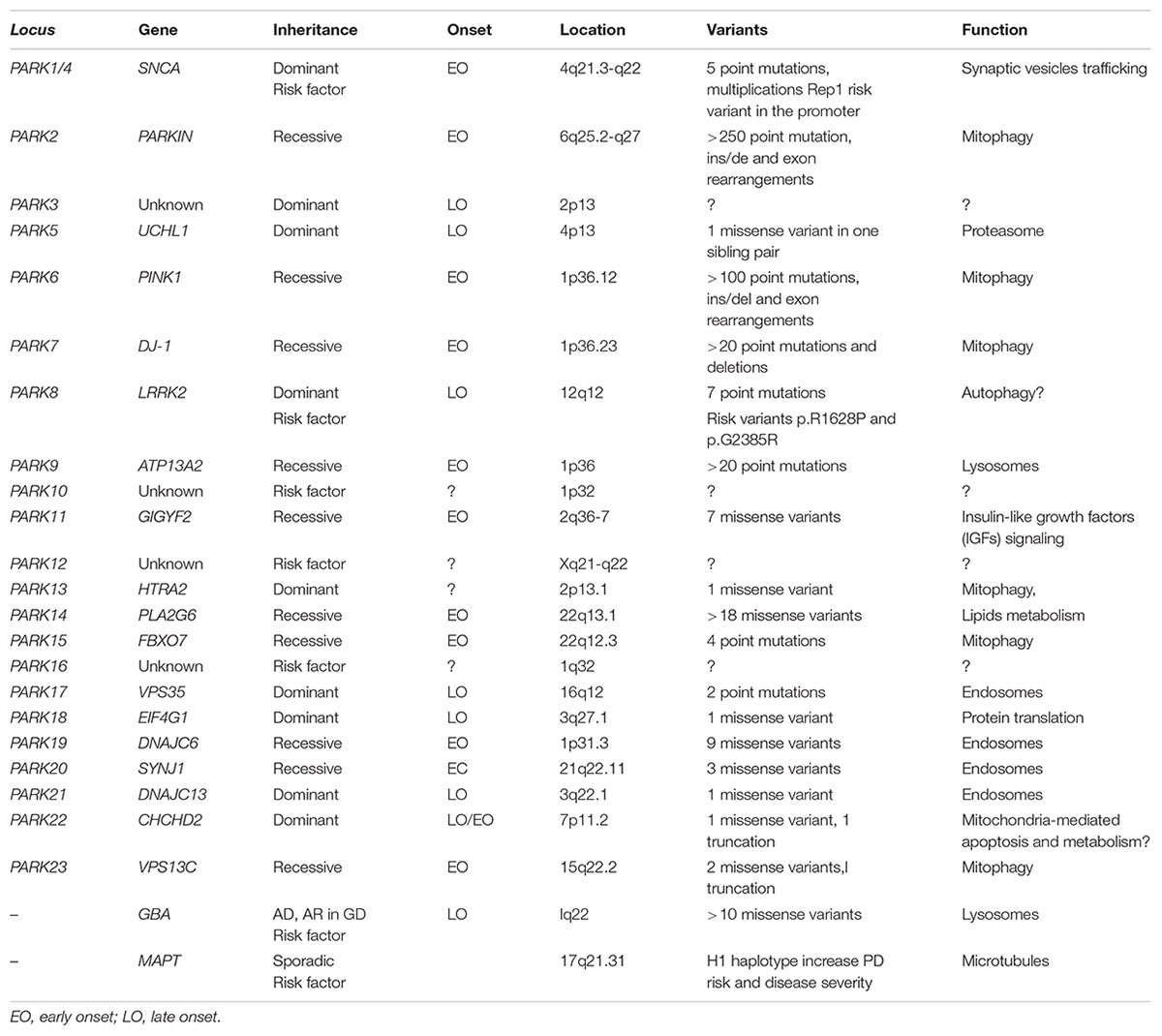
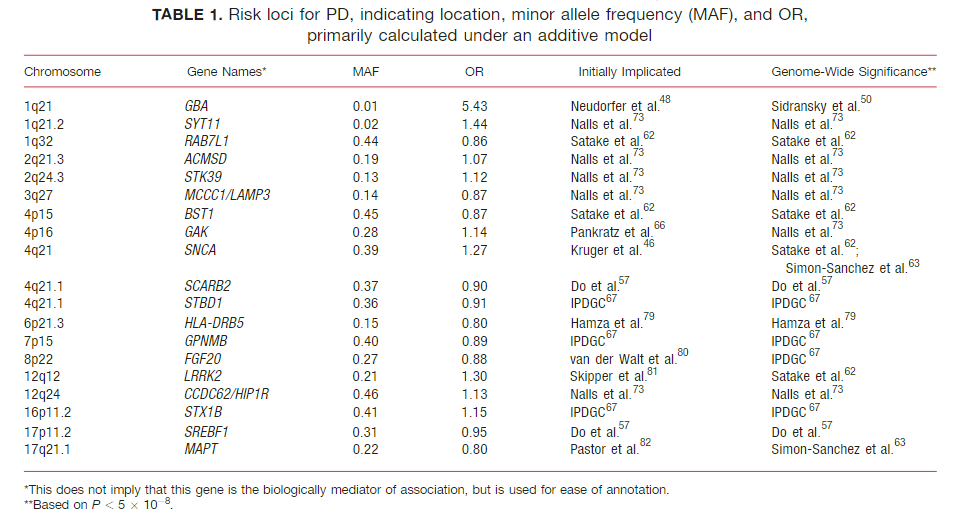
PDの遺伝子変異や遺伝子多型色々
円偏光二色性(circular dichroism, CD)
試料(光学活性物質)に右回りおよび左回りの円偏光を照射し、その吸収の差を測定して立体構造を解析する手法。
タンパク質やDNAなどの生体高分子は、高次構造に由来する特徴的なスペクトルを与えるため、スペクトルの形状から溶液中の構造を簡便に解析できる。
さらに、2個の発色団をもつねじれた構造の未知サンプルは、励起子理論に基づいて絶対配置を決定することもでき、
シグナル強度を利用して光学純度を測定することも可能。
測定できるもの
- 立体構造
- 立体配置
- 立体配座
- 高次構造
- αヘリックス
- βシート
- ランダムコイル
- らせん構造
- ねじれ
- 光学純度
原理 etc.
高分子学会のHP を参照。
サイトの名称 円二色性(Circular Dichroism: CD)
References
- Polymeropoulos MH, Lavedan C, Leroy E, Ide SE, Dehejia A, Dutra A, Pike B, Root H, Rubenstein J, Boyer R, Stenroos ES, Chandrasekharappa S, Athanassiadou A, Papapetropoulos T, Johnson WG, Lazzarini AM, Duvoisin RC, Di Iorio G, Golbe LI, Nussbaum RL. Mutation in the alpha-synuclein gene identified in families with Parkinson's disease. Science. 1997 Jun 27;276(5321):2045-7. doi: 10.1126/science.276.5321.2045. PMID: 9197268.
- Krüger R, Kuhn W, Müller T, Woitalla D, Graeber M, Kösel S, Przuntek H, Epplen JT, Schöls L, Riess O. Ala30Pro mutation in the gene encoding alpha-synuclein in Parkinson's disease. Nat Genet. 1998 Feb;18(2):106-8. doi: 10.1038/ng0298-106. PMID: 9462735.
- Zarranz JJ, Alegre J, Gómez-Esteban JC, Lezcano E, Ros R, Ampuero I, Vidal L, Hoenicka J, Rodriguez O, Atarés B, Llorens V, Gomez Tortosa E, del Ser T, Muñoz DG, de Yebenes JG. The new mutation, E46K, of alpha-synuclein causes Parkinson and Lewy body dementia. Ann Neurol. 2004 Feb;55(2):164-73. doi: 10.1002/ana.10795. PMID: 14755719.
- Appel-Cresswell S, Vilarino-Guell C, Encarnacion M, Sherman H, Yu I, Shah B, Weir D, Thompson C, Szu-Tu C, Trinh J, Aasly JO, Rajput A, Rajput AH, Jon Stoessl A, Farrer MJ. Alpha-synuclein p.H50Q, a novel pathogenic mutation for Parkinson's disease. Mov Disord. 2013 Jun;28(6):811-3. doi: 10.1002/mds.25421. Epub 2013 Mar 1. PMID: 23457019.
- Pasanen P, Myllykangas L, Siitonen M, Raunio A, Kaakkola S, Lyytinen J, Tienari PJ, Pöyhönen M, Paetau A. Novel α-synuclein mutation A53E associated with atypical multiple system atrophy and Parkinson's disease-type pathology. Neurobiol Aging. 2014 Sep;35(9):2180.e1-5. doi: 10.1016/j.neurobiolaging.2014.03.024. Epub 2014 Mar 26. PMID: 24746362.
- Yoshino H, Hirano M, Stoessl AJ, Imamichi Y, Ikeda A, Li Y, Funayama M, Yamada I, Nakamura Y, Sossi V, Farrer MJ, Nishioka K, Hattori N. Homozygous alpha-synuclein p.A53V in familial Parkinson's disease. Neurobiol Aging. 2017 Sep;57:248.e7-248.e12. doi: 10.1016/j.neurobiolaging.2017.05.022. Epub 2017 Jun 27. PMID: 28666710.
- Liu H, Koros C, Strohäker T, Schulte C, Bozi M, Varvaresos S, Ibáñez de Opakua A, Simitsi AM, Bougea A, Voumvourakis K, Maniati M, Papageorgiou SG, Hauser AK, Becker S, Zweckstetter M, Stefanis L, Gasser T. A Novel SNCA A30G Mutation Causes Familial Parkinson's Disease. Mov Disord. 2021 Jul;36(7):1624-1633. doi: 10.1002/mds.28534. Epub 2021 Feb 22. PMID: 33617693.
- Kiely AP, Asi YT, Kara E, Limousin P, Ling H, Lewis P, Proukakis C, Quinn N, Lees AJ, Hardy J, Revesz T, Houlden H, Holton JL. α-Synucleinopathy associated with G51D SNCA mutation: a link between Parkinson's disease and multiple system atrophy? Acta Neuropathol. 2013 May;125(5):753-69. doi: 10.1007/s00401-013-1096-7. Epub 2013 Feb 12. PMID: 23404372; PMCID: PMC3681325.
- Konno T, Ross OA, Puschmann A, Dickson DW, Wszolek ZK. Autosomal dominant Parkinson's disease caused by SNCA duplications. Parkinsonism Relat Disord. 2016 Jan;22 Suppl 1(Suppl 1):S1-6. doi: 10.1016/j.parkreldis.2015.09.007. Epub 2015 Sep 3. PMID: 26350119; PMCID: PMC4820832.
- Singleton AB, Farrer M, Johnson J, Singleton A, Hague S, Kachergus J, Hulihan M, Peuralinna T, Dutra A, Nussbaum R, Lincoln S, Crawley A, Hanson M, Maraganore D, Adler C, Cookson MR, Muenter M, Baptista M, Miller D, Blancato J, Hardy J, Gwinn-Hardy K. alpha-Synuclein locus triplication causes Parkinson's disease. Science. 2003 Oct 31;302(5646):841. doi: 10.1126/science.1090278. PMID: 14593171.
- Fan TS, Liu SC, Wu RM. Alpha-Synuclein and Cognitive Decline in Parkinson Disease. Life (Basel). 2021 Nov 16;11(11):1239. doi: 10.3390/life11111239. PMID: 34833115; PMCID: PMC8625417.
- Ando T, Riku Y, Akagi A, Miyahara H, Hirano M, Ikeda T, Yabata H, Koizumi R, Oba C, Morozumi S, Yasui K, Goto A, Katayama T, Sakakibara S, Aiba I, Sakai M, Konagaya M, Mori K, Ito Y, Yuasa H, Nomura M, Porto KJL, Mitsui J, Tsuji S, Mimuro M, Hashizume Y, Katsuno M, Iwasaki Y, Yoshida M. Multiple system atrophy variant with severe hippocampal pathology. Brain Pathol. 2022 Jan;32(1):e13002. doi: 10.1111/bpa.13002. Epub 2021 Jul 13. PMID: 34255887; PMCID: PMC8713529.
- Kapasi A, Brosch JR, Nudelman KN, Agrawal S, Foroud TM, Schneider JA. A novel SNCA E83Q mutation in a case of dementia with Lewy bodies and atypical frontotemporal lobar degeneration. Neuropathology. 2020 Dec;40(6):620-626. doi: 10.1111/neup.12687. Epub 2020 Aug 12. PMID: 32786148; PMCID: PMC7787029.
- Uversky VN, Li J, Souillac P, Millett IS, Doniach S, Jakes R, Goedert M, Fink AL. Biophysical properties of the synucleins and their propensities to fibrillate: inhibition of alpha-synuclein assembly by beta- and gamma-synucleins. J Biol Chem. 2002 Apr 5;277(14):11970-8. doi: 10.1074/jbc.M109541200. Epub 2002 Jan 25. PMID: 11812782.
- Kumar ST, Mahul-Mellier AL, Hegde RN, Rivière G, Moons R, Ibáñez de Opakua A, Magalhães P, Rostami I, Donzelli S, Sobott F, Zweckstetter M, Lashuel HA. A NAC domain mutation (E83Q) unlocks the pathogenicity of human alpha-synuclein and recapitulates its pathological diversity. Sci Adv. 2022 Apr 29;8(17):eabn0044. doi: 10.1126/sciadv.abn0044. Epub 2022 Apr 29. PMID: 35486726; PMCID: PMC9054026.
- Gasser T. Usefulness of Genetic Testing in PD and PD Trials: A Balanced Review. J Parkinsons Dis. 2015;5(2):209-15. doi: 10.3233/JPD-140507. PMID:25624421; PMCID: PMC4923738.
- Del Rey NL, Quiroga-Varela A, Garbayo E, Carballo-Carbajal I, Fernández-Santiago R, Monje MHG, Trigo-Damas I, Blanco-Prieto MJ, Blesa J. Advances in Parkinson's Disease: 200 Years Later. Front Neuroanat. 2018 Dec 14;12:113. doi: 10.3389/fnana.2018.00113. PMID:30618654; PMCID: PMC6306622.
- Singleton AB, Farrer MJ, Bonifati V. The genetics of Parkinson's disease: progress and therapeutic implications. Mov Disord. 2013 Jan;28(1):14-23. doi: 10.1002/mds.25249. PMID:23389780; PMCID: PMC3578399.