私達は、普段何気なく生活しているこの瞬間にも、どこかの体細胞の遺伝子が傷つき、損傷と自己修復を繰り返しています。
増殖抑止機能の部分の遺伝子修復が追いつかなかったりして、自己増殖能がイカれた細胞の一部はがん細胞として独り歩きしだしたりするわけですが、がん細胞にまではならなくても、損傷・自己修復の過程で生じた遺伝子変異は蓄積するそうです。
脳内の神経細胞では、その遺伝子変異の数が正常加齢と共に増えていくこと、また変性疾患の脳内ではその数が多かったりパターンが異なったりすることが報告されていました [1] 。
今回、アメリカ・ボストンこども病院の Dr. Frosch, Dr. Walsh らの研究グループは、
「アルツハイマー病(Alzheimer's disease, AD)の脳内では、特徴的な遺伝子変異が蓄積している」
という事を明らかにしました [2] 。

アルツハイマー病では、神経細胞の遺伝子がより多く変異している
脳内の神経細胞では、年齢とともに体細胞遺伝子変異が増加
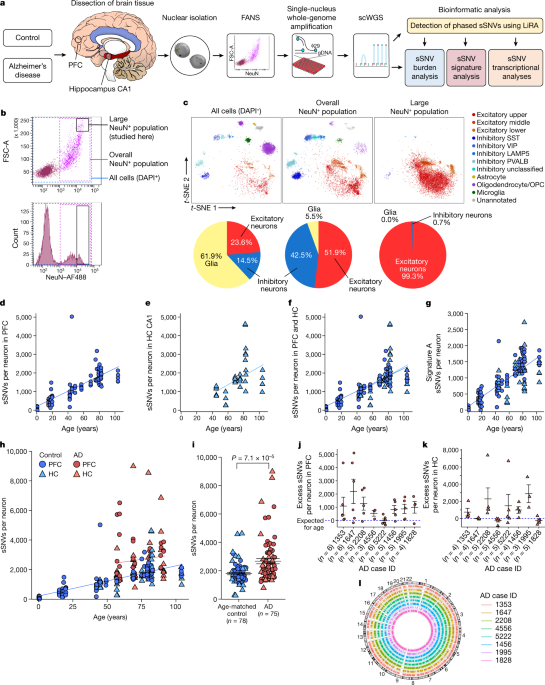
彼らは、
- 若年コントロール: n=9, age 0.4-49.2 yo
- 加齢コントロール: n=11, age 57-104 yo
- AD: n=9, age 57-91 yo
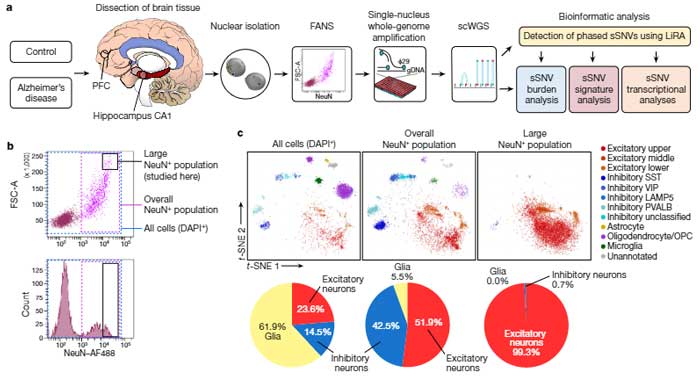
の剖検脳の2箇所
- 前頭前皮質(prefrontal cortex, PFC):
- 海馬CA1
から、ADで特に傷害される、興奮性ニューロンの核を取り出し、single-cell whole-genome sequencing (scWGS) を行いました。
(AD: 91ニューロン、コントロール: 159ニューロン)

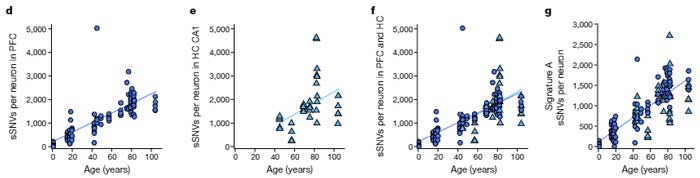
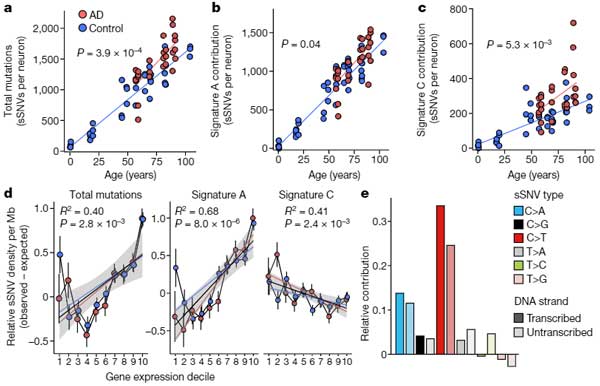
これらのニューロンの体細胞一塩基変異(somatic single-nucleotide variants, sSNVs)を調べ、sSNVは健常人でも加齢と共に増えている事を確認しました。
これらの変異の多くは、特定のCがTに、もしくはTがCに変異するパターン(Pattern A)で、以前彼らが名付けた "clock-like" なパターン [1] でした。
神経細胞って分化しないのに、なんでこんな変異が起こるのかはよくわかりませんが、
SBS5のデータベース(こちら)で照合すると、これらの変異はRNA転写に関係しているようでした。
転写の際、二重らせんはほどけ、一本鎖のDNAはシトシンやチミンの脱アミノ化にさらされ、転写共役ヌクレオチド除去修復機構 (transcription-coupled nucleotide excision repair, TC-NER) の対象となります [3] 。
この一連の転写機構で、転写に伴う損傷や修復がうまくいかないことによって、体細胞変異が誘発されているのかもしれません。
AD脳では体細胞変異が増えている
次に彼らはAD脳の神経細胞の遺伝子変異率を調べました。
PFCでも海馬でも、sSNV は、同年齢のコントロール脳よりもAD脳で増えていました。
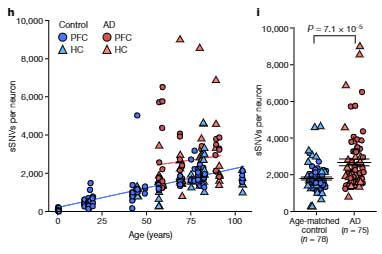
特定の遺伝子というよりは、全体的に色々な遺伝子で変異が生じており、primary というよりは、AD病理等に伴った二次的な変化と考えられました。
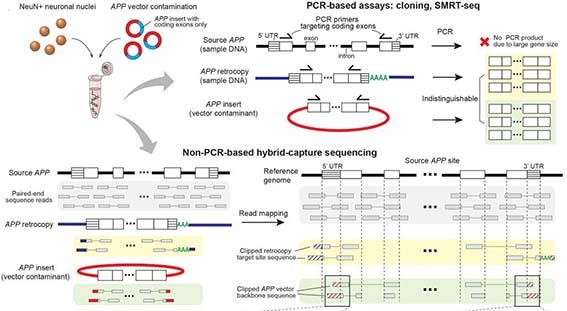
また、以前このブログで、孤発性ADでAPPの変異が増えているか否かの議論についてとりあげましたが [4, 5, 6] 、
ヒトの脳内の多様性や複雑性は、普遍的なゲノムによってエンコードされていると考えられている。 脳内におけるゲノムのモザイク現象は、神経前駆細胞や神経細胞で同定され、コピー数の多様性(copy number variatio …
以前、孤発性アルツハイマー病(Alzheimer's disease, AD)で、 アミロイド前駆体蛋白質(Amyloid precursor protein, APP)が、転写後にゲノム遺伝子に挿入されるという現象が多 …
今回の研究結果では、体細胞変異は APP, PSEN1, PSEN2, APOE いずれの遺伝子でも関係しておらず、最新の報告 [7] を支持し、以前物議を醸した APP の体細胞変異 [4] は否定する形となりました。
ADでは体細胞変異のパターンが加齢性変化と異なる
彼らは以前、神経細胞の de novo にはA, B, C の3種類のパターンがあると報告していて [1]、そのうちパターンBは胎児脳の変化だったので、パターンAとパターンCについて調べました。
すると、AD脳の神経細胞では、正常加齢脳と同じくパターンAの変化もありましたが、それよりもパターンCの変化(C>A)が顕著でした。
このパターンCは、Aよりもより多くのバリエーションがあり、イレギュラーで "calamitous" なイベントが起こった事を示していました。
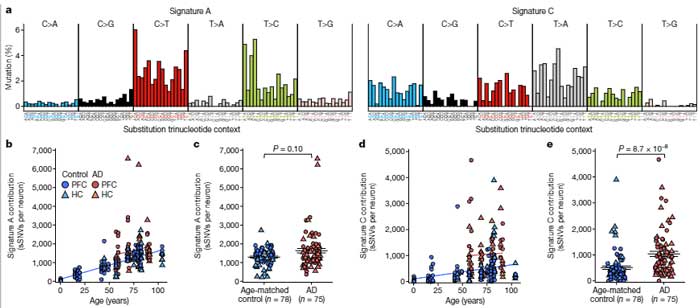
Cの変化からAの変化を差し引くと、グアニン・ヌクレオチド (G) の酸化ストレス障害との関連が示されました [8] 。
また、がん関連シグネチャー SBS8 にも関与しており、TC-NER の機能障害を着たした幹細胞でも認められるパターン [9, 10] でした。
AD脳で活性酸素種(reactive oxygen species, ROS)が上がっている報告も多数あることから [11, 12, 13, 14] 、これらのパターンCの特徴は、AD病理に伴う酸化ストレスが関与している可能性が考えられました。
また、がん関連シグネチャー SBS6 にも関係しており、これは DNA ミスマッチ修復に関与している事から、これらの機能も関与しているかもしれません。
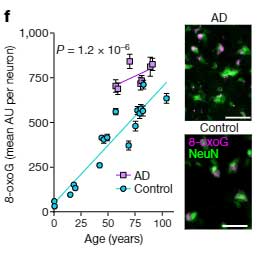
実際に酸化ストレスがこのパターンCシグネチャーに関係しているか調べる為、彼らはヌクレオチドの酸化障害マーカーである 8-oxouanine (8-oxoG) を調べました。
すると、ADの脳の神経細胞では、8-oxoG 量が上がっており、C>A のシグネチャーは酸化ストレスが関与しているものと考えられました。
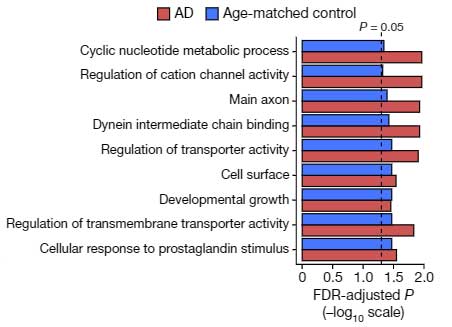
AD神経に起こっている変異はどんな影響をもたらすか
Gene Ontology (GO) 解析を行うと、ADではコントロールとくらべて、神経機能に色々と影響を与えていそうだとわかりました。
ADでの遺伝子変異シグネチャーをコントロール脳と比較すると、蛋白コーディング領域では、非同義変異(non-synonymous mutation)がADでより多く起こっていました。
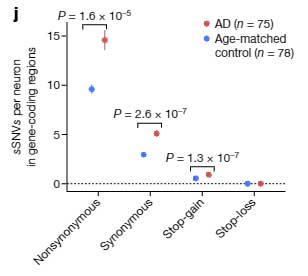
これは、dosage-sensitive 遺伝子を障害する可能性や、Tリンパ球活性UPなどの免疫反応に関与する可能性があり、結果的に細胞障害につながる事が予測されました。
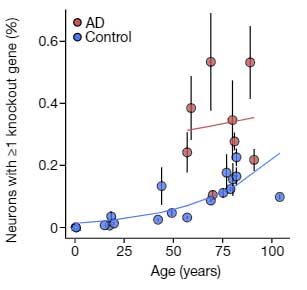
さらに、ゲノム上で変異が蓄積するということは、同じ遺伝子座で2つの有害なエクソン変化が起こって、ノックアウト細胞が作られる可能性が高まる事を意味します。
彼らはsSNVによってノックアウトされた神経細胞の割合をモデル化し、ADニューロンでより多くの細胞の遺伝子がノックアウトされている可能性を示しました。
他の系でも検証
彼らは慎重に慎重を重ねて、よりアーチファクトの少ない遺伝子増幅法でも同様に検証しました。
結果、先の方法と同じように、正常加齢でパターンA(C>T)の変異が増え、ADではパターンCの変異が多くなっていました。
以上の結果から、
AβやタウなどのAD病理
↓
ROS↑
↓
DNA損傷↑
↓
DNA修復過程で変異↑
↓
神経障害
というメカニズムが考えられました。
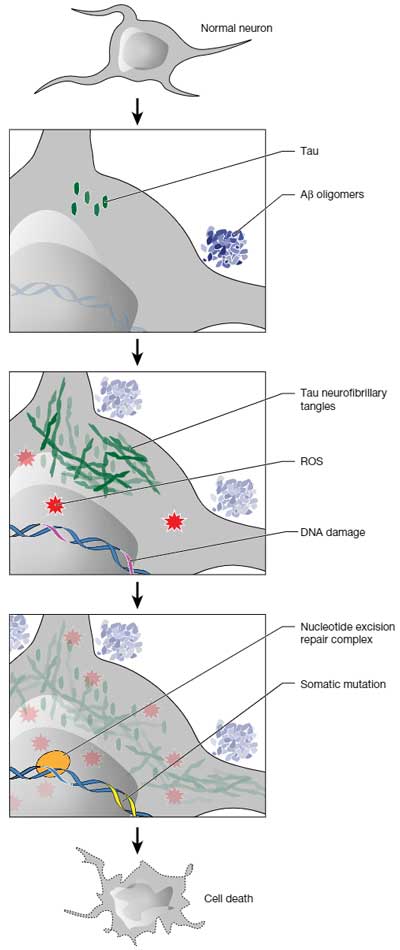
Analyses of single-cell whole-genome sequencing data show that somatic mutations are increased in the brain of individuals with Alzheimer’s disease compared to neurotypical individuals, with a pattern of genomic damage distinct from that of normal ageing.
References
- Lodato MA, Rodin RE, Bohrson CL, Coulter ME, Barton AR, Kwon M, Sherman MA, Vitzthum CM, Luquette LJ, Yandava CN, Yang P, Chittenden TW, Hatem NE, Ryu SC, Woodworth MB, Park PJ, Walsh CA. Aging and neurodegeneration are associated with increased mutations in single human neurons. Science. 2018 Feb 2;359(6375):555-559. doi: 10.1126/science.aao4426. Epub 2017 Dec 7. Erratum in: Science. 2018 Jul 6;361(6397): PMID: 29217584; PMCID: PMC5831169.
- Miller MB, Huang AY, Kim J, Zhou Z, Kirkham SL, Maury EA, Ziegenfuss JS, Reed HC, Neil JE, Rento L, Ryu SC, Ma CC, Luquette LJ, Ames HM, Oakley DH, Frosch MP, Hyman BT, Lodato MA, Lee EA, Walsh CA. Somatic genomic changes in single Alzheimer's disease neurons. Nature. 2022 Apr;604(7907):714-722. doi: 10.1038/s41586-022-04640-1. Epub 2022 Apr 20. PMID: 35444284.
- Bhagwat AS, Hao W, Townes JP, Lee H, Tang H, Foster PL. Strand-biased cytosine deamination at the replication fork causes cytosine to thymine mutations in Escherichia coli. Proc Natl Acad Sci U S A. 2016 Feb 23;113(8):2176-81. doi: 10.1073/pnas.1522325113. Epub 2016 Feb 2. PMID: 26839411; PMCID: PMC4776466.
- Lee MH, Siddoway B, Kaeser GE, Segota I, Rivera R, Romanow WJ, Liu CS, Park C, Kennedy G, Long T, Chun J. Somatic APP gene recombination in Alzheimer's disease and normal neurons. Nature. 2018 Nov;563(7733):639-645. doi: 10.1038/s41586-018-0718-6. Epub 2018 Nov 21. Erratum in: Nature. 2019 Feb;566(7743):E6. PMID: 30464338; PMCID: PMC6391999.
- Kim J, Zhao B, Huang AY, Miller MB, Lodato MA, Walsh CA, Lee EA. APP gene copy number changes reflect exogenous contamination. Nature. 2020 Aug;584(7821):E20-E28. doi: 10.1038/s41586-020-2522-3. Epub 2020 Aug 19. PMID: 32814883; PMCID: PMC7704338.
- Lee MH, Liu CS, Zhu Y, Kaeser GE, Rivera R, Romanow WJ, Kihara Y, Chun J. Reply to: APP gene copy number changes reflect exogenous contamination. Nature. 2020 Aug;584(7821):E29-E33. doi: 10.1038/s41586-020-2523-2. Epub 2020 Aug 19. PMID: 32814882; PMCID: PMC8522531.
- Min S, Li Z, Shieh A, Giase G, Bao R, Zhang C, Kuney L, Kopp R, Asif H, Alliey-Rodriguez N, Qin L, Craig DW, Faulkner GJ, Gershon ES, Tang B, Chen C, Liu C. Absence of coding somatic single nucleotide variants within well-known candidate genes in late-onset sporadic Alzheimer's Disease based on the analysis of multi-omics data. Neurobiol Aging. 2021 Dec;108:207-209. doi: 10.1016/j.neurobiolaging.2021.07.010. Epub 2021 Jul 21. PMID: 34392980.
- Kucab JE, Zou X, Morganella S, Joel M, Nanda AS, Nagy E, Gomez C, Degasperi A, Harris R, Jackson SP, Arlt VM, Phillips DH, Nik-Zainal S. A Compendium of Mutational Signatures of Environmental Agents. Cell. 2019 May 2;177(4):821-836.e16. doi: 10.1016/j.cell.2019.03.001. Epub 2019 Apr 11. PMID: 30982602; PMCID: PMC6506336.
- Alexandrov LB, Kim J, Haradhvala NJ, Huang MN, Tian Ng AW, Wu Y, Boot A, Covington KR, Gordenin DA, Bergstrom EN, Islam SMA, Lopez-Bigas N, Klimczak LJ, McPherson JR, Morganella S, Sabarinathan R, Wheeler DA, Mustonen V; PCAWG Mutational Signatures Working Group, Getz G, Rozen SG, Stratton MR; PCAWG Consortium. The repertoire of mutational signatures in human cancer. Nature. 2020 Feb;578(7793):94-101. doi: 10.1038/s41586-020-1943-3. Epub 2020 Feb 5. PMID: 32025018; PMCID: PMC7054213.
- Jager M, Blokzijl F, Kuijk E, Bertl J, Vougioukalaki M, Janssen R, Besselink N, Boymans S, de Ligt J, Pedersen JS, Hoeijmakers J, Pothof J, van Boxtel R, Cuppen E. Deficiency of nucleotide excision repair is associated with mutational signature observed in cancer. Genome Res. 2019 Jul;29(7):1067-1077. doi: 10.1101/gr.246223.118. Epub 2019 Jun 20. PMID: 31221724; PMCID: PMC6633256.
- Mecocci P, MacGarvey U, Beal MF. Oxidative damage to mitochondrial DNA is increased in Alzheimer's disease. Ann Neurol. 1994 Nov;36(5):747-51. doi: 10.1002/ana.410360510. PMID: 7979220.
- Chun H, Im H, Kang YJ, Kim Y, Shin JH, Won W, Lim J, Ju Y, Park YM, Kim S, Lee SE, Lee J, Woo J, Hwang Y, Cho H, Jo S, Park JH, Kim D, Kim DY, Seo JS, Gwag BJ, Kim YS, Park KD, Kaang BK, Cho H, Ryu H, Lee CJ. Severe reactive astrocytes precipitate pathological hallmarks of Alzheimer's disease via H2O2- production. Nat Neurosci. 2020 Dec;23(12):1555-1566. doi: 10.1038/s41593-020-00735-y. Epub 2020 Nov 16. PMID: 33199896.
- Pao PC, Patnaik D, Watson LA, Gao F, Pan L, Wang J, Adaikkan C, Penney J, Cam HP, Huang WC, Pantano L, Lee A, Nott A, Phan TX, Gjoneska E, Elmsaouri S, Haggarty SJ, Tsai LH. HDAC1 modulates OGG1-initiated oxidative DNA damage repair in the aging brain and Alzheimer's disease. Nat Commun. 2020 May 18;11(1):2484. doi: 10.1038/s41467-020-16361-y. PMID: 32424276; PMCID: PMC7235043.
- Gabbita SP, Lovell MA, Markesbery WR. Increased nuclear DNA oxidation in the brain in Alzheimer's disease. J Neurochem. 1998 Nov;71(5):2034-40. doi: 10.1046/j.1471-4159.1998.71052034.x. PMID: 9798928.