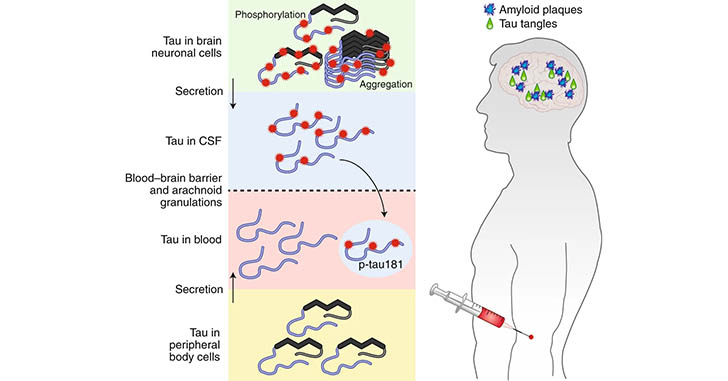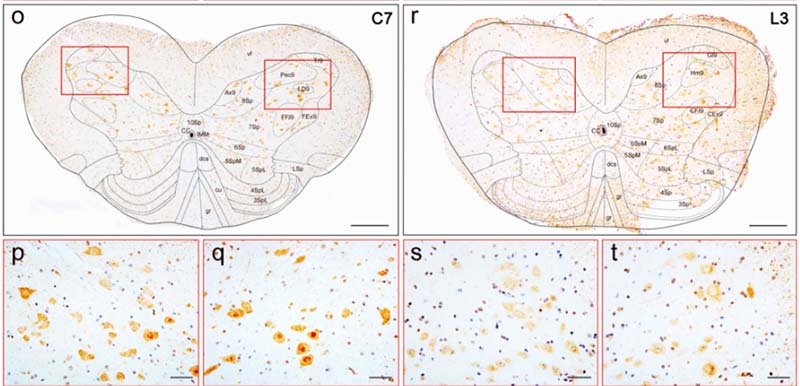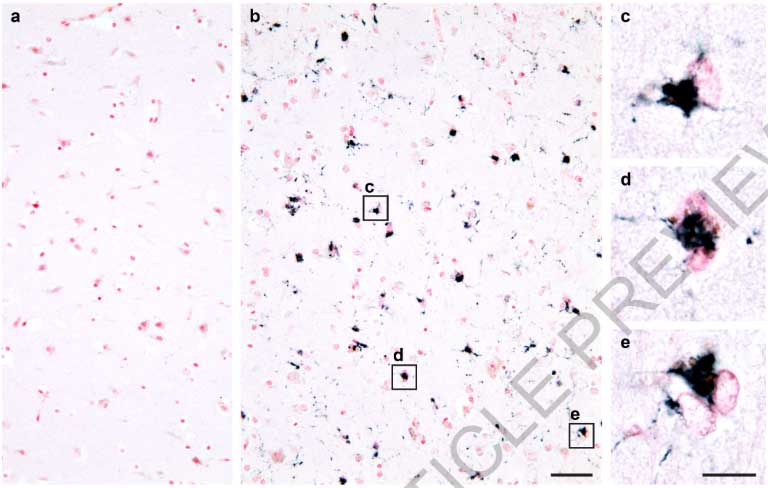
私が研究を始めた頃、アミロイドβ(amyloid beta, Aβ)がアルツハイマー病(Alzheimer's disease, AD)の根本的原因とする「アミロイド仮説」が全て、のような雰囲気がありました。
「Aβが溜まり始め、それがタウのリン酸化を引き起こし、神経原線維変化(neurofibrillary tangles, NFT)となって神経細胞が死んでいき、認知機能が低下していく――だからAβを止めれば AD を止める事ができる」
という考えです。
ただ、認知機能低下と相関があるのは NFT の病理的進展ステージである Braak Stage と強い相関があり、Aβ の進展とは相関がないことから、
「タウ病理の進展を軽視してはいけない」
と考える人達も多くいました。
程なくして、その Braak先生が
「タウ病理は30歳以前から溜まり始める」
という論文を発表し [1]、
Aβ が溜まり始める前にタウ病理が溜まり始める、という事を知って、私は結構な衝撃を受けました。
そしてその後、primary age-related tauopathy (PART) の概念が発表され [2]、私がぼんやりと考えていたことはちょっとした確信に変わりました。
それは、
「タウは青斑核(locus coeruleus, LC)から自然に溜まり始めて、嗅内皮質(entorhinal cortex, EC)、海馬まではじわじわ進展するけど、それだけだと limbic area に留まったままでそこまで悪さをせず(PARTの状態)、
ある時点で新皮質から進展してきたAβと紡錘状回や下側頭回あたりで出会うと、何らかのスイッチが入ってタウが一気に新皮質に広がり、ADとして病態が進行していくんじゃないか。」
という考えです。
この考えがひらめいた時、私はとてもワクワクして、なんとかそれを実験で証明できないかと思いました。
ただ、その時は別のプロジェクトにエフォートを割く必要があり、その後研究室の大ボスからパーキンソン病(Parkinson's disease, PD)のグループで働くよう言われたので、新たにAD研究のプロジェクトを始める事は諦めました。
PDグループで数年働いた後、留学の機会を頂き、私は
「自由に留学先を選べるんだったら、AD、特にタウの研究をしてみたい」
と思い、学振の申請書は思い切ってタウの内容にしました。
大ボスにはズッコケられましたが、苦笑いで見送られ、私自身は気持ちを新たにアメリカの今の研究室にやってきました。
ところが、私が自分で思いついたかのように考えていた上記のアイデアは、ここの研究室の人達の間では当たり前の共通概念でした。
そしてその考えは、私が研究を始めるずっと前、アミロイド仮説が流行りに流行っていた頃から既に議論されており、
テキサス出身のある人は、故郷のシンボルである競馬になぞらえて、
「タウは普段は馬牧場の囲いの中で大人しくしているんだ。
けどそこにAβがやってきて、柵の扉を開けちゃうのさ。
扉が開いたら、馬たち(タウ)は一気に外に飛び出して、方々に走って(広がって)いくんだよ。」
と、面白おかしく話してくれました。
・
・
・
と、前置きが長くなりましたが、この様な
「LC/ECからスタートしたタウ病理が側頭葉付近で上から進展してきたAβと出会うことで、タウの新皮質への伝播が加速される」
という概念は、今では多くの人達が持っており、それを裏付ける結果も次々と報告されています [3]。
今回、韓国・高麗大学校 (Korea University) の Dr. Seong、アメリカ・カリフォルニア大学サンフランシスコ校 (UCSF) の Dr. Seeley、Alzheimer's Disease Neuroimaging Initiative (ADNI) の研究グループたちは、イメージングデータを使って、上記の仮説を視覚的に示しました [4] 。

ジワジワと進展してきたタウが下前頭回でAβと出会った時、新皮質への爆発的広がりの扉が開く
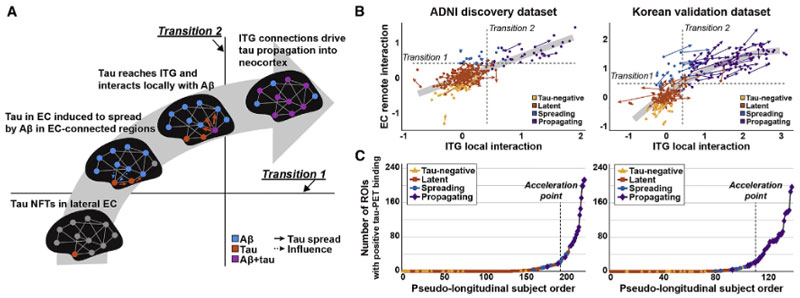
ADNI と 韓国の アミロイドPET/タウPETの縦断的研究
かれらは、The Alzheimer's Disease Neuroimaging Initiative (ADNI) 研究と韓国のデータセットで
- アミロイドPET(18F-florbetapir-PET)
- タウPET(18F-flortaucipir-PET)
のデータを縦断的に検証し、それぞれ pseudo-longitudinal disease severity order を作りました。

これによると、タウ病理は嗅内皮質(entorhinal cortex, EC)から溜まり始め、
- Pre-acceleration phase
- Acceleration phase
- Post-acceleration phase
という3段階のフェーズに分ける事ができました。
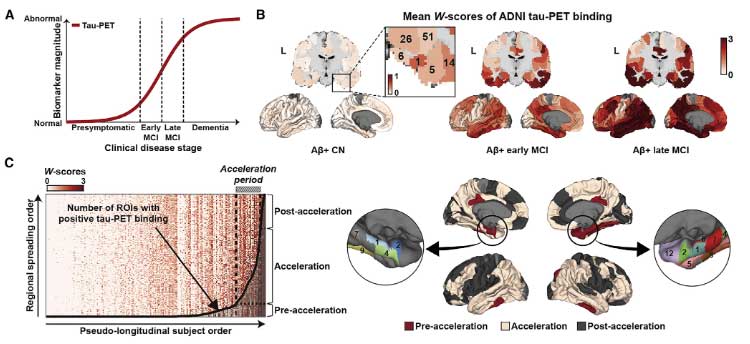
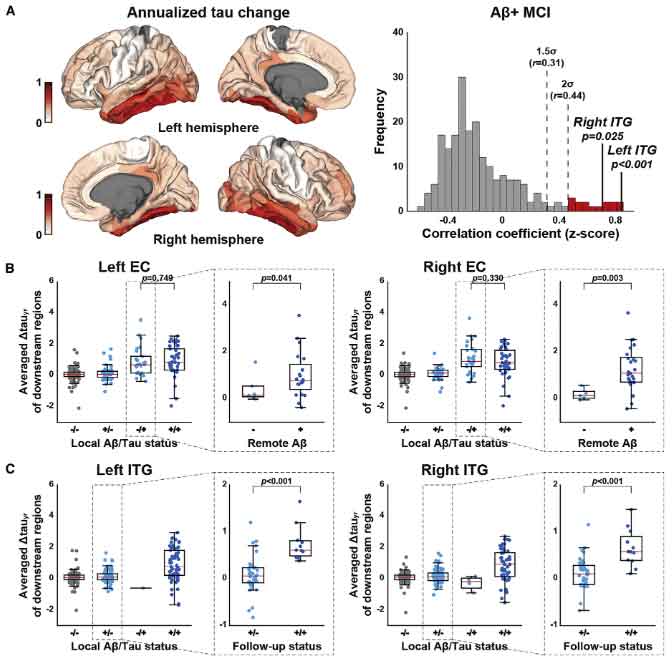
タウ病理が加速する鍵となる場所は下側頭回
タウ病理が一気に加速するフェーズはどこからスタートするのか、彼らは拡散強調画像を使って "コネクトーム" を作り、それぞれの脳部位のコネクティビティとタウ病理の進展の関係を調べました。
結果、タウ病理が一気に加速する部位は「下側頭回(inferior temporal gyrus, ITG)」と判明しました。
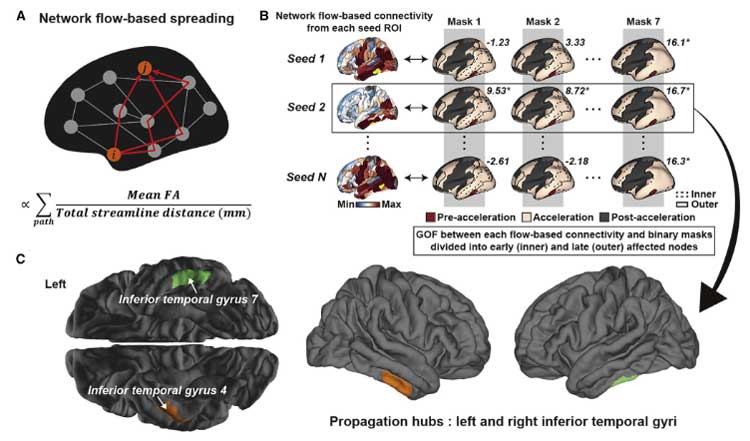
タウ進展の加速に対するAβの関わり
このタウ病理が加速するフェーズに、Aβがどのように関わっているのか調べるため、著者らは
- Aβとタウの遠隔的 (remote) な関わり(タウは細胞体や樹状突起、Aβは軸索を伸ばした先)
- Aβとタウの局所的 (local) な関わり(タウは細胞体や樹状突起、Aβはその周辺)
の2方向から検証しました。
結果、Aβとタウが遠隔的に最初に関係する場所は外側ECで、
局所的に関係する場所は両側ITGと判明しました。
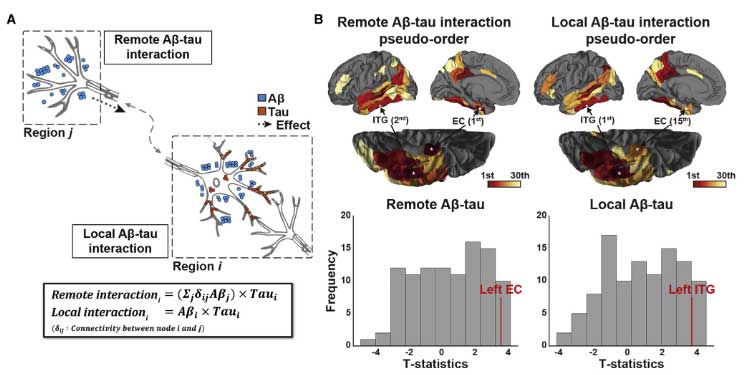
縦断的データでもサポート
以上の結果は、2つのコホートをあわせた縦断的イメージングデータでもサポートされました。
Aβとタウの相互作用モデル
以上のデータセットから、彼らは以下のような仮説を立てました。
- 外側ECにいるタウは、神経の投射先のAβの影響を受けてEC全体に広がる
- そして、ITGに達すると、その局所でのAβとの相互作用により、タウは新皮質に広がっていく
ADNIデータも韓国データも、横断/縦断共に上記の仮説を支持していました。

これらの結果から、著者らはサブジェクトを4つのグループに分けました。
- "tau-negative" in EC:
- タウがECにない状態
- "latent tau":
- ECでの遠隔的なAβ-タウインターラクションが不十分
- "spreading tau":
- ECでの遠隔的なAβ-タウインターラクションは十分だけれども、ITGでの局所的なAβ-タウのインターラクションは不十分
- "propagating tau":
- ITGでの局所的なAβ-タウインターラクションが十分にある
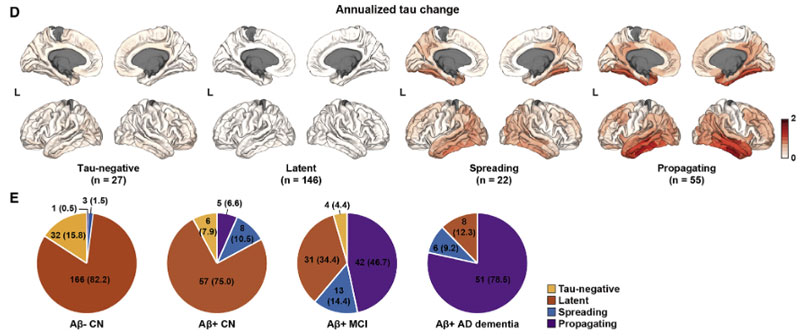
このようなグループ分けはAβとタウの動きをより的確に反映しており、バイオマーカーに基づいたAD治療薬のコホート選出において、より効果的なコホートを選出できる可能性が考えられました。
• Network flow-based model identifies tau propagation hubs in inferior temporal gyri • Remote Aβ-tau interactions in entorhinal cortex may trigger initial tau spreading • Local Aβ-tau interactions in inferior temporal gyrus may promote tau propagation • Connectivity-based model addresses the spatial incongruity between early Aβ and tau
My View
イントロでも書きましたが、私は以前からAβとタウのインターラクションに興味があったのですが、それを研究する機会を逃してきました。
今ではイメージングやマウスモデルを使った研究などで上記仮説を裏付けるデータが報告されており [3] 、
「LC/ECからスタートしたタウ病理が新皮質から進展してきたAβと出会うことで、タウの新皮質への伝播が加速される」
という説はほぼほぼ正しいんじゃないかと思っています。
今回の研究では、タウ病理はECからスタートしていますが、これはイメージングを使った研究だからで、
- 最初にLCにみられるタウ病理はプレタングルの状態だから
- LCがとても小さい領域だから
という2つの理由で、LCのタウ病理はタウPETでは検出できないんじゃないかと思います。
最後に著者らは、Aβ-タウの遠隔的/局所的インターラクションによって、CN-MCI-ADを4つに分類しました。
今まで、多くのAD治療薬の治験が失敗か微妙な結果のままFDA承認されたりしていますが、そのイマイチな結果の原因の1つにADの多様性(heterogeneity)が指摘されています。
今回のような "Aβ-タウインターラクション" という観点からの分類は、バイオマーカーを基にしたAD治療薬のコホート選出において、今後、大いに力を発揮するんじゃないか、と思いました。
References
- Braak H, Del Tredici K. The pathological process underlying Alzheimer's disease in individuals under thirty. Acta Neuropathol. 2011 Feb;121(2):171-81. doi:10.1007/s00401-010-0789-4. Epub 2010 Dec 15. PMID: 21170538.
- Crary JF, Trojanowski JQ, Schneider JA, Abisambra JF, Abner EL, Alafuzoff I, Arnold SE, Attems J, Beach TG, Bigio EH, Cairns NJ, Dickson DW, Gearing M, Grinberg LT, Hof PR, Hyman BT, Jellinger K, Jicha GA, Kovacs GG, Knopman DS, Kofler J, Kukull WA, Mackenzie IR, Masliah E, McKee A, Montine TJ, Murray ME, Neltner JH, Santa-Maria I, Seeley WW, Serrano-Pozo A, Shelanski ML, Stein T, Takao M, Thal DR, Toledo JB, Troncoso JC, Vonsattel JP, White CL 3rd, Wisniewski T, Woltjer RL, Yamada M, Nelson PT. Primary age-related tauopathy (PART): a common pathology associated with human aging. Acta Neuropathol. 2014 Dec;128(6):755-66. doi:10.1007/s00401-014-1349-0. Epub 2014 Oct 28. PMID: 25348064; PMCID: PMC4257842.
- He Z, Guo JL, McBride JD, Narasimhan S, Kim H, Changolkar L, Zhang B, Gathagan RJ, Yue C, Dengler C, Stieber A, Nitla M, Coulter DA, Abel T, Brunden KR, Trojanowski JQ, Lee VM. Amyloid-β plaques enhance Alzheimer's brain tau-seeded pathologies by facilitating neuritic plaque tau aggregation. Nat Med. 2018 Jan;24(1):29-38. doi:10.1038/nm.4443. Epub 2017 Dec 4. PMID: 29200205; PMCID: PMC5760353.
- Lee WJ, Brown JA, Kim HR, La Joie R, Cho H, Lyoo CH, Rabinovici GD, Seong JK, Seeley WW; Alzheimer’s Disease Neuroimaging Initiative. Regional Aβ-tau interactions promote onset and acceleration of Alzheimer's disease tau spreading. Neuron. 2022 Apr 15:S0896-6273(22)00305-1. doi:10.1016/j.neuron.2022.03.034. Epub ahead of print. PMID: 35443153.