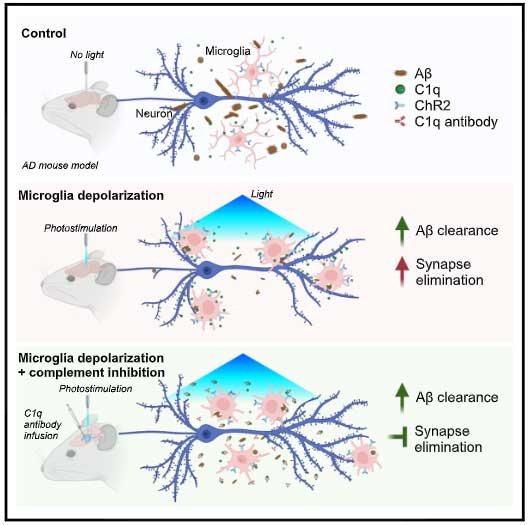
脳の掃除屋、ミクログリア。
アルツハイマー病 (Alzheimer's disease, AD) の脳内に蓄積するアミロイドβ (Amyloid beta, Aβ) プラーク周囲にも集族し、Aβプラークを除去しようと頑張ります。
けれどもミクログリアは、Aβだけでなく神経シナプス剪定にも関与しており、活性化したミクログリアは神経シナプスも貪食してしまいます。
……なんとかミクログリアシナプスを貪食せず、Aβだけ除去するよう働きかける事はできないでしょうか?
ということで今回、中国・深圳先進技術研究院(Shenzhen Institute of Advanced Technology, Chinese Academy of Sciences)のDr. Zhanらのグループは、
「補体C1qをブロックしながらオプトジェネシスでミクログリアを活性化したら、シナプスは保護したままミクログリアのAβ除去機能を上げることができる」
という事を報告しました [1]。

ミクログリアの活性化と補体の抑制でアルツハイマー病を治療
Targeted manipulation of microglia by optogenetics. Depolarized microglia display enhanced phagocytic capacity. Microglial depolarization leads to Aβ clearance and synapse elimination. Microglial phagocytosis of synapse but not Aβ is dependent on C1q
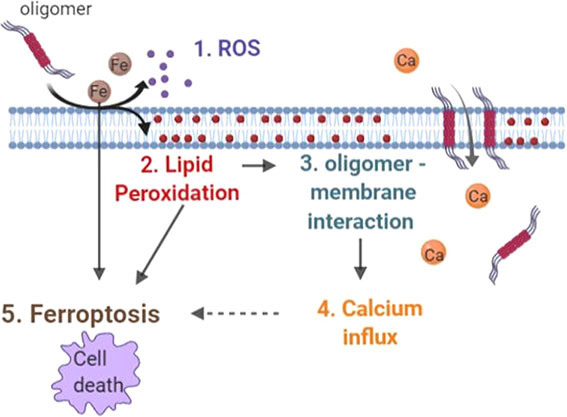
ミクログリアの活動を上げると、貪食機能がUP
彼らは、チャネルロドプシン遺伝子 ChETA(ChR2 E123T/A)をレンチウイルスを使ってBV2細胞と初代培養ミクログリアへ導入しました。
青色光を照射すると、ミクログリア内に脱分極が起こり、
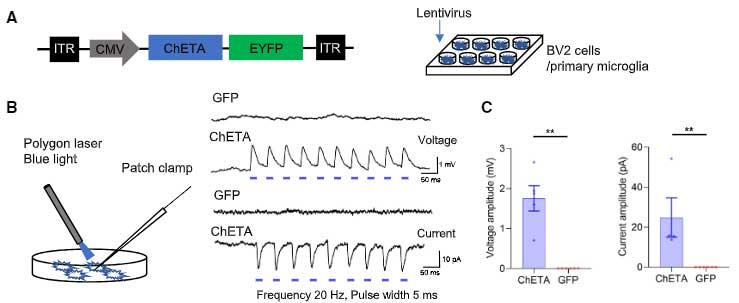
マイクロビーズ、シナプトソーム、アミロイドβ (Amyloid beta, Aβ) オリゴマーなどの貪食が亢進しました。
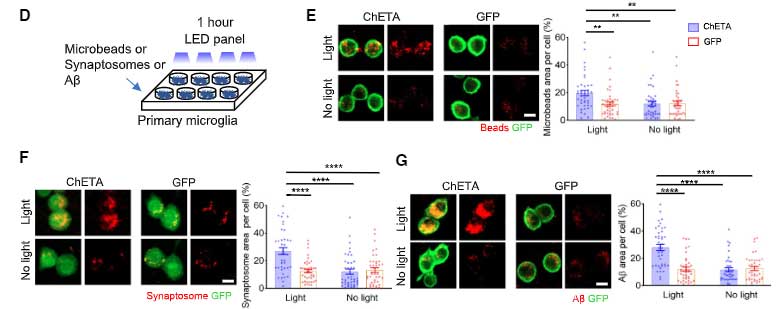
マウスのミクログリアの活動を上げると、Aβ貪食が亢進
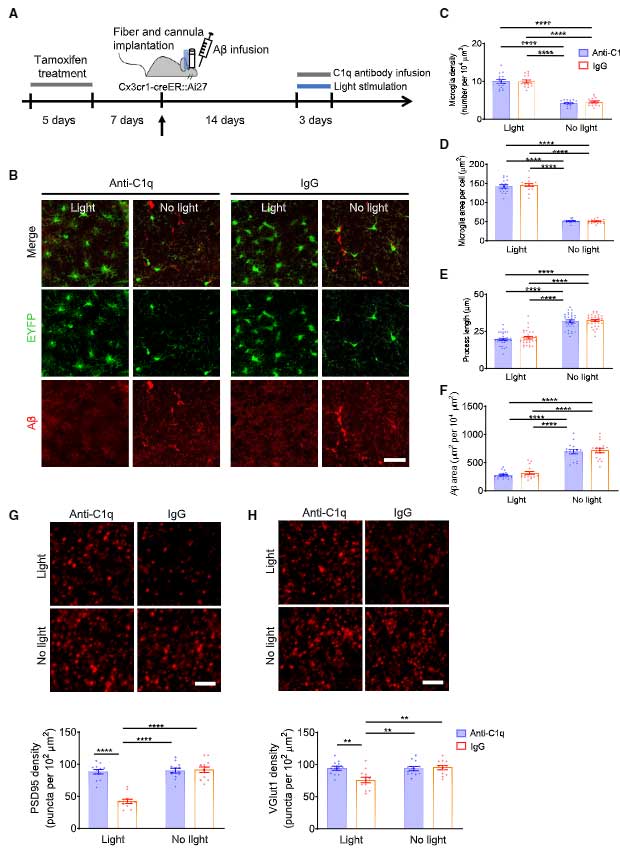
この現象をマウスで確認するため、彼らはタモキシフェン投与によりミクログリア(とマクロファージ)特異的にCreとEYFPが発現するマウス(Cx3cr1-creERマウス)[2] と、Cre依存的にチャネルロドプシンととTomato(ChR2-tdTomato)を発現するマウス(Ai27)[3] を交配し、青色光刺激によってミクログリアの活動が亢進するマウスを作製しました(Cx3cr1-creER::Ai27)。
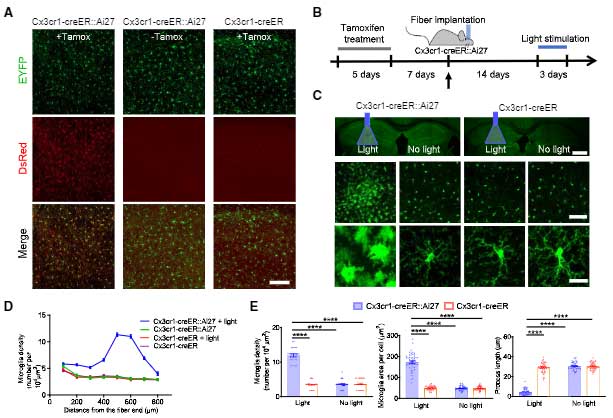
このマウスを、5xFADマウスと交配し、青色光でミクログリアの活動を亢進させると、ミクログリアの形は活性型ミクログリア様になり、Aβ量は減少しました。
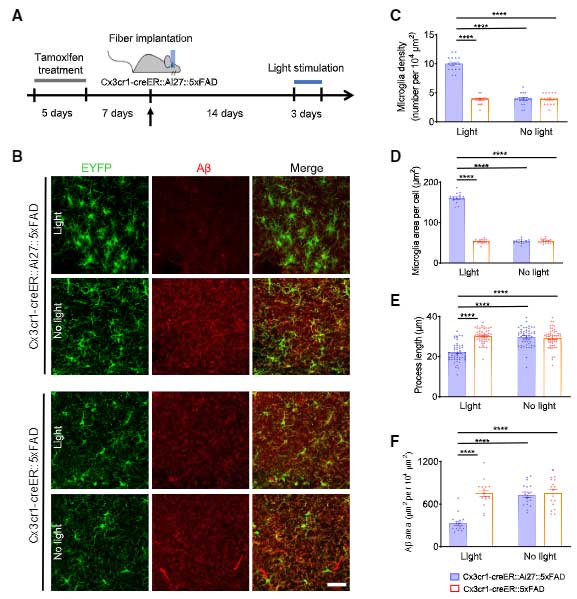
また、側脳室にAβオリゴマーを注入したマウスでも、オプトジェネティックス刺激で同様の結果が得られました。
マウスのミクログリアの活動を上げるとシナプス貪食も亢進
ミクログリアはシナプス剪定の機能もあるので、オプトジェネティックス刺激でシナプスの貪食も亢進していないか調べました。
すると、予想通り、オプトジェネチックス刺激で後シナプス(PSD95)も前シナプス(VGlut1)も減り、
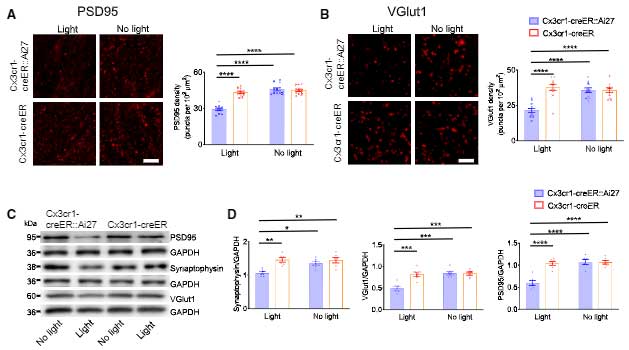
スパインの数も減少しました。
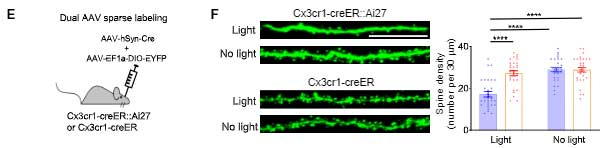
青色光の照射時間を変えて、ミクログリアのVGlut1貪食能を調べると、刺激時間依存的にVGlut1の貪食が増えていました。
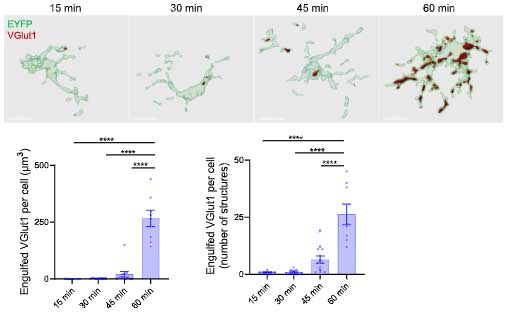
C1qを阻害しながらミクログリアの活動を上げると、シナプスの貪食を抑えながらAβ貪食能のみ亢進
- シナプス剪定には補体経路が関与していること [4]
- ADモデルでは、補体のC1qレベルが上昇していること [5]
- 補体のC1qを抗体などでブロックすると、タウマウスのシナプス障害を抑制できること [6, 7]
などから、彼らはC1qをブロックしながらミクログリアの活動を上げると、シナプスは保護しながらAβ除去能のみを上げられるのではないかと考えました。
そこで、抗C1q抗体を脳室内に投与しながらミクログリアをオプトジェネティックス刺激すると、予想どおりシナプスの減少を抑えることができました。
まとめ
以上の結果から、
- オプトジェネティックスでミクログリアの活動を上げるとAβ除去能が上がるが、シナプスも貪食されてしまう
- これを防ぐために、オプトジェネティックス刺激と同時に抗C1q抗体で補体系をブロックしておくと、シナプスは保護したままAβのみを選択的に貪食し、ADの治療法として使える可能性がある
という事がわかりました。

My View
ミクログリアの活動を上げてAβ除去というのはこれまでにも色々と試されてきたと思いますが、シナプス機能を維持したまま、というポイントは大事だと思います。
Aβだけなくなっても認知機能が悪くなったら意味ないですし。
ただ今回はオプトジェネティックスで活動を上げているので、機能がわかったという点では重要ですが、直接ヒトに応用するのは難しいですね。
ミクログリアの活動を上げる、安全でBBBを通過する薬剤があれば、良いのかもしれませんが。
この間も、「Aβの凝集阻害と神経炎症抑制」をターゲットにした報告を読みましたが [8]、
アルツハイマー病 (Alzheimer's disease, AD) に対する抗アミロイドβ (Amyloid beta, Aβ) 抗体が承認され、「疾患修飾薬はない」と言われ続けていたAD治療の分野は大きく前進しました …
「Aβ除去だけじゃだめだよね」という流れができてきているのかなーという気がしました。
Glossary
オプトジェネティクスに使用されるロドプシン関連の色々
ロドプシン(rhodopusin)は、光によって活性化される、Gタンパク質共役型受容体(G protein-coupled receptor, GPCR)。
人の場合は、網膜にある視物質ロドプシンが光情報を伝達するが、微生物型ロドプシンは光照射によるロドプシンの異性体変化に起因するイオンチャネルの開閉機能を持つ。
神経活動を誘導
2005年、Deisserothらのグループが、光吸収によりNa+などの陽イオンを細胞内へと輸送する「チャネルロドプシン2(Channel rhodopsin 2, ChR2)」を神経細胞に導入し、光照射により活動電位を発生する事を報告した [9]。
ChR2は緑藻類クラミドモナスの眼点から単離された7回膜貫通ドメインを持つ膜タンパクであり、470nmの波長を吸収極大とする blue light によって活性化され、非選択的用イオンチャネルを開口する [10]。
このChR2を導入した神経細胞は、青色光の照射によって細胞の膜電位が脱分極し、神経活動の興奮が起こる。
この機能を利用して、脳内の特定部位における神経活動のみを興奮させ、その生理学的機能を調べる研究が加速した。
他にも、心筋の収縮や間葉系幹細胞の分化など、幅広く利用されている [11] 。
チャネルロドプシンのバリエーション色々
(Addgene HPより一部改変し引用)
| バリアント | 機能 | ピーク反応波長 (nm) |
|---|---|---|
| ChR2 | 広く使用されている(CrChR2)。 | 470 |
| ChR2/H134 | CrChR2よりも光流量が多い。 | 450 |
| ChETA | E123T変異。開口/閉口は早いが、光流量の振幅は低い。 | 490 |
| ChR/T159A | T159C変異。光の流入を遅らせる。 | 470 |
| SFP/SSFO | 開口時定数を変化し、470 nmで開口して590 nmで閉口する。C128SとC156Aは閉口までの時間を遅らせる。 | 470でactive, 590でinactive |
| ReaChR | 赤色光で活性化。 | 590 |
細胞内シグナルカスケード制御や細胞機能を制御
ロドプシンは光によって活性化されるGタンパク質共役型受容体(G protein-coupled receptor, GPCR)だが、 2009年、Deisserothらは、この細胞内ドメインを他の受容体の細胞内ドメインと置換し、様々なセカンドメッセンジャーを光で誘導する技術を開発した [12]。
opto-β2AR
GPCRであるロドプシン受容体をβ2アドレナリン受容体の細胞内ドメインとスワップし、セカンドメッセンジャーである再クリックアデノシンモノリン酸(cAMP)の産生を光で誘導する。
opto-α1AR
GPCRであるロドプシン受容体をα1アドレナリン受容体とスワップし、セカンドメッセンジャーであるイノシトールトリスリン酸(IP3)やジアシルグリセロール(DAG)の産生を光で誘導する。
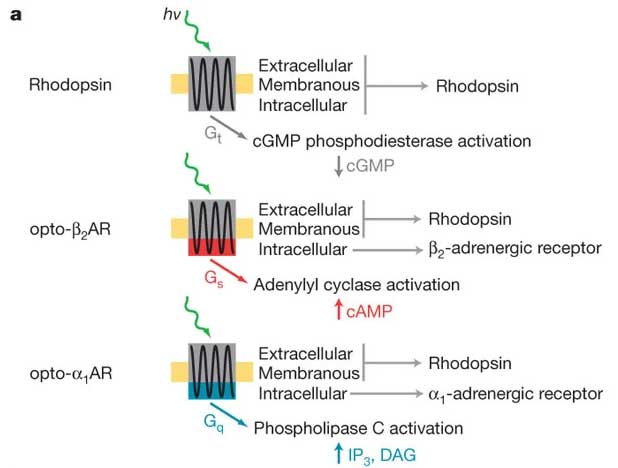
これらの技術は、細胞内シグナルカスケードの制御と細胞機能制御の解明に応用されている。
※セカンドメッセンジャーの色々
(コスモ・バイオHPより一部改変)
| セカンドメッセンジャー | シグナル伝達パスウェイ | 主な機能 |
|---|---|---|
| カルシウム(Ca2+) | Phosphoinositol Pathway | 細胞質内Ca2+濃度の増加により、筋収縮、エキソサイトーシス、Tリンパ球活性化、細胞接着及びアポトーシスなどの様々な応答を誘導。 |
| サイクリックアデノシンモノリン酸(cAMP) | Adenylyl Cyclase Signaling Pathway | タンパク質をリン酸化するcAMP依存性キナーゼであるプロテインキナーゼ(PKA)を活性化。イオンチャネル調節。遺伝子転写の調節。 |
| サイクリックグアノシンモノリン酸(cGMP) | Guanylyl Cyclase Signaling Pathway | タンパク質をリン酸化するcGMP依存性キナーゼであるプロテインキナーゼG(PKG)を活性化。 |
| イノシトールトリスリン酸(IP3) | Phosphoinositol Pathway | 小胞体上にあるカルシウムチャネルに結合し、細胞質へのカルシウム放出のトリガーとなる。 |
| ジアシルグリセロール(DAG) | Phosphoinositol Pathway | タンパク質をリン酸化するカルシウム依存性キナーゼであるプロテインキナーゼC(PKC)を活性化。 |
神経活動を抑制
神経活動抑制には、クロライドチャネル型のチャネルロドプシンや、ハロロドプシン(HaloR, NpHR)、アーキオロドプシン(Arch)等が用いられる。
HaloR
HaloRは古細菌から単離された分子で、590 nmの波長を吸収極大とする橙色光を需要することで活性化され、塩素イオンポンプを駆動する [13]。
細胞膜電位は過分極になるため神経活動は抑制される。
Arch
Archは570 nmを吸収極大とする緑色光によって活性化されるプロトンポンプであり、細胞外へプロトンを汲み出すためにHaloRと同様に膜電位を過分極させて神経活動を抑制する [14]。
ChR2の変異型
チェネルの特性(開口時定数の変化や、470 nmの波長光で開口して560 nmの波長光で閉口するC128SやD156A点変異体)
References
- Lv Z, Chen L, Chen P, Peng H, Rong Y, Hong W, Zhou Q, Li N, Li B, Paolicelli RC, Zhan Y. Clearance of β-amyloid and synapses by the optogenetic depolarization of microglia is complement selective. Neuron. 2024 Jan 30:S0896-6273(23)00931-5. doi: 10.1016/j.neuron.2023.12.003. Epub ahead of print. PMID: 38295790.
- Boyden ES, Zhang F, Bamberg E, Nagel G, Deisseroth K. Millisecond-timescale, genetically targeted optical control of neural activity. Nat Neurosci. 2005 Sep;8(9):1263-8. doi: 10.1038/nn1525. Epub 2005 Aug 14. PMID: 16116447.
- Parkhurst CN, Yang G, Ninan I, Savas JN, Yates JR 3rd, Lafaille JJ, Hempstead BL, Littman DR, Gan WB. Microglia promote learning-dependent synapse formation through brain-derived neurotrophic factor. Cell. 2013 Dec 19;155(7):1596-609. doi: 10.1016/j.cell.2013.11.030. PMID: 24360280; PMCID: PMC4033691.
- Madisen L, Mao T, Koch H, Zhuo JM, Berenyi A, Fujisawa S, Hsu YW, Garcia AJ 3rd, Gu X, Zanella S, Kidney J, Gu H, Mao Y, Hooks BM, Boyden ES, Buzsáki G, Ramirez JM, Jones AR, Svoboda K, Han X, Turner EE, Zeng H. A toolbox of Cre-dependent optogenetic transgenic mice for light-induced activation and silencing. Nat Neurosci. 2012 Mar 25;15(5):793-802. doi: 10.1038/nn.3078. PMID: 22446880; PMCID: PMC3337962.
- Yilmaz M, Yalcin E, Presumey J, Aw E, Ma M, Whelan CW, Stevens B, McCarroll SA, Carroll MC. Overexpression of schizophrenia susceptibility factor human complement C4A promotes excessive synaptic loss and behavioral changes in mice. Nat Neurosci. 2021 Feb;24(2):214-224. doi: 10.1038/s41593-020-00763-8. Epub 2020 Dec 22. PMID: 33353966; PMCID: PMC8086435.
- Hong S, Beja-Glasser VF, Nfonoyim BM, Frouin A, Li S, Ramakrishnan S, Merry KM, Shi Q, Rosenthal A, Barres BA, Lemere CA, Selkoe DJ, Stevens B. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 2016 May 6;352(6286):712-716. doi: 10.1126/science.aad8373. Epub 2016 Mar 31. PMID: 27033548; PMCID: PMC5094372.
- Dejanovic B, Huntley MA, De Mazière A, Meilandt WJ, Wu T, Srinivasan K, Jiang Z, Gandham V, Friedman BA, Ngu H, Foreman O, Carano RAD, Chih B, Klumperman J, Bakalarski C, Hanson JE, Sheng M. Changes in the Synaptic Proteome in Tauopathy and Rescue of Tau-Induced Synapse Loss by C1q Antibodies. Neuron. 2018 Dec 19;100(6):1322-1336.e7. doi: 10.1016/j.neuron.2018.10.014. Epub 2018 Nov 1. PMID: 30392797.
- Fonseca MI, Zhou J, Botto M, Tenner AJ. Absence of C1q leads to less neuropathology in transgenic mouse models of Alzheimer's disease. J Neurosci. 2004 Jul 21;24(29):6457-65. doi: 10.1523/JNEUROSCI.0901-04.2004. PMID: 15269255; PMCID: PMC6729885.
- Nagel G, Szellas T, Huhn W, Kateriya S, Adeishvili N, Berthold P, Ollig D, Hegemann P, Bamberg E. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proc Natl Acad Sci U S A. 2003 Nov 25;100(24):13940-5. doi: 10.1073/pnas.1936192100. Epub 2003 Nov 13. PMID: 14615590; PMCID: PMC283525.
- Arrenberg AB, Stainier DY, Baier H, Huisken J. Optogenetic control of cardiac function. Science. 2010 Nov 12;330(6006):971-4. doi: 10.1126/science.1195929. PMID: 21071670.
- Airan RD, Thompson KR, Fenno LE, Bernstein H, Deisseroth K. Temporally precise in vivo control of intracellular signalling. Nature. 2009 Apr 23;458(7241):1025-9. doi: 10.1038/nature07926. Epub 2009 Mar 18. PMID: 19295515.
- Han X, Boyden ES. Multiple-color optical activation, silencing, and desynchronization of neural activity, with single-spike temporal resolution. PLoS One. 2007 Mar 21;2(3):e299. doi: 10.1371/journal.pone.0000299. PMID: 17375185; PMCID: PMC1808431.
- Chow BY, Han X, Dobry AS, Qian X, Chuong AS, Li M, Henninger MA, Belfort GM, Lin Y, Monahan PE, Boyden ES. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature. 2010 Jan 7;463(7277):98-102. doi: 10.1038/nature08652. PMID: 20054397; PMCID: PMC2939492.