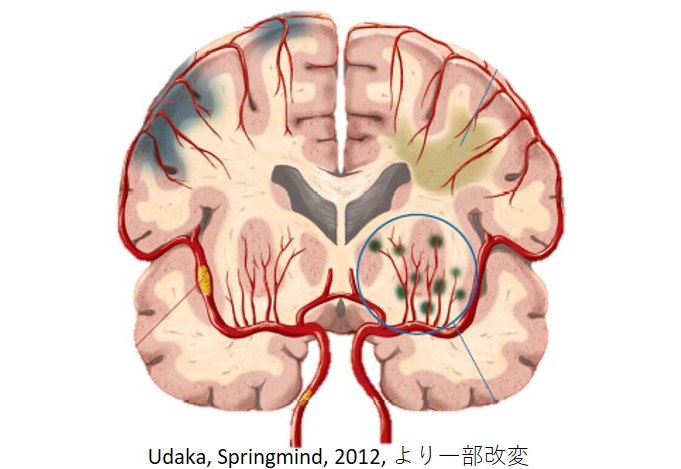
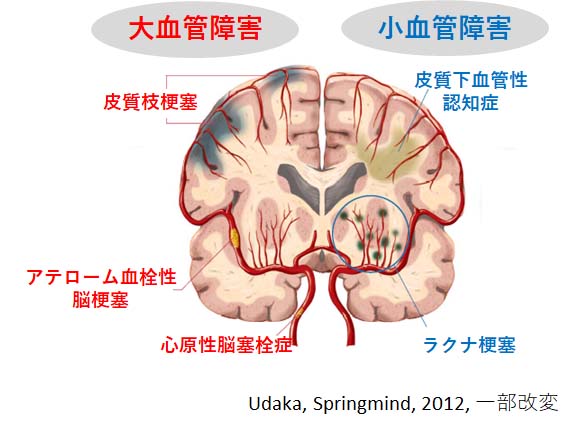
脳梗塞には、梗塞巣の大きさや数、発症原因によっていくつかの種類に分類されています。
セミナーで、私の以前行っていた研究内容を紹介しました。 思っていたよりもたくさんの人達からpositive feedbackを頂き、とても嬉しかったです。 最初のミーティングで中途退席という洗礼を頂いたPIからも、満面の …
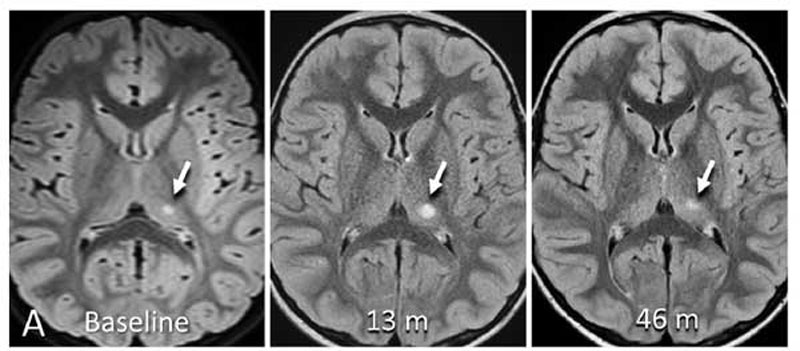
この内、脳の深部を流れる細い血管(穿通枝)が詰まることで生じる脳梗塞を「ラクナ梗塞」とよびます [1, 2]。
「ラクナ」とはラテン語で「小さな空洞」という意味で、画像上は15mm未満の小さな梗塞巣を意味します。
ラクナ梗塞の最大の原因は「高血圧症」で、穿通枝に高い圧力がかかる事で血管が脆くなり、破れたり詰まりやすくなったりすると考えられています。
小さい梗塞なので、そこまで重要ではない場所に1箇所くらいラクナがあっても症状がわかりにくいことも多いですが、
神経路や重要な皮質下灰白質などにラクナ梗塞を生じると、運動障害、感覚障害、認知症等、その責任病巣に応じた症状が出現します。
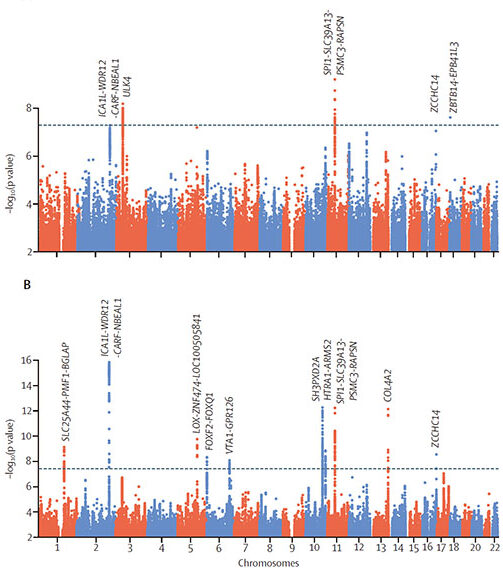
今回、International Stroke Genetics Consortium のメンバーのうち、イギリス、アメリカ、オーストラリアの共同研究で、ラクナ梗塞のリスク遺伝子を同定しました。(コレスポは、イギリス・ケンブリッジ大学のDr. Markus)

ラクナ梗塞のリスク遺伝子
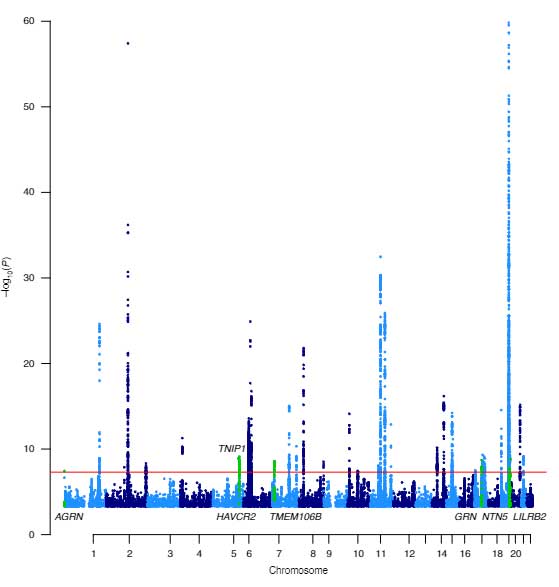
彼らは、MRIでラクナ梗塞と診断された患者さん7,338人と、コントロール254,798人を対象に、genome-wide association studies (GWAS) と transciptome-wide association study (TWAS) を行いました。
結果、下記5種類のラクナ梗塞リスク遺伝子を同定しました。
- ICA1l-WDR12-CARF-NBEAL1
- ULK4
- SPI1-SLC39A13-PSMC3-RAPSN
- ZCCHC14
- ZBTB14-EPB41L3
また、MRI上の脳白質高信号 (n = 42,310) と関連のある遺伝子7種類も同定しました。
- SLC25A44-PMF1-BGLAP
- LOX-ZNF474-LOC100505841
- FOXF2-FOXQ1
- VTA1-GPR126
- SH3PXD2A
- HTRA1-ARMS2
- COL4A2
これらのリスク遺伝子多型のうち、下記2遺伝子はラクナ梗塞・脳白質高信号の両方に共通でした。
- COL4A2
- HTRA1
TWASの結果では、下記6種類のラクナ梗塞リスク遺伝子を同定しました。
- SCL25A44
- ULK4
- CARF
- FAM117B
- ICA1L
- NBEAL1
また、パスウェイ解析では、
- 細胞外マトリックス
- ホスファチジルイノシトール5-リン酸 binding
- Roundabout binding
の障害が、ラクナ梗塞発症に関与している可能性を示唆していました。
既往歴・生活歴面では、既存の概念と同じく、
- 高血圧
- 喫煙歴
- 糖尿病
がラクナ梗塞のリスク因子となりました。
The genetic basis of lacunar stroke is poorly understood, with a single locus on 16q24 identified to date. We sought to identify novel associations and provide mechanistic insights into the disease.
My View
高血圧や糖尿病がなく、喫煙歴もない人がラクナ梗塞になったら……上記遺伝子のリスク多型を持っているかもしれません。
個人的には、ラクナと白質障害に共通の2遺伝子COL4A2とHTRA1に興味が湧きました。
COL4A2は血管の基底膜を形成するIV型コラーゲンをコードする遺伝子で、この変異は家族性脳小血管病を生じますし [4]、
HTRA1の変異も、遺伝性脳小血管病CARASIL(Cerebral autosomal recessive arteriopathy with subcortical infarcts and leukoencephalopathy)の原因遺伝子として知られています [5]。
遺伝性脳小血管病の原因だけでなく、孤発性ラクナ梗塞のリスク遺伝子ということがわかったので、
これらをターゲットにした遺伝子治療や下流シグナルの研究は、より多くの人々を救う事になるんじゃないかと思います。
他に、パスウェイ解析で得られた結果も、梗塞予防のターゲットメカニズムとして、色々研究できそうです。
こーゆー大規模メタ解析は、個人の力では無理ゲーなので、ありがたい研究だと思います。
References
- Pantoni L. Cerebral small vessel disease: from pathogenesis and clinical characteristics to therapeutic challenges. Lancet Neurol. 2010 Jul;9(7):689-701. doi: 10.1016/S1474-4422(10)70104-6. PMID: 20610345.
- Wardlaw JM, Smith C, Dichgans M. Small vessel disease: mechanisms and clinical implications. Lancet Neurol. 2019 Jul;18(7):684-696. doi: 10.1016/S1474-4422(19)30079-1. Epub 2019 May 13. PMID: 31097385.
- Traylor M, Persyn E, Tomppo L, et al. Genetic basis of lacunar stroke: a pooled analysis of individual patient data and genome-wide association studies. Lancet Neurol. 2021 Mar doi:https://doi.org/10.1016/S1474-4422(21)00031-4
- Verbeek E, Meuwissen ME, Verheijen FW, Govaert PP, Licht DJ, Kuo DS, Poulton CJ, Schot R, Lequin MH, Dudink J, Halley DJ, de Coo RI, den Hollander JC, Oegema R, Gould DB, Mancini GM. COL4A2 mutation associated with familial porencephaly and small-vessel disease. Eur J Hum Genet. 2012 Aug;20(8):844-51. doi: 10.1038/ejhg.2012.20. Epub 2012 Feb 15. PMID: 22333902; PMCID: PMC3400734.
- Hara K, Shiga A, Fukutake T, Nozaki H, Miyashita A, Yokoseki A, Kawata H, Koyama A, Arima K, Takahashi T, Ikeda M, Shiota H, Tamura M, Shimoe Y, Hirayama M, Arisato T, Yanagawa S, Tanaka A, Nakano I, Ikeda S, Yoshida Y, Yamamoto T, Ikeuchi T, Kuwano R, Nishizawa M, Tsuji S, Onodera O. Association of HTRA1 mutations and familial ischemic cerebral small-vessel disease. N Engl J Med. 2009 Apr 23;360(17):1729-39. doi: 10.1056/NEJMoa0801560. PMID: 19387015.