ヒトの脳内の多様性や複雑性は、普遍的なゲノムによってエンコードされていると考えられている。
脳内におけるゲノムのモザイク現象は、神経前駆細胞や神経細胞で同定され、コピー数の多様性(copy number variations: CNVs)を生み出していた。このゲノムのモザイク現象は、細胞の生存や遺伝子の転写などに影響を与えているといわれる。
しかし、体細胞内で特定の遺伝子の組み換えが起こっているという報告は、今までなかった。
Leeらは、アミロイドβ(Amyloid β:Aβ)の前駆体、アミロイド前駆タンパク(Amyloid precursor protein:APP)をコードするAPP遺伝子に着目した。APP遺伝子は、健常人の脳内でモザイクCNVsを生じる事がわかっているが、このCNVsは孤発性アルツハイマー病 (sporadic Alzheimer\'s disease : sAD) で増加する(Bushman et.al., eLIFE, 2015)。
しかしながら、(がん等とは違い脳細胞は増殖しないので)同じ変異を異なる脳細胞が持っている可能性は少なく、通常の方法でシークエンスをしても検出は難しい。
APP遺伝子の細胞内組み換えについて検証
神経細胞内の新規APP RNA変異
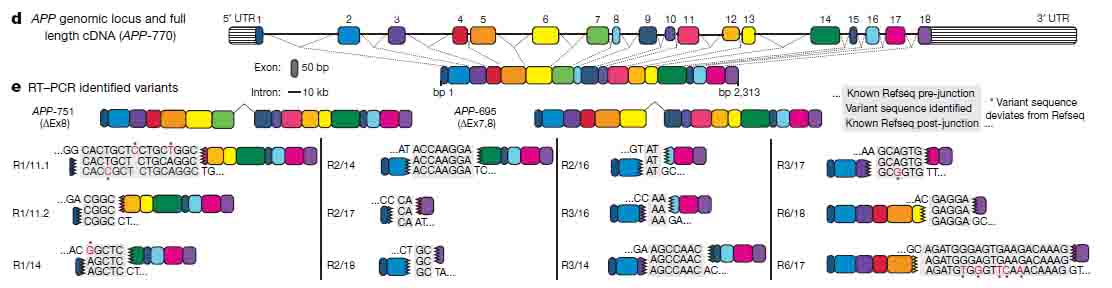
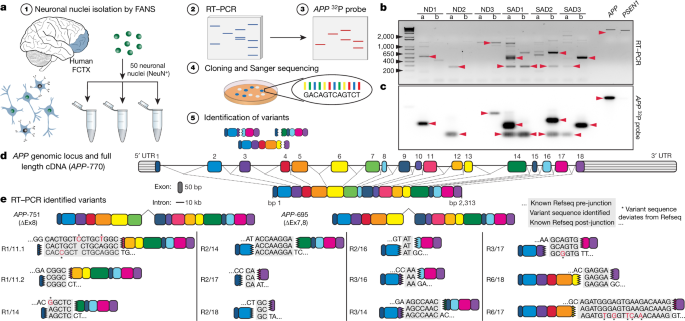
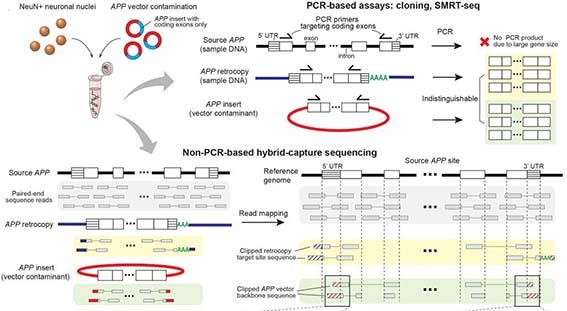
著者らは、 fluorescence-activated nuclear sorting (FANS)という方法で、sADとコントロールの前頭皮質からNeuN陽性の神経細胞の核を抽出し、RT-PCRで解析した。RT-PCRでは、エクソン1とエクソン18のプライマーを使用した。これは、APP cDNAの全長を増幅できるが、スプライシング変異であるAPP-751とAPP-695も検出した。しかしながら、様々なサイズの予期しないバンドも検出された。
サザンブロットで解析したところ、このバンドは今まで報告されていない変異で、中心のエクソン部分が抜け、エクソン内部の接合部(intra-exonic junctions: IEJs)によりN末側とC末側のエクソンが結合していた。
このようにして、神経細胞内でAPPの12個の新規mRNA変異が同定された。
神経細胞のゲノムDNAシークエンス
著者らは、これらのRNA変異が(正常遺伝子から転写されたのではなく)DNAのモザイク変異であるかどうかを調べた。
著者らは、健常人の脳とsADの脳から20個ずつの神経細胞核を取り出し、RNaeで処理したDNAを、APPのRNAやcDNAのプライマーを使って増幅させた。wild-typeのAPPゲノムは約300kbもあるので、通常のPCRで増幅させる事は不可能だ。しかし、ゲノムDNAのPCRは新規RNA変異と同サイズの増幅産物を得た。
他のさまざまな部位の細胞(肺線維芽細胞、ヒト胎児腎細胞、神経以外の脳細胞)などでは、このようなゲノムDNAは同定されなかった。
また、家族性ADの原因遺伝子で、APPを切断するプロテアーゼの構成成分であるプレセネリン1(PSEN1)を調べてみたが、このようなことは起こっていなかった。
PCR法以外でのゲノムDNAの同定
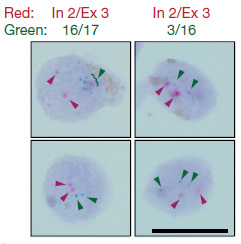
一つの細胞内でのゲノムでこのようなAPPのゲノムDNA結合がおこっているかどうかを調べるため、著者らはDNA in situ hybridization(DISH)法を開発した。この方法では、二種類のDISHプローブを使用した。一つは、通常のゲノムDNAシークエンス(エクソン16-エクソン17の部分)を認識するプローブ(DISH16/17)で、もう一つは新規同定された変異(エクソン3と16の部分)を認識するプローブ(DISH3/16)である。
イントロン2とエクソン3の部分を認識するプローブ(In2/Ex3)も用いて2重標識すると、DISH16/17、DISH3/16は、それぞれIn2/Ex3と共局在せず、これらの異常cDNAは、元のAPPアレルとは異なる様々なゲノム上にが存在している事がわかった。
これらの結果は、APP遺伝子が一度mRNAに転写された後、逆転写酵素でcDNAに転換され、それがゲノムの別の場所に再挿入された可能性を示唆している。
孤発性アルツハイマー病におけるAPPゲノムDNA
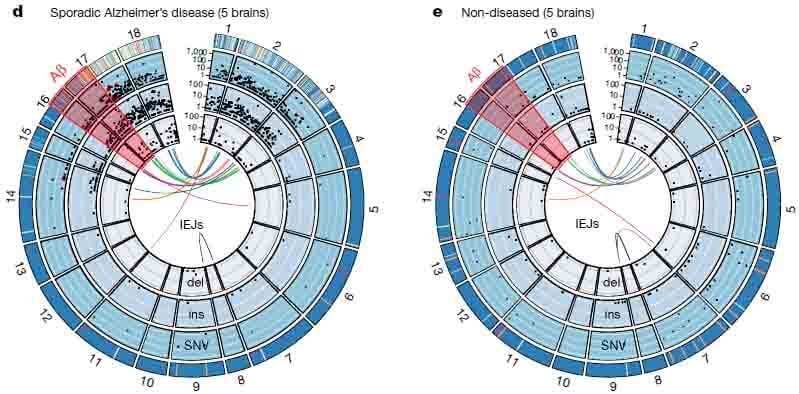
ゲノムDNAシークエンスの多様性は、single molecule real-time (SMRT) circular consensus sequencing (CCS) という、別の方法でも評価した。
sADの脳から抽出した神経細胞核からは、6,299種類のシークエンスが同定され、そのうち45個は異なったIEJsであった。健常人の脳から抽出した神経細胞核からは、1,084種類のシークエンスが同定され、そのうち20個のIEJsがあった。
sADの患者では、新規IEJsや一塩基変異(single nucleotide variants: SNVs)が健常人に比べて明らかに多かった。他方、健常人の脳内では通常のスプライシング変異であるAPP-751やAPP-695が多かった。
また特記すべき事として、sADの脳内では家族性ADの原因となるSNVsが11種類同定され、健常人の脳からは一つも同定されなかった。
変異ゲノムDNAの形成
どうやってこのような変異ゲノムDNAが作られるのか、著者らは細胞系を使って調べた。
Chinese hamster ovary細胞(CHO細胞)にAPP-751を発現させ、内因性の逆転写酵素を加えたが、このような変異ゲノムDNAは作られなかった。しかし、それに過酸化水素(H2O2)を加えると、これらの新規ゲノムDNAsが作られた。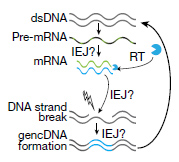
内因性逆転写酵素阻害薬で処理すると、これらの反応は抑制された。このことから、これらの変異ゲノムDNAの産生には、内因性の逆転写酵素+α(酸化ストレス等)が必要と考えられた。
sAD患者脳とAPP遺伝子改変マウス脳の神経細胞で変異DNAが増えている
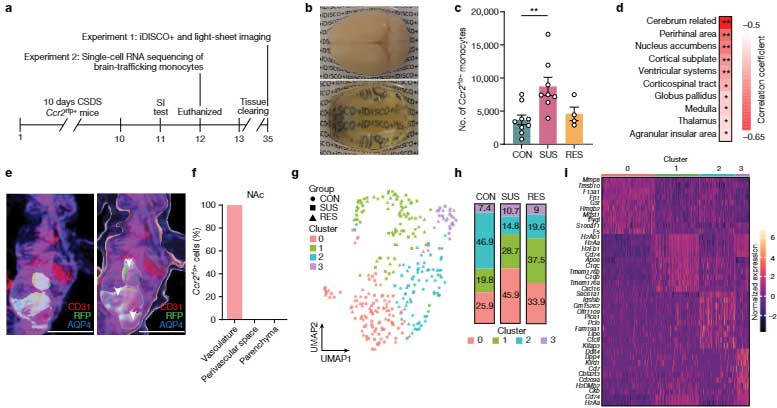
著者らは、DISH16/17のプローブとDISH3/16のプローブを用いて、これらの変異DNAとsADの発症に相関があるかどうか調べた。
sADと健常人の脳を6人ずつ調べたところ、sADの脳神経細胞内では、変異DNAが3-5倍程度増加していた。
これらの変異DNAが毒性を持つかどうか調べるため、SH-SY5Y細胞に3種類のAPP RNA変異(R2/18, R3/14, R3/16)を導入した。このうち2種類のRNA変異が神経細胞死を誘導した。
J20マウス(APP KM670/671ML (Swedish) 変異とAPP V717F (Indiana) 変異が導入されたマウス)の脳神経細胞をDISH3/16を使って調べたところ、変異DNAはマウスの神経細胞内で年齢依存的に増加していた。
The gene for the amyloid precursor protein (APP) shows somatic gene recombination in neurons, and the abundance and diversity of APP variants is increased in neurons from individuals with Alzheimer’s disease.
My View
アルツハイマー病の95%以上は孤発性です。
孤発性のアルツハイマー病がどのようにして起こるのか、それはまだほとんど解明できていません。
アルツハイマー病の大きな特徴である
- 老人斑―アミロイドβ(Aβ)病理
- 神経原線維変化ー過リン酸化タウ病理
が注目されており、それぞれ研究が進められています。
家族性ADで原因遺伝子がわかっているものは、現時点ではすべてAβの産生に関連する遺伝子(APP, PSEN1, PSEN2)です。強い危険因子とされるAPOEやTREM2等もAβ病理と深くかかわっています。
認知機能と相関が強いのはタウ病理の進展ですが、タウ病理は健常人でも10代の頃から少しずつ出現して(Braak and Tredici, Acta Neuropathol, 2011, Braak et.al., Acta Neuropathol, 2014)内側側頭葉内に広がっていきます。そこにAβの存在があると、タウ病理の伝播が一機に加速して内側側頭葉を越え、ADを発症していく(He et.al, Nat Med, 2018)と、個人的には考えています。
では、なぜAβ病理が増える人とそうでない人がいるのか?
家族性ADの変異、APOE、TREM2など、現在わかっている遺伝子が関係している症例も多いですが、それらの因子がなくても、加齢とともにAβ病理は増える傾向にあります。
今回の論文で主張している事が本当にヒトの脳内で起こっているのだとしたら・・・その疑問に対する一つの答えを示しているように思います。
神経細胞内のAPP遺伝子にはトランスポゾンのような機能があり、加齢に伴うファクターが関与して、細胞内で異常DNAがゲノム上に再挿入され増殖していく・・・そしてその量が多かったり、家族性変異のものが作られたりすると、Aβの産生量は多くなり、Aβ病理が形成されていく・・・
また、Aβ自身もプリオンのように伝播するようなので、
著者らは、以前、死後脳の下垂体から抽出・精製したヒト由来成長ホルモン(human cadaveric pituritary-derived grouth hormone:c-hGH)投与により、医原性クロイツフェルト・ヤ …
異常Aβの産生が増えて、ある一定レベルになれば、正常Aβを異常に折りたたみながら広がっていき、AD発症の素地を作っていくのかもしれません。
著者らは考察で、HIV患者に使用する逆転写酵素阻害薬等が、有効な治療法となる可能性に触れています。この話が本当であれば、ADの疾患修飾療法につながるかもしれません。
でも、なぜこんな事がおこるのでしょうか?また、なぜAPP遺伝子だけがこのような機能を持っているのでしょうか?
まだ謎は多いですが、とてもインパクトのある論文でした。