
筋萎縮性側索硬化症 (Amyotrophic Lateral Sclerosis, ALS) は、主に上位下位の運動神経が障害されていく疾患で、約10%が家族性、90%が孤発性に発症します。
ALSで同定されているものの中で最も多い遺伝子変異は C9orf72の6塩基反復配列の伸長で、家族性ALSの約40%、孤発性ALSの約8%に認められています。
C9orf72がALSを発症する機序の一つとして、核膜孔複合体 (Nuclear Pore Complex, NPC) の異常が注目されていますが、詳細についてまだ色々とわかっていないことも多いようです。
今回、アメリカ・ジョーンズホプキンス大学の Dr. Coyne, Dr. Rothsteln らの研究グループは、NPCのホメオスタシスに重要な働きをもつCHMP7(Charged Multivesicular Body Protein 7) に注目し、
CHMP7の核内集積が、NPCの異常、そしてALSの主要病理の一つであるTDP-43の異所性局在を誘導することを報告しました [1]。

CHMP7の核内集積がNPC異常のきっかけになり、ALS特有のTDP-43異所性凝集を誘導する
ALS由来のiPS神経では、NPCの核内局在低下/CHMP7の核内局在上昇が起こっている
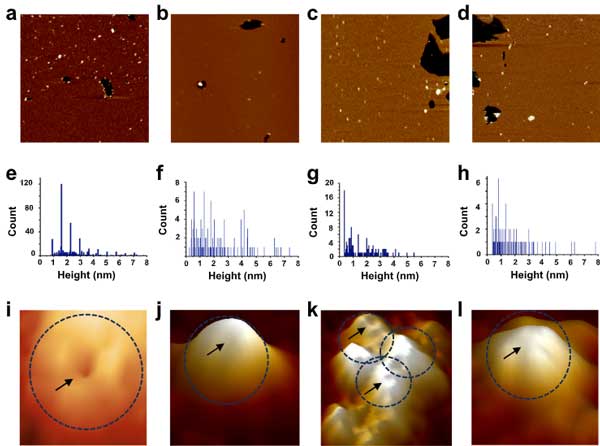
著者らは、孤発性ALS患者さんとコントロールのiPS細胞から分化させた運動神経のNPCを 超解像顕微鏡 (super-resolution structured illumination microscopy, SIM) で観察し、
NPC の構成構成蛋白群であるヌクレオポリン (nucleoporins, Nups) を観察し、ALS由来のiPS神経でNupsの核内発現が軒並み低下している事を示しました。
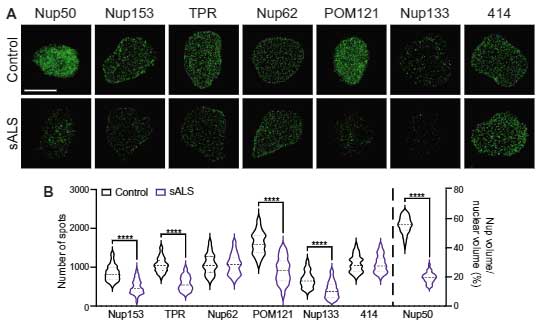
今回注目しているCHMP7を調べると、C9orf72変異ALS患者さんと孤発性ALS患者さん由来のiPS神経でCMMP7の核内の局在が上がっていました。
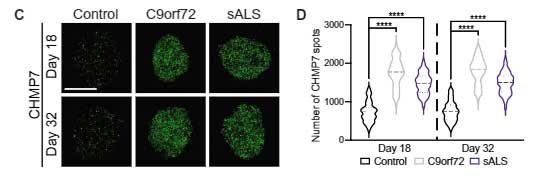
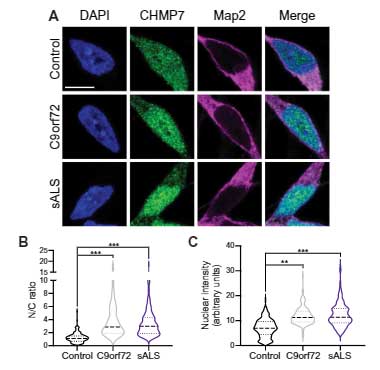
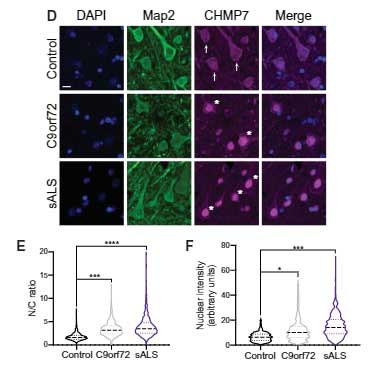
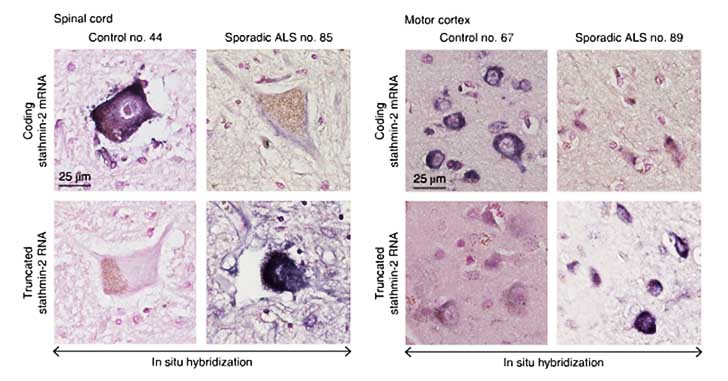
同様の結果は、C9orf72と孤発性ALSの剖検脳でも確認できました。
CHMP7を核内で強制発現すると、Nupの核内局在が低下し、TDP-43の異局在化が起こる
上記のiPS細胞を観察していると、CHMP7の変化の方がNupの変化よりも先に起こっていそうだったので、
彼らはCHMP7を核内で強制発現して、Nupの動態を確認しました。
すると、CHMP7を全体で強制発現したときには特に変化がありませんでしたが、
核外搬出シグナル (Nuclear export signal, NES) の一部に変異を入れてCHMP7を核内に留まらせると、
- Nup50
- POM121
- Nup133
などのNup系蛋白の核内局在が軒並み下がりました。
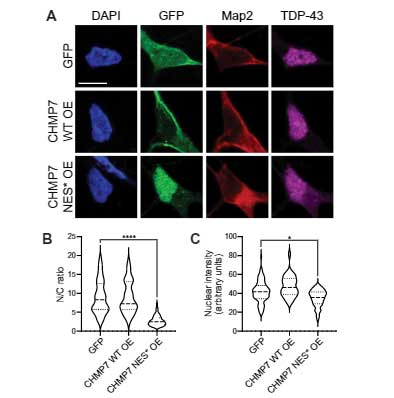
さらに、TDP-43 も一部細胞外に異所局在しており、
TDP-43 の機能障害によって生じる STMN2 mRNA のスプライシングも変化していました [2]。
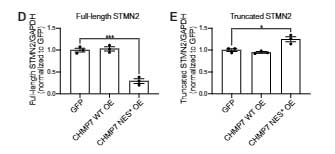
筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis: ALS)の多くの症例と、前頭側頭型認知症(Fronttemporal dementia:FTD)の約45%の症例でDNA-binding …
C9orf72ALS/FTD 患者さんと孤発性ALS患者さんの脳運動皮質でも、CHMP7の核内集積とTDP-43の細胞質凝集を認める神経細胞が確認されました。
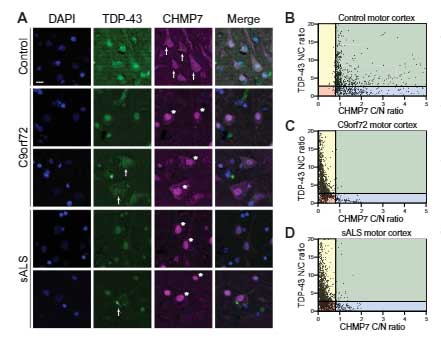
ASOでCHMP7を抑えると、C9orf72と孤発性ALS由来のiPS神経細胞のNup核局在が改善する
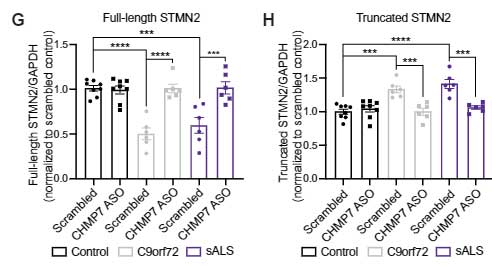
最後に著者らは、アンチセンスオリゴヌクレオチド(antisense oligonucleotides, ASO)でCHMP7の発現を抑え、病態が改善するかどうか確認しました。
結果、Nup群の核局在はほぼ改善し、
STMN2のスプライシングも正常化、
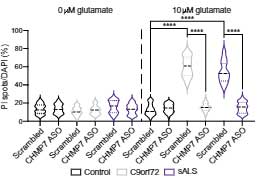
グルタミン酸処置 (10 µM) による神経興奮毒性も、ASOで抑えられました。
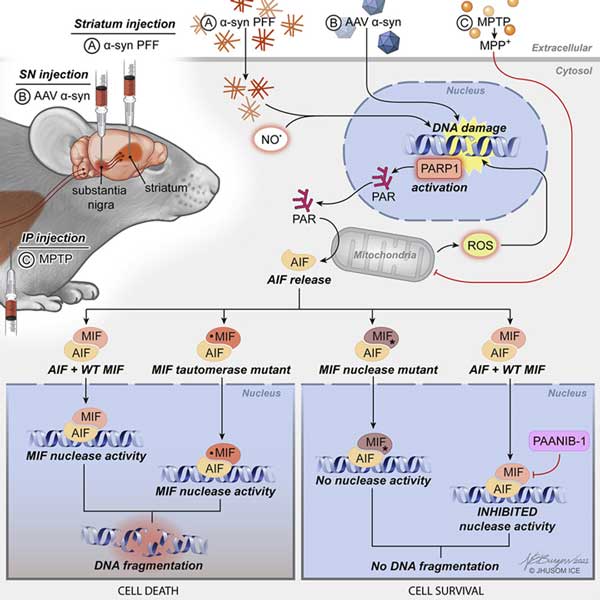
以上の結果から、
CHMP7の核内集積
↓
Nupsの核局在低下
↓
NPCの機能異常
↓
TDP-43の核外異局在化
↓
TDP-43の機能喪失による神経障害
という流れが考えられました。
The majority of amyotrophic lateral sclerosis (ALS) cases are of unknown origin (sporadic, sALS). The nuclear pore complex (NPC) has been involved in familial ALS (fALS); whether and how it plays a role also in sALS remains to be elucidated. Now, Coyne et al. used human tissue and induced pluripotent stem cell–derived motor neurons from patients with fALS and sALS to show that the protein CHMP7, previously shown to be involved in NPC homeostasis in yeast, was increased in both ALS subtypes. Antisense oligonucleotide targeting CHMP7 reduced NPC and TDP-43 abnormalities and promoted neuronal survival, suggesting that CHMP7 is a potential target for treating both sALS and fALS.
My View
今やっているプロジェクトの一つでTDP-43の病理をやっているので、もっと分子メカニズムも勉強しないとなー、と思っています……が、いつも後回しになりがちなので、ちょっと反省……。
今回の論文は、NupがNPCを作る最初のステップで重要は働きを持つCHMP7に注目した内容でした。
「CHMP7核内集積 →NPCの機能異常 →TDP-43の核外異局在化」
の流れを iPS細胞由来の神経細胞を使って示していて、興味深いと思います。
気になったのは、iPS細胞がコントロール、C9orf72、孤発性ALSで1ラインずつみたいなので、個体差とかはみなくていいのかなーと思ったところと、
CHMP7ってかなり重要そうなのですが、この論文で最終的に使ったASOはノックダウンの程度が強くてほぼ発現が消えているようにみえるので、
「こんなにCHMP7減らして、それだけ (Glu 0 µM) では異常が出ない って……ホントかな?」
と、ちょっと心配になりました。
本当に CHMP7↓ で病理が改善すれば、治療ターゲットとなるかもですが、モデル動物での改善はみていないので先は長そうなのと、安全性の問題はついてまわりそうに思います。
また、CHMP7核内集積でTDP-43の異局在化までは再現できていますが、凝集まではしていないので、
「FTLD/ALSのTDP-43病理を再現するには、あと一歩別の機序が必要なのかもなー」と、思いました。
References
- Coyne AN, Baskerville V, Zaepfel BL, Dickson DW, Rigo F, Bennett F, Lusk CP, Rothstein JD. Nuclear accumulation of CHMP7 initiates nuclear pore complex injury and subsequentTDP-43dysfunction in sporadic and familial ALS. Sci Transl Med. 2021 Jul 28;13(604):eabe1923. doi: 10.1126/scitranslmed.abe1923. PMID: 34321318.
- Melamed Z, López-Erauskin J, Baughn MW, Zhang O, Drenner K, Sun Y, Freyermuth F, McMahon MA, Beccari MS, Artates JW, Ohkubo T, Rodriguez M, Lin N, Wu D, Bennett CF, Rigo F, Da Cruz S, Ravits J, Lagier-Tourenne C, Cleveland DW. Premature polyadenylation-mediated loss of stathmin-2 is a hallmark of TDP-43-dependent neurodegeneration. Nat Neurosci. 2019 Feb;22(2):180-190. doi: 10.1038/s41593-018-0293-z. Epub 2019 Jan 14. PMID: 30643298; PMCID: PMC6348009.




核内の増加という意味でした。。。。が言葉足らずな文章になってしまい申し訳ありません。
確かに過剰発現という表現は適さないと感じました。ありがとうございます。
そして1.5倍に対する所感も教えていただき助かります。当方、専門が有機化学のため分子生物学の詳細な知識が不足しておりました。
そうですね。NESの方がいいかもしれません。そしてメカニズムの解明という点では同感です。少しずつでもわかることが増えていけば治療薬開発に繋がると思います。
こちらこそありがとうございます。
言葉の定義についてはディスカッションの際に誤解の元になるので、先に確認しておいたほうが良いと思った次第です……ので、言葉の使い方などはお気になさらずどんどんご意見いただけると嬉しいです。
私の場合は専門範囲がざっくりとしているので、色々な分野の方々からのご意見は大変勉強になります。
低分子化合物とか逆立ちしても作れないので、作りたくなったらよろしくお願いします笑
これはすごい発見かもしれませんね!
論文を見たところWestern BlotでALS患者由来iPS細胞のCHMP7の定量化を行い、増加していましたが、実際に増加したのは1.5倍程度だったように思います。
もちろんWesternの定量性は正確ではないにしろ、星が付いており、有意差はあったのですが、過剰発現と言っていいレベルなんでしょうか?
CHMP7に関して少し調べましたが、低分子では狙いにくそうですね
核を単離してWBしているので、”核内での” 増加という事ですね。
細胞質画分も並行でWBしたら、どれくらい局在が変わっているかもっと正確に比が出せるんじゃないかと思いますが、この論文ではそこまではしていなさそうですね。
“過剰発現” という言葉は人為的に発現を上げるという意味合いが強いので、この結果を表現する場合にはそぐわないように思います。
個人的な意見として、人為的に過剰発現させる場合と違って、自然の状態で核内で1.5倍増えていたら、それは結構大きな変化だと思います。iPS細胞から神経に分化させただけで核内のCHMP7の量が1.5倍増えているわけなので。
治療ターゲットとしては、Hiroさんの仰るように、私もCHMP7全体を狙うのはちょっと難しい気がします。
かなりコアな働きをしている蛋白ですし、ゼブラフィッシュではCHMP7+/-で表現型が出ていますしね。
NESをターゲットにするのはアリかと思いますが。
でも、メカニズムの解明という点においては、重要な内容だと思います。詰めていけばもっとアプローチしやすいターゲットにも繋がるかもしれないですね。