先日に引き続き、ミクログリアのイメージングのお話。
アルツハイマー病(Alzheimer's disease, AD)の診断をつける上で、画像データは欠かせませんが、だいたい single-photon emission computerized tomography (SPECT) か、2-Deoxy-2-[18F]fluoro-D-glucose positron emission tomography (FDG-PET) を使う事が多いと思います。
SPECTは放射性同位元素を注入して脳血流量によって神経の代謝を観察し、FDG-PETは、脳の神経細胞がエネルギー源としてブドウ糖を取り込む現象を利用して神経の糖代謝を観察します。
両方とも、後部帯状回・楔前部・頭頂側頭連合野から集積低下が始まり、進行すると前頭連合野も集積が低下します。
ただ、以前より超早期のADで一時的にFDG-PETの集積が上がる、という現象があり [1, 2, 3] 、
「Aβによって一時的に神経が過活動になっているのでは?」など、色々推測されていました。
一方で、ミクログリアの機能が喪失する TREM2 T66M 変異ではFDGの取り込みが著名に低下する [4] という事も報告されており、「ミクログリアの糖代謝がFDG-PETに反映されているのでは」という可能性も示唆されてきました。
今回、ドイツ・ミュンヘン神経変性疾患センターの Dr. Haass, Dr. Brendel らの研究グループは、
「ミクログリアは神経よりもFDGを多く取り込み、FDG-PETの結果には神経の糖代謝だけでなくミクログリアの糖代謝も反映されている」という内容を報告しました [5]。

FDG-PETは、神経変性だけじゃなくミクログリアの糖代謝も反映していた
ミクログリアを欠失させるとFDGの取り込みが低下する
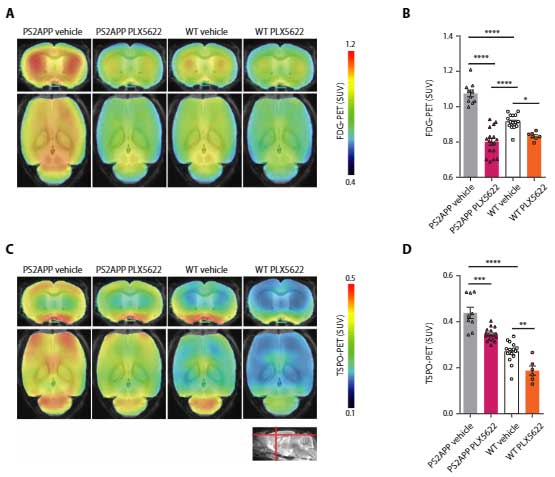
著者らはまず、
- PS2APPマウス(Aβ↑)
- PS2APPマウスxPLX5622投与(Aβ↑かつミクログリア↓)
- 野生型(WT)マウス
- WTマウスxPLX5622投与(ミクログリア↓)
の4群のマウスに
- FDG-PET
- 18-kDa translocator protein (TSPO) PET
- アミロイドPET
を行い、Aβプラークの蓄積が多いPS2APPマウスではFDGの取り込みが高いのに、PSX5622でミクログリアを欠失させるとFDGの取り込みが著減する事を確認しました。

また、Trem2-/-xAPPPS1マウスでも同様の現象を確認し、
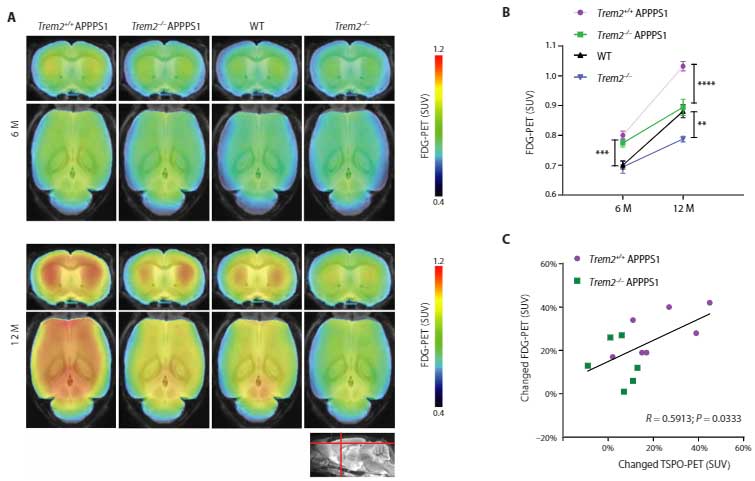
「ミクログリアを欠失させるとFDGの取り込みが低下する」事を示しました。
ミクログリアの活性化がFDGの取り込み量を規定する
実際にどれくらいの割合でミクログリアがFDGを取り込むのか調べるため、
著者らは、WTマウスにFDGを注入し、30分後に脳内のミクログリア、アストロサイト、ニューロン、オリゴデンドロサイトを単離してFDG取り込み量を測定しました。
結果、ミクログリアがダントツにFDGを取り込んでおり、
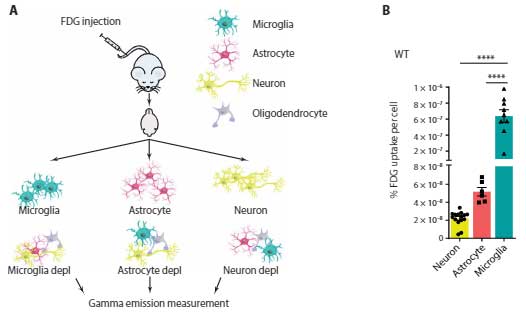
この現象は、Trem2-/-(ミクログリアの機能喪失)で減少、
APPKI(Aβ↑で活性化ミクログリアも↑)で増加し、

「ミクログリアが最も多くのFDGを取り込み、その量はミクログリアの活性に左右される」という事が示唆されました。
ヒトでも確認
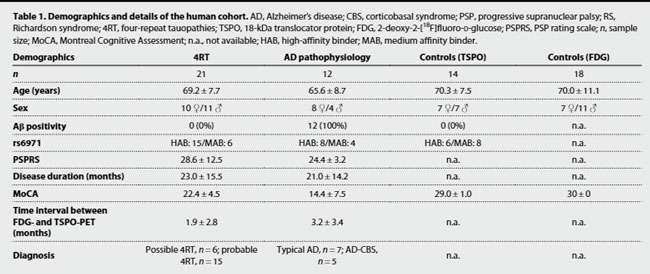
最後に、これらマウスの結果がヒトでもあてはまるかどうか、
- アミロイドPET陽性のAD (n=12)
- アミロイドPET陰性の4リピートタウオパチー (4RT, n=21)
- コントロール (TSPO, n=14; FDG, n=18)
のTSPO-PETとFDG-PETを撮像し、検討しました。
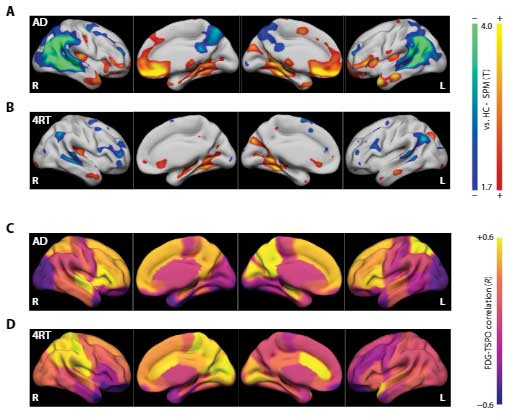
結果、神経障害が強くない症例では、活性化ミクログリアの程度とFDG-PETシグナルに正の相関がみられ、「FDG-PETのシグナルの一部はミクログリアの糖代謝を拾っている」可能性が示唆されました。
けれど、ADの頭頂葉や側頭葉、4RTの前頭葉や側頭葉のFDG集積低下はTSPOのシグナルとは相関しなかったので、「それでもFDG-PETでは神経障害の程度が最も強く反映されている」と考えられました。
FDG-PET shows that microglial activation might drive cerebral glucose uptake in mice and patients with AD.
References
- Benzinger TL, Blazey T, Jack CR Jr, Koeppe RA, Su Y, Xiong C, Raichle ME, Snyder AZ, Ances BM, Bateman RJ, Cairns NJ, Fagan AM, Goate A, Marcus DS, Aisen PS, Christensen JJ, Ercole L, Hornbeck RC, Farrar AM, Aldea P, Jasielec MS, Owen CJ, Xie X, Mayeux R, Brickman A, McDade E, Klunk W, Mathis CA, Ringman J, Thompson PM, Ghetti B, Saykin AJ, Sperling RA, Johnson KA, Salloway S, Correia S, Schofield PR, Masters CL, Rowe C, Villemagne VL, Martins R, Ourselin S, Rossor MN, Fox NC, Cash DM, Weiner MW, Holtzman DM, Buckles VD, Moulder K, Morris JC. Regional variability of imaging biomarkers in autosomal dominant Alzheimer's disease. Proc Natl Acad Sci U S A. 2013 Nov 19;110(47):E4502-9. doi:10.1073/pnas.1317918110. Epub 2013 Nov 5. PMID: 24194552; PMCID: PMC3839740.
- Cohen AD, Price JC, Weissfeld LA, James J, Rosario BL, Bi W, Nebes RD, Saxton JA, Snitz BE, Aizenstein HA, Wolk DA Dekosky ST, Mathis CA, Klunk WE. Basal cerebral metabolism may modulate the cognitive effects of Abeta in mild cognitive impairment: an example of brain reserve. J Neurosci. 2009 Nov 25;29(47):14770-8. doi:10.1523/JNEUROSCI.3669-09.2009. PMID: 19940172; PMCID: PMC2810461.
- Gordon BA, Blazey TM, Su Y, Hari-Raj A, Dincer A, Flores S, Christensen J, McDade E, Wang G, Xiong C, Cairns NJ, Hassenstab J, Marcus DS, Fagan AM, Jack CR Jr, Hornbeck RC, Paumier KL, Ances BM, Berman SB, Brickman AM, Cash DM, Chhatwal JP, Correia S, Förster S, Fox NC, Graff-Radford NR, la Fougère C, Levin J, Masters CL, Rossor MN, Salloway S, Saykin AJ, Schofield PR, Thompson PM, Weiner MM, Holtzman DM, Raichle ME, Morris JC, Bateman RJ, Benzinger TLS. Spatial patterns of neuroimaging biomarker change in individuals from families with autosomal dominant Alzheimer's disease: a longitudinal study. Lancet Neurol. 2018 Mar;17(3):241-250. doi: 10.1016/S1474-4422(18)30028-0. Epub 2018 Feb 1. PMID: 29397305; PMCID: PMC5816717.
- Kleinberger G, Brendel M, Mracsko E, Wefers B, Groeneweg L, Xiang X, Focke C, Deußing M, Suárez-Calvet M, Mazaheri F, Parhizkar S, Pettkus N, Wurst W, Feederle R, Bartenstein P, Mueggler T, Arzberger T, Knuesel I, Rominger A, Haass C. The FTD-like syndrome causing TREM2 T66M mutation impairs microglia function, brain perfusion, and glucose metabolism. EMBO J. 2017 Jul 3;36(13):1837-1853. doi: 10.15252/embj.201796516. Epub 2017 May 30. PMID: 28559417; PMCID: PMC5494459.
- Xiang X, Wind K, Wiedemann T, Blume T, Shi Y, Briel N, Beyer L, Biechele G, Eckenweber F, Zatcepin A, Lammich S, Ribicic S, Tahirovic S, Willem M, Deussing M, Palleis C, Rauchmann BS, Gildehaus FJ, Lindner S, Spitz C, Franzmeier N, Baumann K, Rominger A, Bartenstein P, Ziegler S, Drzezga A, Respondek G, Buerger K, Perneczky R, Levin J, Höglinger GU, Herms J, Haass C, Brendel M. Microglial activation states drive glucose uptake and FDG-PET alterations in neurodegenerative diseases. Sci Transl Med. 2021 Oct 13;13(615):eabe5640. doi: 10.1126/scitranslmed.abe5640. Epub 2021 Oct 13. PMID: 34644146.