アルツハイマー病(Alzheimer's disease, AD)は、認知症をきたす疾患の中で最も症例の多い疾患ですが、同じADでも、10年以上かけてゆっくり進行するタイプもあれば、発症から数ヶ月~1年程度で急激に症状が悪化するタイプもあり、その臨床経過は様々です。
以前より、発症から2-3年以内に急激に臨床症状が悪化し、死亡してしまうタイプのADを「急性進行形AD(rapid progressive AD, rpAD」、ゆっくり進行するタイプを「慢性進行形AD(slowly progressive AD, spAD」と、区分し、
それら違いについて分子生物学的に解析されてきました [1, 2, 3, 4, 5]。
それらの多くはアミロイドβ(Amyloid beta, Aβ)に注目した研究で、
- rpADにはAβオリゴマーがより多く含まれている[2] 。
- rpADのAβプラークには神経関連タンパクが多く、アストロサイト関連タンパクが少ない [3] 。
- rpADのAβプラークにはシナプス関連タンパクが多く含まれている [3] 。
- Aβ40フィブリルをcryo-EMで見ると、典型的なADがAβ40のみで構成されているのに対し、rpADのフィブリルは(よくわからない)他の構造物が混ざっている [4] 。
などが報告されています。
タウに関しても、
- rpADには高分子タウオリゴマーが多く含まれており、その分シード形成能が高い [5] 。
という報告があり、以前このブログでも取り上げました。
同じアルツハイマー病(Alzheimer's disease, AD) でも、進行の早い人と遅い人がいるのはなぜ? マサチューセッツ工科大学(MIT)/ハーバード大学のHymanらの研究グループは、進行の早い人ADと多い …
今回、アメリカ・ase Western Reserve大学のDr. Safarらの研究グループは、
「AD脳内にはいくつかのコンフォメーションのタウ凝集体が存在し、rpADとspADでその割合等が異なる」
という内容を報告しました [6] 。
進行の早いアルツハイマー病の脳内ではタウのコンフォメーションがちょっと違うかも
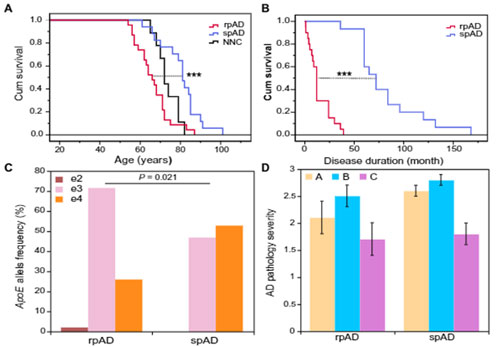
rpADとspADの臨床経過とApoEアイソタイプ
彼らは、
- rpAD: 発症から1年程度で死亡し、プリオン病としてプリオンセンターに送られ、病理でADだったことが判明した症例、n=23
- spAD: 通常経過(発症から7-10年で死亡)の症例、n=17
の2種類のAD症例群の臨床経過とApoEアイソタイプ、AD病理などを調べ、
- rpADは、spADよりも臨床経過が早い。
- rpADは、ApoE4のキャリア率が低く、ApoE2の症例も含まれる
- rpADとspADでAD病理に大きな違いはない
という事を示しました。
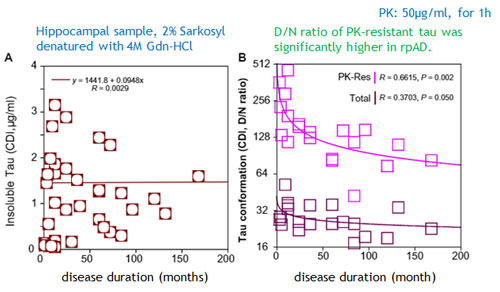
サルコシル不溶性&PK抵抗性タウの量と罹病期間が逆相関する
彼らはこれらのサンプルを、プリオン病研究などで確立している
- Conformation-Dependent Immunoassay, CDI
- Conformational Stability Assay, CSA
という2種類の間接的なアッセイ法で検証しました [7, 8] (Glossary参照)。
結果、サルコシル(2%)不溶性のタウ濃度(denature後)と罹病期間に相関はありませんでしたが、
予めProteinase K(PK, 50 µg/ml for 1 h)で処置した後のPK-resistantタウのD/N比 [7, 8] (Glossary参照) と罹病期間に負の相関を認め、
 ▲ CDI法(Daude N et al., Acta Neuropathol, 2020 [8] より、一部改変)
▲ CDI法(Daude N et al., Acta Neuropathol, 2020 [8] より、一部改変)「rpADのタウは、サルコシル不溶性&PK抵抗性タウの量が多い」
という可能性が示唆されました。
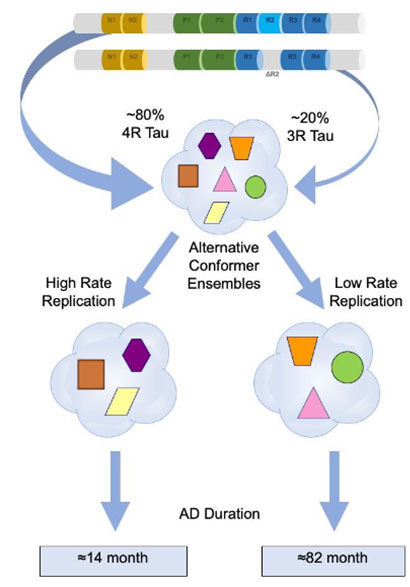
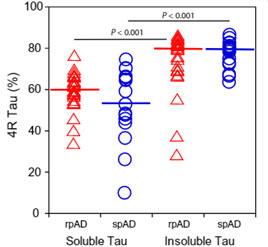
サルコシル可溶性と不溶性のタウのアイソタイプを見ると、
「サルコシル不溶性のタウは80%が4Rで構成されている」
という事がわかりました。
サンプル内には、コンフォメーションとサイズが違うタウ凝集体が含まれていそう
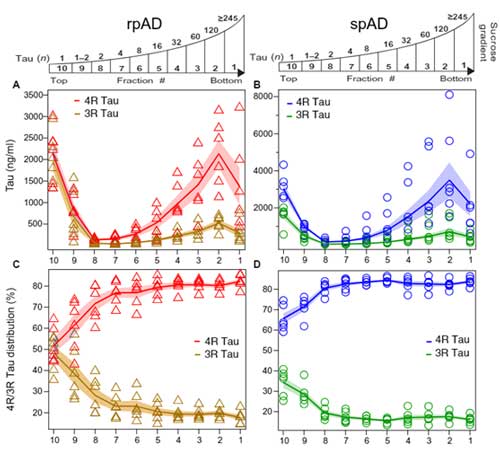
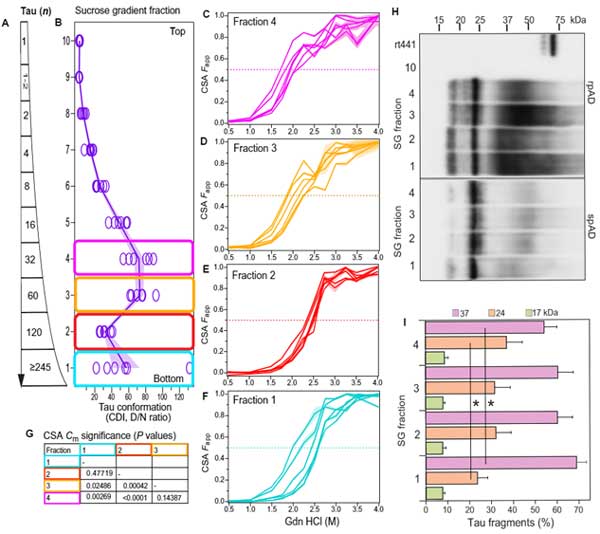
純粋にタウのサイズを見るため、彼らはスクロース勾配法で各分画のタウの構成を調べてみました。
その際、様々なサイズのリコンビナントタウ・オリゴマーも一緒に系にかけ、どのスクロース分画でどれくらいの大きさのタウが含まれるかも検証しました。
結果、rpAD、spADともに
「120merくらいのタウの割合が最も多く」、
また
「タウオリゴマーのサイズが大きくなればなるほど、4Rタウの割合が多くなる」
という結果が得られました。
ところが、同サンプルのD/N比を見ると、60merくらいのところにピークがきており、
「60merくらいのタウオリゴマーが最もミスフォールドしたタウが多い」
という事になります。
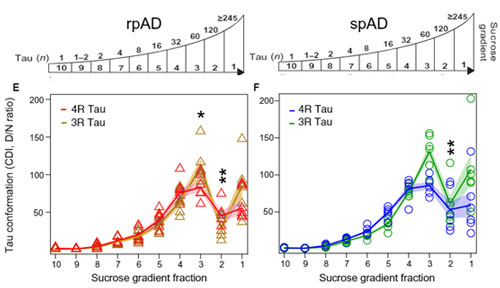
つまり、
「オリゴマータウの量自体は、120merくらいが多いけど、60merくらいのタウがよりミスフォールドしており、同じサンプル内で違う構造のタウが存在している」
という可能性が示唆されました。
PK抵抗性タウの方が凝集体が安定化している
次に彼らは、CSA法 [7, 8] (Glossary参照) で、サンプル内のミスフォールド・タウの安定化を調べました。
 ▲ CSA法(Daude N et al., Acta Neuropathol, 2020 [8] より)
▲ CSA法(Daude N et al., Acta Neuropathol, 2020 [8] より)全タウの 50% CSA Fapp はだいたい1.5-2.0Mくらいだったのに対し、PK抵抗性タウの 50% CSA Fapp は2.0-2.6Mとより高濃度の方にシフトしており、
「PK抵抗性タウの方が凝集体の安定性が高い」
という可能性が示唆されました。
逆にPK反応性タウ(全タウーPK抵抗性タウ)を見ると、50% CSA Fapp は1-2M とより低濃度を示しており、矛盾しない結果でした。
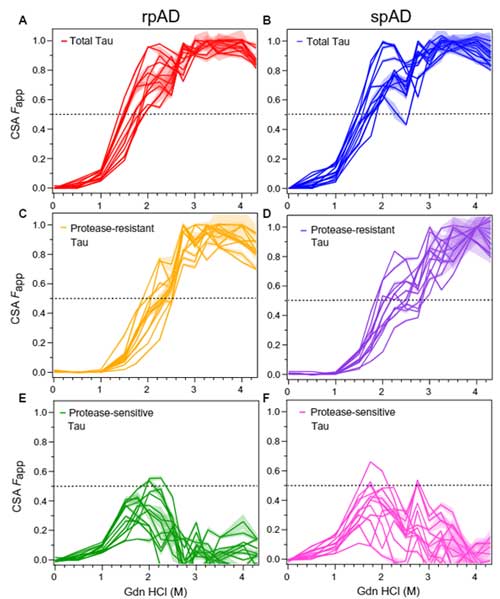
……この時点では、rpADとspADに明らかな違いはなさそうに見えます。
RT-QuiCでシード形成能を検証
次に彼らは、Real Time-Quaking Induced Conversion(RT-QuiC)で各サンプル内のタウのシード系性能を確認しました。
このRT-QuiCでは、4Rタウ(K18)と3Rタウ(K19)の2種類のタウモノマーを使って検証され、
「rpADサンプルの方が4Rタウを凝集させやすい」
という事がわかりました。
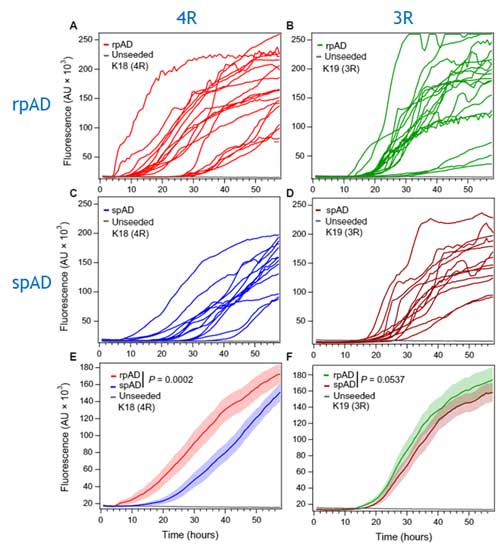
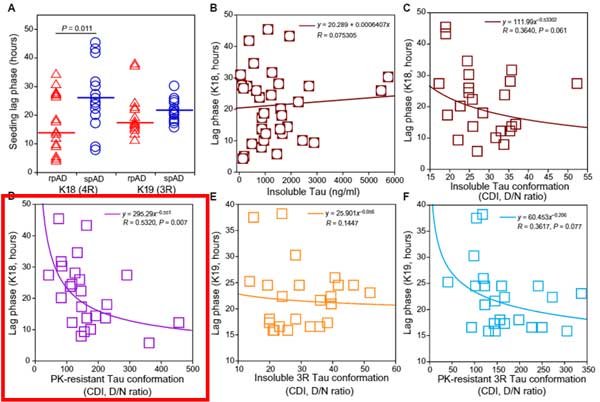
更にこのサンプルを詳しく解析したところ、PK抵抗性タウのD/N比とRT-QuiCのLag phaseに逆相関がみられ(3Rタウはギリギリ有意差なし)、
「PK抵抗性のミスフォールドしたタウが、4Rタウを凝集させるスピードが早い」
という事もわかりました。
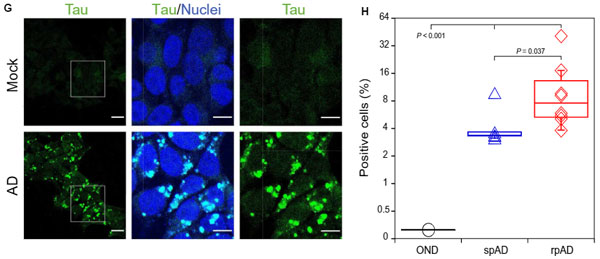
細胞系でも検証
同様に、シード形成能を、細胞系でも確認しました。
彼らが用いたのは、HEK293にP301LとV337Mの変異が入った4Rタウのリピートドメインを発現する細胞系で、
この細胞株にrpADとspADのサンプルを処置すると、両方とも細胞の内因性タウを凝集させましたが、その程度はrpADサンプルの方で多く、
「rpADタウの方が内因性タウを凝集させる能力が高い」
という可能性が示唆されました。
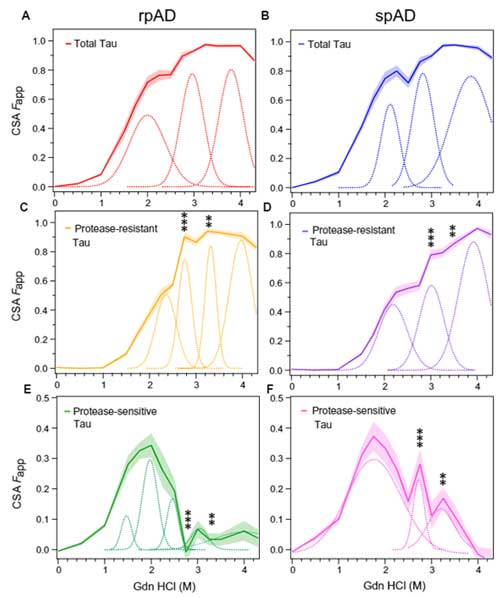
ADサンプル内には違うコンフォメーションのタウが複数含まれている
最期ほど、一見rpADとspADとで違いがなさそうにみえたCSAアッセイの結果……
よくよく見ると、いずれも綺麗なシグモイドカーブを描いておらず、
サンプルに安定性の異なる、複数のミスフォールド・タウが含まれている可能性が考えられました。

そこで彼らは、ガウスモデル(Gaussian model)を使って、それぞれのミスフォールド・タウのピークがいくつあるのか計算しました。
結果、rpADとspADには、それぞれ3種類の異なるピークが観察され、
またPK抵抗性タウで検証すると、rpADには4種類、spADには3種類の異なるピークが観察されました。
特に違いは、2.75Mと3.25M付近のピークで、この2つはrpADとspADで明確に差が現れました。
異なるサイズのタウオリゴマーは、凝集安定性etc.やその割合が異なる
最後に、再びスクロース勾配法で得られた高分子タウの4分画
- 画分4: 32mer
- 画分3: 60mer
- 画分2: 120mer
- 画分1: ≧245mer
でCSAを行うと、それぞれ異なる 50% CSA Fapp を示し、
「それぞれの分画のタウ凝集安定性が異なる」
可能性が示唆されました。
また、これらをトリプシンで軽く処理してウェスタンブロットにかけると、
- 24kDa
- ~37kDa
- ~13kDa
辺りにそれぞれバンドが確認されましたが、その割合は画分間で異なっており、やはり安定性に違いがある可能性が示唆されました。
・
・
・
以上の結果から、
ADサンプル内には複数の異なるミスフォールド・タウが含まれており、その割合やシード形成能はrpADとspADで異なる
可能性が考えられました。

Distinct populations of highly potent TAU seed conformers in rapidly progressing Alzheimer’s diseaseRapid replication in vitro implicates distinct populations of misfolded hippocampal 4R TAU protein in accelerated progression of Alzheimer’s disease.
My View
最近、cryo-EMなどで直接タウ凝集体のコンフォメーションを見にいく手法が流行っている中、今回の手法はかなり間接的な方法でコンフォメーションの違いを検証していました。
CDIとCSAの手法に関しては、プリオンの研究で1990年代に開発されており [7]、以降、Aβ [2] やシヌクレイン、TDP-43, FUS、P301Lタウ [8] の解析などにも応用されてきたようです [9] 。
rpADとspADとのタウのコンフォメーションの違いについては、Dr. Goedert のグループがcryo-EMで17症例のAD脳のタウを解析したことがあり、
この時は
「異なる臨床経過のADでも、中に含まれるタウ凝集体の構造は同じ」
という結果を報告していました [10]。
ただし、このcryo-EMの解析では、より高濃度のPKで処理しており、タウ凝集体のコア(主にR3-R4で構成)を見にいっています。
今回はよりマイルドなPKで処理しており、少なくともDA9がキャプチャーできるくらいにタウの構造が保たれいてる状態で解析しているので、
それくらい長いタウを観察すると、rpADとspADで異なるコンフォメーションのタウが含まれていそうだ、という事が言えるんじゃないかと思いました。
ただ、正直アッセイ法が間接的すぎるように思えるのと、ガウスモデルの計算法が複雑で理解するのを諦めてしまったので(これは私の力不足が原因ですが……)、
詳細まで理解して納得した、というわけではありません。
まず最初にひっかかったのが、
「より大きくて凝集能が安定なタウは80%が4Rタウで構成されている」
という結論を出しているところのアッセイ内容。
この分野では、多くの人達が
「ADタウは3Rタウと4Rタウが1:1の割合で構成されている」
というのが常識と考えていると思うので、ある意味驚きの結果だと思います。
そんな重要な結果にも拘らず、「4Rタウを直接見ていない」ところがひっかかります。
彼らは、全タウ(77G7抗体)の結果から3Rタウ(3RD)の結果を差し引いて4Rタウの結果として出しているので、
例えば「3RDでdetect出来なかった3Rタウも、全て4Rタウとしてカウントされている」可能性は否定できません。
80%が4Rタウというのであれば、やはり4RD抗体でも同じアッセイを行い、その上で3Rと4Rの比を見にいくべきだと思います。
他に気になった点としては、このアッセイ法で解析できるタウは、「DA9でキャプチャできるタウに限られる」ので、例えばDA9よりC末側で切れているタウなどは解析出来ないことになります。
PK処理によって、DA9前後もある程度切れると思うので、このアッセイ法で全てのタウを見られるわけではありません(とゆーか、PK処理後にこの部分が結構残っていた事の方が不思議……)
あと、
「細胞系でタウのシード形成能がrpADとspADで異なり、それはタウ濃度には依存しないが、PK抵抗性タウのD/N比と相関する」
という事を言っていますが、
私達のラボのこれまでの実験結果では、
「タウのシード形成能は、サンプルに含まれるリン酸化タウの量に相関し、この量で補正すると各サンプル間の差は殆どなくなる」
という事がわかっています。
なので、リン酸化タウで補正するとrpADとspADで差がなくなるんじゃないか、もしくは解析後に含まれるリン酸化タウ量をみると罹病期間となんらかの相関がでるんじゃないか、と思いました。
……と、いくつか気になる点はありますが、いずれにしても、ADという巨大な山に、色々な手法で様々な角度から挑んでいくのは大変重要なこと。
このように多様なアプローチ法で方々から解析を続ける事で、ADの多様性について今後も色々わかってくるんじゃないか、と思いました。
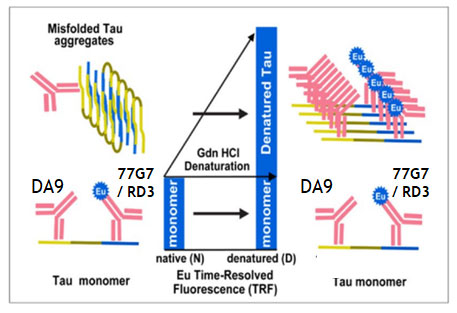
Glossary
Conformation-Dependent Immunoassay, CDI
プレートをN末タウ抗体(DA9)でコーティングし、その上にサンプルを乗せる。
その後、微小管結合領域(microtubule binding domain, MTBD)に結合する抗体
- 77G7: 4Rタウ/3Rタウ両方に結合
- RD3: 3Rタウのみに結合
にヨーロピウム(Europium, Eu)を結合させた抗体を処置してシグナル強度を検出する。
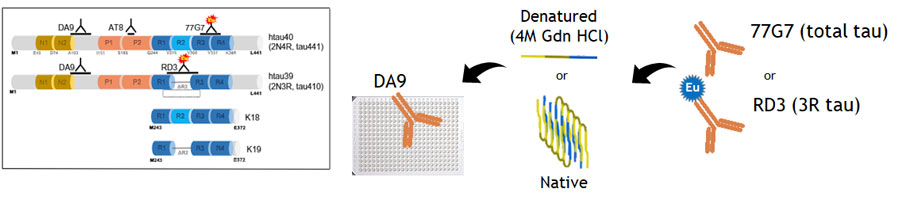
この時、タウがネイティブの状態だったらMTBDが開いているので、この系で検出できるが、
タウがフィブリル化して折りたたまれた状態(native)の場合、MTBDが折りたたみ構造の内部に位置するのでEu付き抗体がタウに結合できず、シグナルが得られない。
けれどもここでグアニジン塩酸塩(Guanidine hydrochloride,Gdn HCl, 4M)で処置(denature)すると、タウの構造が開き、MTBD抗体が結合してシグナルが得られる。
 ▲ Daude N et al., Acta Neuropathol, 2020 [8] より、一部改変
▲ Daude N et al., Acta Neuropathol, 2020 [8] より、一部改変この、Gdn HCl処置後と処置前のシグナル強度の比(denatured/native比, D/N比)を出すことで、サンプル内にどれだけの量のミスフォールド・タウが含まれているかを調べることができる。
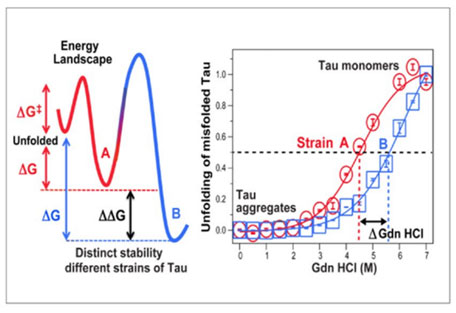
Conformational Stability Assay, CSA
CDIの応用版で、Gdn HClの濃度を0Mから4Mまで0.25M刻みで段階的に濃くしていき、其々のウェルにサンプルを乗せる。
同様にEuシグナルを検出して、シグモイドカーブを描く。
例えばStrain AとStrain Bという2種類の異なった構造のタウが含まれていた場合、
構造が比較的緩いと、より低濃度のGdn HClでタウが開き、シグナル強度が高くなる。
構造が安定していると、より高濃度のGdn HClが必要となり、シグモイドカーブが高濃度側にシフトする。
 ▲ Daude N et al., Acta Neuropathol, 2020 [8] より
▲ Daude N et al., Acta Neuropathol, 2020 [8] より半分のタウが開いた時のGdn HCl濃度(50% CSA Fapp)を比較することで、其々のタウの構造の安定性を比較することができる。
References
- Schmidt C, Wolff M, Weitz M, Bartlau T, Korth C, Zerr I. Rapidly progressive Alzheimer disease. Arch Neurol. 2011 Sep;68(9):1124-30. doi: 10.1001/archneurol.2011.189. PMID: 21911694.
- Cohen ML, Kim C, Haldiman T, ElHag M, Mehndiratta P, Pichet T, Lissemore F, Shea M, Cohen Y, Chen W, Blevins J, Appleby BS, Surewicz K, Surewicz WK, Sajatovic M, Tatsuoka C, Zhang S, Mayo P, Butkiewicz M, Haines JL, Lerner AJ, Safar JG. Rapidly progressive Alzheimer's disease features distinct structures of amyloid-β. Brain. 2015 Apr;138(Pt 4):1009-22. doi: 10.1093/brain/awv006. Epub 2015 Feb 15. PMID: 25688081; PMCID: PMC5014074.
- Drummond E, Nayak S, Faustin A, Pires G, Hickman RA, Askenazi M, Cohen M, Haldiman T, Kim C, Han X, Shao Y, Safar JG, Ueberheide B, Wisniewski T. Proteomic differences in amyloid plaques in rapidly progressive and sporadic Alzheimer's disease. Acta Neuropathol. 2017 Jun;133(6):933-954. doi: 10.1007/s00401-017-1691-0. Epub 2017 Mar 4. PMID: 28258398; PMCID: PMC5503748.
- Qiang W, Yau WM, Lu JX, Collinge J, Tycko R. Structural variation in amyloid-β fibrils from Alzheimer's disease clinical subtypes. Nature. 2017 Jan 12;541(7636):217-221. doi: 10.1038/nature20814. Epub 2017 Jan 4. PMID: 28052060; PMCID: PMC5233555.
- Dujardin S, Commins C, Lathuiliere A, Beerepoot P, Fernandes AR, Kamath TV, De Los Santos MB, Klickstein N, Corjuc DL, Corjuc BT, Dooley PM, Viode A, Oakley DH, Moore BD, Mullin K, Jean-Gilles D, Clark R, Atchison K, Moore R, Chibnik LB, Tanzi RE, Frosch MP, Serrano-Pozo A, Elwood F, Steen JA, Kennedy ME, Hyman BT. Tau molecular diversity contributes to clinical heterogeneity in Alzheimer's disease. Nat Med. 2020 Aug;26(8):1256-1263. doi: 10.1038/s41591-020-0938-9. Epub 2020 Jun 22. Erratum in: Nat Med. 2021 Feb;27(2):356. PMID: 32572268; PMCID: PMC7603860.
- Kim C, Haldiman T, Kang SG, Hromadkova L, Han ZZ, Chen W, Lissemore F, Lerner A, de Silva R, Cohen ML, Westaway D, Safar JG. Distinct populations of highly potent TAU seed conformers in rapidly progressing Alzheimer's disease. Sci Transl Med. 2022 Jan 5;14(626):eabg0253. doi: 10.1126/scitranslmed.abg0253. Epub 2022 Jan 5. PMID: 34985969.
- Safar J, Wille H, Itri V, Groth D, Serban H, Torchia M, Cohen FE, Prusiner SB. Eight prion strains have PrP(Sc) molecules with different conformations. Nat Med. 1998 Oct;4(10):1157-65. doi: 10.1038/2654. PMID: 9771749.
- Daude N, Kim C, Kang SG, Eskandari-Sedighi G, Haldiman T, Yang J, Fleck SC, Gomez-Cardona E, Han ZZ, Borrego-Ecija S, Wohlgemuth S, Julien O, Wille H, Molina-Porcel L, Gelpi E, Safar JG, Westaway D. Diverse, evolving conformer populations drive distinct phenotypes in frontotemporal lobar degeneration caused by the same MAPT-P301L mutation. Acta Neuropathol. 2020 Jun;139(6):1045-1070. doi: 10.1007/s00401-020-02148-4. Epub 2020 Mar 26. Erratum in: Acta Neuropathol. 2021 Mar;141(3):467-468. PMID: 32219515; PMCID: PMC7244472.
- Kovacs GG. Molecular pathology of neurodegenerative diseases: principles and practice. J Clin Pathol. 2019 Nov;72(11):725-735. doi: 10.1136/jclinpath-2019-205952. Epub 2019 Aug 8. PMID: 31395625.
- Falcon B, Zhang W, Schweighauser M, Murzin AG, Vidal R, Garringer HJ, Ghetti B, Scheres SHW, Goedert M. Tau filaments from multiple cases of sporadic and inherited Alzheimer's disease adopt a common fold. Acta Neuropathol. 2018 Nov;136(5):699-708. doi: 10.1007/s00401-018-1914-z. Epub 2018 Oct 1. PMID: 30276465; PMCID: PMC6208733.