アミロイドβ (Amyloid beta, Aβ) の抗体療法は、アルツハイマー病 (Alzheimer's disease, AD) の治療として最も期待がかかっている治療法の一つですが、
治験の結果は、マウスの実験結果ほど手応えがない……というのが現状です。
マウスとヒトとで脳内環境が異なる、というのがその答えになるとは思いますが、
では具体的にどこを改善したら、ヒトでもAβ抗体療法の効果が上がるのでしょうか?
今回、アメリカ・ヴァージニア大学の Dr. Mesqulta, Dr. Klpnls らの研究グループは、
髄膜リンパ管の機能障害に注目し、マウスで髄膜リンパ管を障害させると、Aβ抗体療法の効果が下がる、ということを報告しました [1]。

髄膜リンパ管の機能障害は、Aβ除去作用を妨げる
彼らはまず、家族性ADの原因遺伝子変異5種類をトランスジェニックしたマウス 5XFAD の若齢での髄膜リンパ管を調べ、そんなに障害されていないことを確認しました。
そのマウスに、
- アデュカヌマブ
- BAN2401
のマウス用キメラ抗体
- mAducanumab
- mAb158
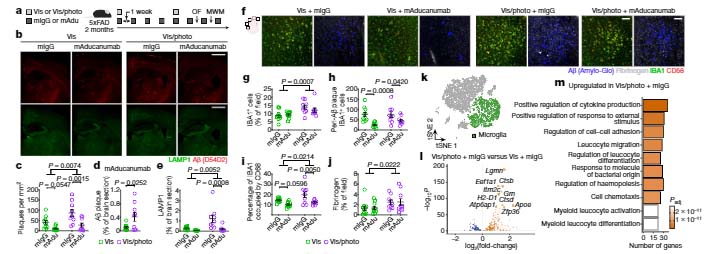
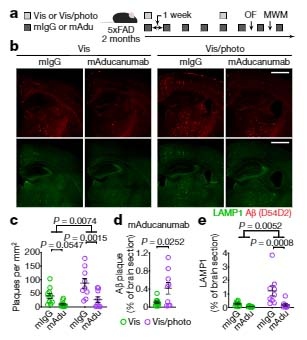
を投与し、Aβ除去作用を比較したところ、結果、mAducanumab, mAb158 ともに 5XFAD マウスのプラークを減少させました。
ところが、この 5XFAD マウスの髄液中に photoconversion した Visudyne を投与し [2, 3]、髄膜リンパ管障害を起こした状態で両抗体を投与すると、
抗体のAβ除去作用が落ち、多くの炎症反応が起こっていました。
これらのマウスでは、不安障害や認知機能低下が起こっており、Aβ抗体療法には、髄膜リンパ管を健全に保つ事が重要だと考えられました。
Aβ抗体療法により、Aβは髄膜リンパ管によるドレナージシステムを通って体外に排出させていると予測されましたが、
具体的にどのような細胞がこの機能に関わっているのか調べるため、彼らはこのマウスの single-cell RNA sequenceing (scRNA-sequ) を行いました。
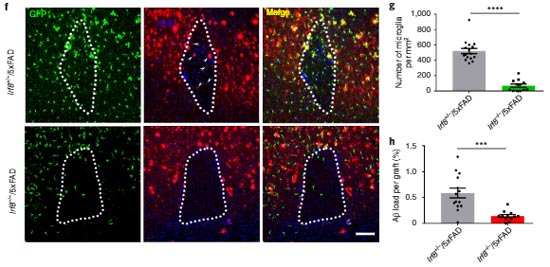
結果、髄膜リンパ管を障害されたマウスでは、ミクログリア、壁細胞、内皮細胞などのプロファイルが大きく変化している事がわかりました。
髄膜リンパ管障害マウスでは、ホメオスタティックなミクログリアが減り、細胞傷害性の disease associated microglia (DAM) が増えていました。
また、動脈・静脈に関わらず内皮細胞の分化・増殖のマーカーが上昇しており、毛細血管内皮細胞では白血球遊走に関わるサイトカイン系の発現上昇を認めました。
これらの結果から、髄膜リンパ管障害の状態でAβ抗体療法を行うと、一時的な脳内アミロイド量の急騰によって、ミクログリアが細胞傷害性に変化し、血管障害や白血球の浸出などが起こると考えられました。
VEGF-C を投与すれば、Aβ抗体療法の効果を上げることができる
実際の患者さんたちで、Aβ抗体療法の効果を上げるためにはどうしたらよいでしょうか?
その答えを探るため、彼らは リンパ管障害マウスに mAb158 を投与する際、内皮細胞成長因子(mVEGF-C)をウイルスベクターにいれて投与しました。
すると、Aβ除去作用は、シナジー効果的にあがっており、Aβ周囲のミクログリアの数や、細胞障害性ミクログリアの数が減少、認知機能も改善しました。
26-30ヶ月齢の老齢APPSweマウスに mAducanumab と mVEGF-C の同時投与をおこなうと、同様にAβプラーク除去効果が上がり、ニューロンのシナプス機能やトランスミッターの機能改善を示唆する結果が得られました。
AD脳でも同様の事が起こっていそう
実際に、ADの患者さん脳内で同様の病態が起こっているかどうか、AD脳のデータと照合しました。
結果、5XFADマウスの
- 髄膜リンパ管細胞
- 脳血管内皮細胞
- ミクログリア
の上位10個の遺伝子発現プロファイルとAD脳の遺伝子プロファイルに強い相関を認め、
髄膜リンパ管細胞の遺伝子プロファイルの変化は 脳脊髄液(cerebrospinal fluid, CSF)中のAβ42量と相関がありました。
さらに髄膜リンパ管障害を起こした 5XFAD マウスのミクログリアのプロファイルとAD脳のミクログリアのプロファイルにも強い相関があり、
AD脳でも
- 髄膜リンパ管障害
- 血管障害
- 異常ミクログリアの活性化
などが起こっている可能性が考えられました。
Meningeal lymphatic drainage can affect the microglial inflammatory response and anti-amyloid-β immunotherapy in mouse models of Alzheimer’s disease.
My View
脳内に髄膜リンパ管があると "再発見" されてから [4, 5, 6]、髄膜リンパ管からのドレナージの重要性を示す論文が次々に報告されています。
長らく、脳にはリンパ管が存在しないと言われていましたが、 1987年、脳の表層にある髄膜には「リンパ管がある」と報告されていました [1]。 その後この発見はしばらく歴史に埋もれていましたが、 40年程経った2013年以 …
髄膜リンパ管障害が Aβ クリアランスを低下させ、AD の病態を悪くすることは報告されていましたが [7, 8, 9]、
今回の研究は、髄膜リンパ管障害がミクログリアや血管障害に繋がり、Aβ抗体療法の効果を相殺してしまう、という内容でした。
ただ……非常に膨大なデータだと思うのですが、
「髄膜リンパ管障害 → ミクログリアや血管障害」のストーリーをほぼ遺伝子のプロファイル変化だけで見ているところがちょっと引っかかりました。
また、AD患者さんの研究でも、ほぼほぼ遺伝子プロファイルでの相関を見ているだけなので、ここの論文で主張されている変化が実際のAD患者さん脳内でも起こっているかどうか、結論づけるのはちょっと早いかなーと思いました。
でも、このストーリーが本当だとして、「VGEFの同時投与でAβ抗体療法の効果UP」というストーリーは期待したいところです。
マウスの実験では AAVベクターで強制発現しているので、すぐにヒトに応用とはいかなさそうですが、何かしらヒントになるのではないかと思いました。
……といっても、具体的にどうすればいいのかちょっと思いつかないので、いいアイデアがあったら誰か教えて下さい。
References
- Da Mesquita S, Papadopoulos Z, Dykstra T, Brase L, Farias FG, Wall M, Jiang H, Kodira CD, de Lima KA, Herz J, Louveau A, Goldman DH, Salvador AF, Onengut-Gumuscu S, Farber E, Dabhi N, Kennedy T, Milam MG, Baker W, Smirnov I, Rich SS; Dominantly Inherited Alzheimer Network, Benitez BA, Karch CM, Perrin RJ, Farlow M, Chhatwal JP, Holtzman DM, Cruchaga C, Harari O, Kipnis J. Meningeal lymphatics affect microglia responses and anti-Aβ immunotherapy. Nature. 2021 Apr 28. doi: 10.1038/s41586-021-03489-0. Epub ahead of print. PMID: 33911285.
- Da Mesquita S, Louveau A, Vaccari A, Smirnov I, Cornelison RC, Kingsmore KM, Contarino C, Onengut-Gumuscu S, Farber E, Raper D, Viar KE, Powell RD, Baker W, Dabhi N, Bai R, Cao R, Hu S, Rich SS, Munson JM, Lopes MB, Overall CC, Acton ST, Kipnis J. Functional aspects of meningeal lymphatics in ageing and Alzheimer's disease. Nature. 2018 Aug;560(7717):185-191. doi: 10.1038/s41586-018-0368-8. Epub 2018 Jul 25. Erratum in: Nature. 2018 Nov 5;: PMID: 30046111; PMCID: PMC6085146.
- Louveau A, Herz J, Alme MN, Salvador AF, Dong MQ, Viar KE, Herod SG, Knopp J, Setliff JC, Lupi AL, Da Mesquita S, Frost EL, Gaultier A, Harris TH, Cao R, Hu S, Lukens JR, Smirnov I, Overall CC, Oliver G, Kipnis J. CNS lymphatic drainage and neuroinflammation are regulated by meningeal lymphatic vasculature. Nat Neurosci. 2018 Oct;21(10):1380-1391. doi: 10.1038/s41593-018-0227-9. Epub 2018 Sep 17. PMID: 30224810; PMCID: PMC6214619.
- Aleksanteri Aspelund, Salli Antila, Steven T. Proulx, Tine Veronica Karlsen, Sinem Karaman, Michael Detmar, Helge Wiig, Kari Alitalo; A dural lymphatic vascular system that drains brain interstitial fluid and macromolecules. J Exp Med 29 June 2015; 212 (7): 991–999. doi: https://doi.org/10.1084/jem.20142290
- Louveau, A., Smirnov, I., Keyes, T. et al. Structural and functional features of central nervous system lymphatic vessels. Nature 523, 337–341 (2015). https://doi.org/10.1038/nature14432
- Martina Absinta, Seung-Kwon Ha, Govind Nair, Pascal Sati, Nicholas J Luciano, Maryknoll Palisoc, Antoine Louveau, Kareem A Zaghloul, Stefania Pittaluga, Jonathan Kipnis, Daniel S Reich. Human and nonhuman primate meninges harbor lymphatic vessels that can be visualized noninvasively by MRI. eLife 2017;6:e29738 DOI: 10.7554/eLife.29738
- Da Mesquita, S., Louveau, A., Vaccari, A. et al. Functional aspects of meningeal lymphatics in ageing and Alzheimer’s disease. Nature 560, 185–191 (2018). https://doi.org/10.1038/s41586-018-0368-8
- Mentis, AF.A., Dardiotis, E. & Chrousos, G.P. Apolipoprotein E4 and meningeal lymphatics in Alzheimer disease: a conceptual framework. Mol Psychiatry (2020). https://doi.org/10.1038/s41380-020-0731-7
- Stower, H. Meningeal lymphatics in aging and Alzheimer’s disease. Nat Med 24, 1781 (2018). https://doi.org/10.1038/s41591-018-0281-6
- Ding, XB., Wang, XX., Xia, DH. et al. Impaired meningeal lymphatic drainage in patients with idiopathic Parkinson’s disease. Nat Med (2021). https://doi-org.proxy.library.upenn.edu/10.1038/s41591-020-01198-1