今回は、前頭側頭葉変性症(Frontotemporal lobar degeneration, FTLD)の約半数を占める
「TDP43凝集体を伴うFTLD(FTLD-TDP)」
…に深く関与する、
ProgranulinとTMEM106bについてのお話。
研究の背景
Progranulin
Progranulin(PGRN)は成長因子の一種であり、
細胞増殖、腫瘍形成、創傷治癒、発達、炎症etc. 多くのプロセスに関与します [1]。
このタンパクをコードする遺伝子GRNのハプロタイプ不全は、
FTLD-TDPの原因遺伝子として知られています [2]。
PGRN機能不全がFTLD-TDP発症に関与するメカニズムに関しては色々調べられていますが、
リソソーム系の異常説が有力視されています。
TMEM106b
TMEM106bは、FTLD-TDPのリスク因子として同定され [3]、
GRN変異を持つFTLD(FTLD-GRN)の調整因子として注目されています。
FTLD-GRNの発症率を上げるTMEM106bのハプロタイプでは、TMEM106bのタンパクレベルが増加していることから、
TMEM106b発現量低下が治療ターゲットの一つとして考える人もいます。
TMEM106bのハプロタイプは、limbic-predominant age-related TDP-43 encephalopathy (LATE) や 海馬硬化(Hippocampal sclerosis, HS)のリスク因子としても知られており [4]、
PGRNと独立してTDP43病理に関与する機序もあるように思っています。
TMEM106bノックアウトマウスの最初の報告は
gene-trap法でTMEM106bの転写を阻害したマウスの解析で、
グリオーシスと軽度のリソソーム機能変化を示すくらいの、軽いフェノタイプ、という報告でした [5, 6]。
ところが、今年、ドイツのDr. Dammeらの研究グループが
- Cre-loxPシステム
- CRISPER
の二種類の異なる手法でTMEM106bノックアウトマウスを作製し、
これらのマウスでは、強いリソソーム機能障害と運動機能障害をきたす事を報告しました [7]。
彼らの見解によると、gene-trap法だとTMEM106bを完全にノックアウトできず、TMEM106bが少しだけ発現していたためにフェノタイプが軽かったのではないかということです。
PGRNとTMEM106bの関係
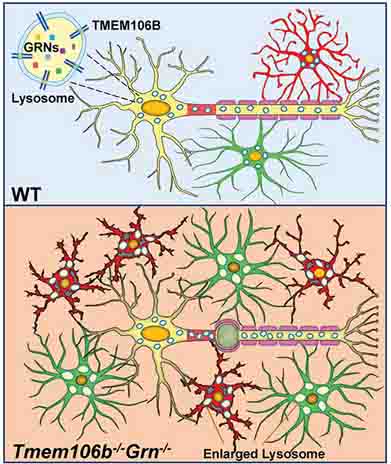
TMEM106bとPGRNは両者ともリソソームに多く存在しており、
TMEM106bは、PGRNの発現調節もしくは共同作業によってFTLD-GRN発症に関与しているのではないかと考えられているようです。
などの結果から、TMEM106bとPGRNの発現量のバランスがリソソーム系の障害、そしてFTLD-GRN発症の鍵となっているのではないか、と考えられています。
このことから、
「TMEM106bの発現を抑えると、Grn-/-マウスのフェノタイプが改善するのでは?」
と考え、
以前、エール大学のDr. Strittmatterらの研究グループは
先に紹介したgene-trap法でTMEM106bの転写を阻害したTMEM106bノックアウトマウスとGrnノックアウトマウスを交配して、
Grn -/-のフェノタイプがTMEM106b-/-で改善した、
という事を報告していました [6]。
しかしながら、彼らは、4ヶ月の若齢マウスしか解析していないので、
「老齢になっても同じ結果なの?」
という疑問が湧いてきます。
また、先に紹介したように、gene-trap法ではTMEM106bを完全にノックアウトできていない可能性があるので、
「完全にTMEM106bをノックアウトしたら、GRNノックアウトマウスのフェノタイプはどうなるのか?」
と、いう疑問も湧き上がると思います。
これら疑問に答えるように、
3つの異なる研究グループがそれぞれTMEM106bとGRNをダブルノックアウトしたマウスを解析し、それぞれEMBO reportsに報告しました。
と、かなり前置きが長くなりましたが、
要は、
「結局、TMEM106bとGRNを両方ノックアウトするとどうなるの?」
というお話。
論文3報の紹介
From アメリカ・メイヨークリニック
まずは、アメリカ・メイヨークリニックのDr. Zhou、Dr. Dickson、Dr. Rademakersらの研究グループから [10]。
(概要)
彼らがまず最初に使ったマウスは、Dr. Strittmatterらのグループと同じ、
gene-trap法で、LacZレポーター遺伝子をTMEM106bのイントロン4に挿入し、転写を阻害したマウスライン、Tmem106b-/-(EPD0047_1_E02)。
このラインとGrn-/-とを交配し、Tmem106b-/-:Grn-/- マウスを作製した。
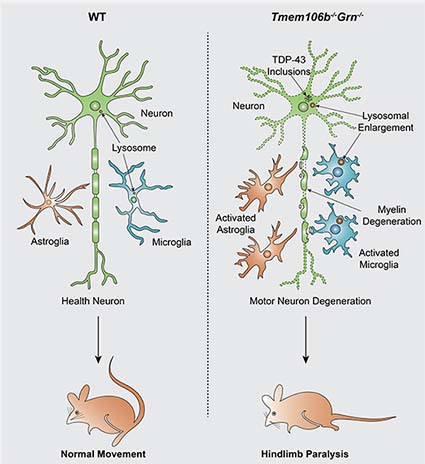
結果、Dr. Strittmatterらの結果と逆に、6–8ヶ月齢で運動機能障害が出現し、
11ヶ月齢で完全な四肢麻痺となり、死亡し始めた。
このマウスを解析すると、LacZにTmem106bのN末がくっついたタンパクが発現しており、さらに5-10%の全長Tmem106bが発現していた。
これが四肢麻痺→死亡と関連があるかどうか調べるため、
彼らはCRISPRシステムを使ってTmem106b-/-マウスを作製し、Tmem106bを完全に欠損させた。
結果、4.5ヶ月齢で運動機能障害が出現し、7ヶ月齢で死亡し始めた。
この結果から、gene-trap法のTmem106b-/-マウスはフェノタイプの出現が数ヶ月遅くなるだけだと判断した。
gene-trap法のTmem106b-/-マウス(11-12ヶ月齢)を解析すると、
- 脊髄の運動神経核の脱落
- 脊髄のミエリンの障害
- 脊髄のグリオーシス(ミクログリア、アストロサイト)
- 脳幹の神経細胞(Soma & neuropil)にp-TDP43凝集体(細胞脱落は脊髄のみ)
- 脊髄のリソソーム機能障害
- 脊髄にユビキチン+封入体(でもp-TDP43は陰性)
を認め、
老齢のTmem106b-/-:Grn-/- マウスでは、
脳幹のp-TDP43凝集体と、脊髄のリソソーム機能障害、神経細胞脱落、グリオーシスを認め、
1年程度で四肢麻痺→死亡してしまう
ということが判明した。
From アメリカ・コーネル大学
続いて、アメリカ・コーネル大学のDr. Huらの研究グループから [11]。
(概要)
彼らは、CRISPR/Cas9システムでTmem106b-/-マウスを作製した。
このマウスは、リソソームのトラフィッキングの障害をきたしており、TMEM106bが運動神経のリソソーム機能維持に重要であることを示唆していた。
次に、このTmem106-/-マウスとGrn-/-マウスを交配し、ダブルノックアウトマウス(Tmem106b-/-;Grn-/-)を作製した。
このマウスは、3.5ヶ月齢から進行性の運動機能障害をきたし、
5.5ヶ月齢でサクリファイスしなければならなくなった。
Tmem106b+/-;Grn-/-, Tmem106b-/-:Grn+/-マウスは、両者とも16ヶ月齢まで大きな運動機能障害や失調をきたさなかった。
Tmem106b-/-;Grn-/-マウスは、
- 脊髄の神経細胞脱落
- 脊髄のグリオーシス
- 小脳のグリオーシス
- 網膜の神経変性とグリオーシス
- 神経炎症、リポフスチンの沈着、オートファジー-リソソーム系の障害
- 脊髄のRIPA不溶性p-TDP43、p62, ユビキチンタンパクの増加
などを認めた。
From ドイツ・Ludwig-Maximillans大学BMC
最後は、ドイツ・Ludwig-Maximillans大学BMCのDr. Haass, Dr. Capellらの研究グループから [12]。
(概要)
彼らは、CRISPR/Cas9システムで作製したTmem106b-/-マウスとGrn-/-マウスを交配し、Tmem106b-/-;Grn-/-マウスを作製した。
Tmem106b-/-;Grn-/-マウスは、3ヶ月齢で運動機能障害をきたし、
- オートファジー関連遺伝子とミクログリア関連遺伝子の発現調節障害
- ミエリンの減少
- 脳内のミクログリオーシスとアストログリオーシス
- リソソームとオートファジーの機能障害
- 脳内(皮質、支障、小脳、中脳、延髄)の神経細胞体にp-TDP43の凝集体
を認めた。
My View
と、ゆー事で、
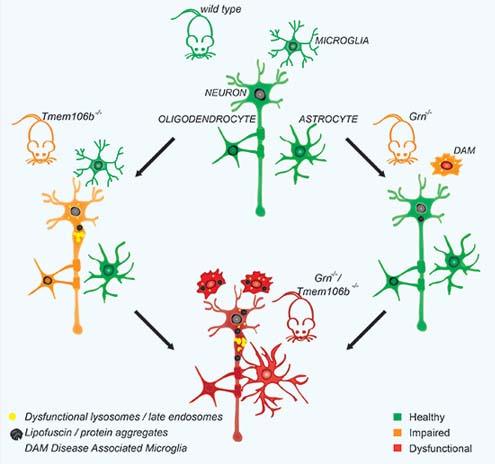
スタディー間で多少の違いはあるものの、
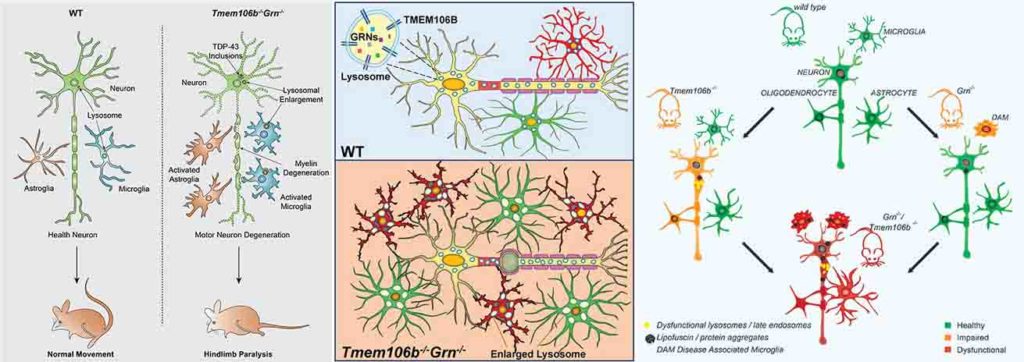
TMEM106bとGRNのダブルノックアウトマウスは、
いずれも
- リソソーム系の障害
- 神経細胞障害とグリオーシス
- 運動機能障害
をきたす、という結果だった様子。
つまりは、
「単純にTMEM106bを無くせばFTLD-GRNがよくなる…というわけではない」
という事だと思います。
ただ、気をつけておくべきは、
「これらのマウスは、ヒトのFTLD-GRNを完全に反映しているわけではない」
という事。
ヒトの場合、
- GRN変異のFTLDの患者さんでは、GRNの発現量は半減しているだけだし、
- TMEM106Bのリスク多型では、TMEM106bの発現量はほんのちょっと上がっているだけ。
という感じで、両者とも完全にノックアウトされているわけではないので…
いずれのスタディーも、ヘテロ欠損マウスでは明らかな異常がみられておらず、
ヒトのFTLD-GRN病理メカニズムを理解するために必要なことは、
まだまだありそうな…気がします。
References
- Chitramuthu BP, Bennett HPJ, Bateman A. Progranulin: a new avenue towards the understanding and treatment of neurodegenerative disease. Brain. 2017 Dec 1;140(12):3081-3104. doi: 10.1093/brain/awx198. PMID:29053785.
- Rademakers, R., Neumann, M. & Mackenzie, I. Advances in understanding the molecular basis of frontotemporal dementia. Nat Rev Neurol 8, 423–434 (2012). https://doi.org/10.1038/nrneurol.2012.117
- Van Deerlin VM, Sleiman PM, Martinez-Lage M, Chen-Plotkin A, Wang LS, Graff-Radford NR, Dickson DW, Rademakers R, Boeve BF, Grossman M, Arnold SE, Mann DM, Pickering-Brown SM, Seelaar H, Heutink P, van Swieten JC, Murrell JR, Ghetti B, Spina S, Grafman J, Hodges J, Spillantini MG, Gilman S, Lieberman AP, Kaye JA, Woltjer RL, Bigio EH, Mesulam M, Al-Sarraj S, Troakes C, Rosenberg RN, White CL 3rd, Ferrer I, Lladó A, Neumann M, Kretzschmar HA, Hulette CM, Welsh-Bohmer KA, Miller BL, Alzualde A, Lopez de Munain A, McKee AC, Gearing M, Levey AI, Lah JJ, Hardy J, Rohrer JD, Lashley T, Mackenzie IR, Feldman HH, Hamilton RL, Dekosky ST, van der Zee J, Kumar-Singh S, Van Broeckhoven C, Mayeux R, Vonsattel JP, Troncoso JC, Kril JJ, Kwok JB, Halliday GM, Bird TD, Ince PG, Shaw PJ, Cairns NJ, Morris JC, McLean CA, DeCarli C, Ellis WG, Freeman SH, Frosch MP, Growdon JH, Perl DP, Sano M, Bennett DA, Schneider JA, Beach TG, Reiman EM, Woodruff BK, Cummings J, Vinters HV, Miller CA, Chui HC, Alafuzoff I, Hartikainen P, Seilhean D, Galasko D, Masliah E, Cotman CW, Tuñón MT, Martínez MC, Munoz DG, Carroll SL, Marson D, Riederer PF, Bogdanovic N, Schellenberg GD, Hakonarson H, Trojanowski JQ, Lee VM. Common variants at 7p21 are associated with frontotemporal lobar degeneration with TDP-43 inclusions. Nat Genet. 2010 Mar;42(3):234-9. doi: 10.1038/ng.536. Epub 2010 Feb 14. PMID:20154673; PMCID: PMC2828525.
- Nelson PT, Dickson DW, Trojanowski JQ, Jack CR, Boyle PA, Arfanakis K, Rademakers R, Alafuzoff I, Attems J, Brayne C, Coyle-Gilchrist ITS, Chui HC, Fardo DW, Flanagan ME, Halliday G, Hokkanen SRK, Hunter S, Jicha GA, Katsumata Y, Kawas CH, Keene CD, Kovacs GG, Kukull WA, Levey AI, Makkinejad N, Montine TJ, Murayama S, Murray ME, Nag S, Rissman RA, Seeley WW, Sperling RA, White Iii CL, Yu L, Schneider JA. Limbic-predominant age-related TDP-43 encephalopathy (LATE): consensus working group report. Brain. 2019 Jun 1;142(6):1503-1527. doi: 10.1093/brain/awz099. Erratum in: Brain. 2019 Jul 1;142(7):e37. PMID:31039256; PMCID: PMC6536849.
- Nicholson AM, Zhou X, Perkerson RB, Parsons TM, Chew J, Brooks M, DeJesus-Hernandez M, Finch NA, Matchett BJ, Kurti A, Jansen-West KR, Perkerson E, Daughrity L, Castanedes-Casey M, Rousseau L, Phillips V, Hu F, Gendron TF, Murray ME, Dickson DW, Fryer JD, Petrucelli L, Rademakers R. Loss of Tmem106b is unable to ameliorate frontotemporal dementia-like phenotypes in an AAV mouse model of C9ORF72-repeat induced toxicity. Acta Neuropathol Commun. 2018 May 31;6(1):42. doi: 10.1186/s40478-018-0545-x. PMID:29855382; PMCID: PMC5984311.
- Klein ZA, Takahashi H, Ma M, Stagi M, Zhou M, Lam TT, Strittmatter SM. Loss of TMEM106B Ameliorates Lysosomal and Frontotemporal Dementia-Related Phenotypes in Progranulin-Deficient Mice. Neuron. 2017 Jul 19;95(2):281-296.e6. doi: 10.1016/j.neuron.2017.06.026. PMID:28728022; PMCID: PMC5558861.
- Lüningschrör P, Werner G, Stroobants S, Kakuta S, Dombert B, Sinske D, Wanner R, Lüllmann-Rauch R, Wefers B, Wurst W, D'Hooge R, Uchiyama Y, Sendtner M, Haass C, Saftig P, Knöll B, Capell A, Damme M. The FTLD Risk Factor TMEM106B Regulates the Transport of Lysosomes at the Axon Initial Segment of Motoneurons. Cell Rep. 2020 Mar 10;30(10):3506-3519.e6. doi: 10.1016/j.celrep.2020.02.060. PMID:32160553.
- Zhou X, Sun L, Brady OA, Murphy KA, Hu F. Elevated TMEM106B levels exaggerate lipofuscin accumulation and lysosomal dysfunction in aged mice with progranulin deficiency. Acta Neuropathol Commun. 2017;5(1):9. Published 2017 Jan 26. doi: 10.1186/s40478-017-0412-1
- Gallagher MD, Posavi M, Huang P, Unger TL, Berlyand Y, Gruenewald AL, Chesi A, Manduchi E, Wells AD, Grant SFA, Blobel GA, Brown CD, Chen-Plotkin AS. A Dementia-Associated Risk Variant near TMEM106B Alters Chromatin Architecture and Gene Expression. Am J Hum Genet. 2017 Nov 2;101(5):643-663. doi: 10.1016/j.ajhg.2017.09.004. Epub 2017 Oct 19. PMID:29056226; PMCID: PMC5673619.
- Zhou X, Brooks M, Jiang P, Koga S, Zuberi AR, Baker MC, Parsons TM, Castanedes-Casey M, Phillips V, Librero AL, Kurti A, Fryer JD, Bu G, Lutz C, Dickson DW, Rademakers R. Loss of Tmem106b exacerbates FTLD pathologies and causes motor deficits in progranulin-deficient mice. EMBO Rep. 2020 Aug 5;21(10):e50197. doi: 10.15252/embr.202050197. Epub ahead of print. PMID:32761777; PMCID: PMC7534638.
- Feng T, Mai S, Roscoe JM, Sheng RR, Ullah M, Zhang J, Katz II, Yu H, Xiong W, Hu F. Loss of TMEM106B and PGRN leads to severe lysosomal abnormalities and neurodegeneration in mice. EMBO Rep. 2020 Aug 10;21(10):e50219. doi: 10.15252/embr.202050219. Epub ahead of print. PMID:32852886; PMCID: PMC7534636.
- Werner G, Damme M, Schludi M, Gnörich J, Wind K, Fellerer K, Wefers B, Wurst W, Edbauer D, Brendel M, Haass C, Capell A. Loss of TMEM106B potentiates lysosomal and FTLD-like pathology in progranulin-deficient mice. EMBO Rep. 2020 Sep 14;21(10):e50241. doi: 10.15252/embr.202050241. Epub ahead of print. PMID:32929860; PMCID: PMC7534633.