神経炎症は、アルツハイマー病(Alzheimer's disease, AD)を含む多くの神経変性疾患で認める初見で、病態との関連も多く報告されています。
アルツハイマー病(Alzheimer's disease, AD)の病理学的特徴としては、 アミロイドβ(Amyloid beta, Aβ)や過リン酸化タウの蓄積、炎症、神経細胞脱落etc.が挙げられますが、 Aβ/タウ …
アルツハイマー病(Alzheimer's disease, AD)の代表的な病理といえば、 アミロイドβ(Amyloid beta, Aβ) タウ 神経炎症 血管病変 神経障害 などが挙げられるかと思います。 これらの変 …
炎症を語る上で外せない細胞の1つがミクログリアですが、そのミクログリアの活動を調整する因子の1つに TAM受容体ファミリーがあります (Glossary参照) [1, 2] 。
TAM受容体は
- TYRO3
- AXL
- MER
の3種類があり、それぞれN末で切断されて
- sTYRO3
- sAXL
- sMER
として細胞外に放出され、血漿中などでも確認されます。
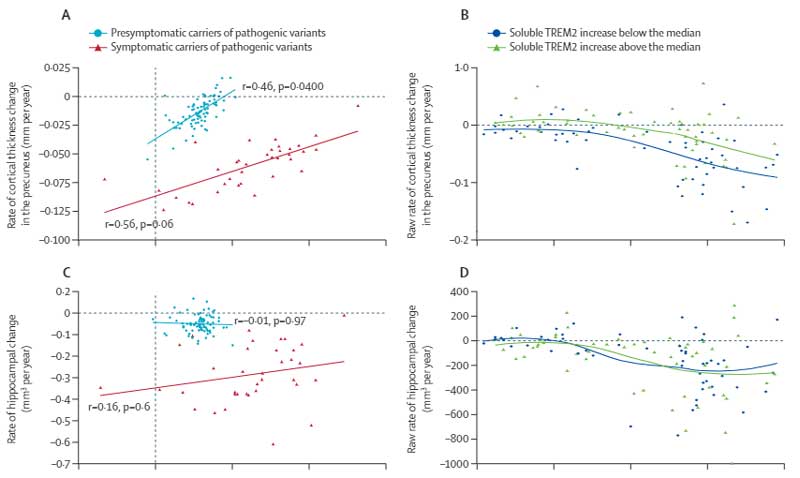
今回、ドイツ・神経変性疾患研究センター(DZNE)の Dr. Heneka が主導する、DELCODEスタディグループのメンバー達は、様々な髄液マーカーを測定し、TMAファミリーの sAXL と sTyro3 が、脳萎縮のステージや認知機能の経時的変化と相関があることを報告しました [3] 。
髄液中の可溶性TAM受容体(sAXLとsTyro3)はアルツハイマー病のバイオマーカーになり得るか

彼らは、ドイツの DELCODE スタディ(n=309)参加者
- Subjective cognitive decline (SCD)
- mild cognitive impairment (MCI)
- dementia of the Alzheimer's type (DAT)
- first-degree relatives of DAT subjects and healthy controls (HC)
の髄液から、様々なマーカーを調べました。
その結果、
- sAXL
- sThyro3
の2つの蛋白が、髄液中のADマーカーと相関があり、特に髄液中タウの量が多い人ほどこれら2つの蛋白レベルが上がっていました。
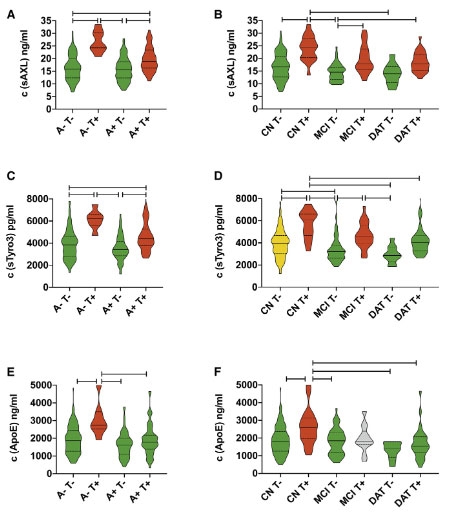
これら2つの蛋白は、非線形解析で
- CSF中 Aβ42/Aβ40比
- CSF中 p-tau-181
と相関があり、
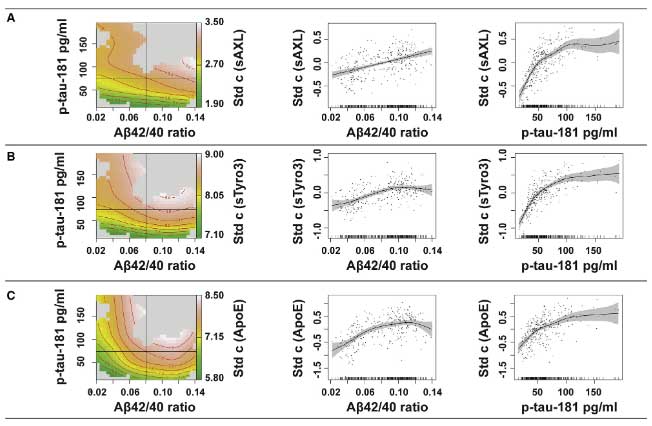
また、Braak Stage になぞらえた脳萎縮の進行分布の程度とも相関していました。
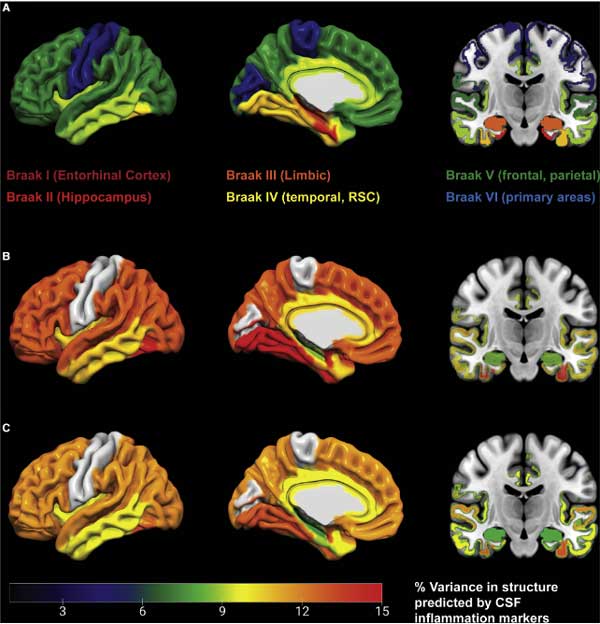
さらに、サンプルをそれぞれ
- sAXL
- sAXLが高い群
- sAXLが低い群
- sTyro3
- sTyro3が高い群
- sTyro3が低い群
に分けて、5年間の認知機能低下の程度を比較すると、
sAXL, sTyro3が低い群で5年間の認知機能低下が強い傾向にあり、
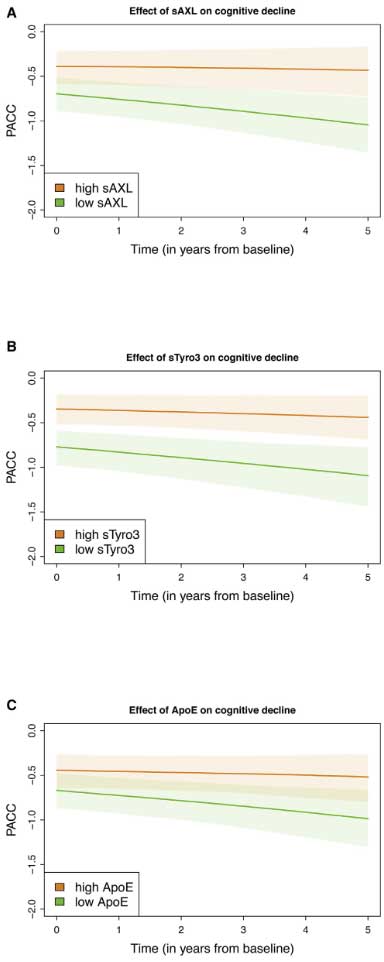
sAXL, sTyroは、AD病理に対して代償的に上がり、神経保護的に働いている可能性が示唆されました。
• Neuroinflammation biomarker study on cerebrospinal fluid of DELCODE and F.ACE cohorts • Synchronous pre-dementia elevation of inflammatory, tau, and neurodegeneration markers • Among these, sTyro3 and sAXL positively relate to MRI structure and cognition • Could TAM signaling be protective during pre-dementia neuroinflammation?
My View
先日、髄液中 sTREM2 がADの初期から増えており、AD病理に対して TREM2 が保護的に働いている可能性について考察しましたが、
TREM2 (triggering receptor expressed on myeloid cell 2) は、脳内では主にミクログリアに発現する膜貫通型の糖蛋白です。 このTREM2をコードする遺伝子TREM2の点 …
今回もそれに似たような内容だと思います。
TAM受容体はマクロファージの貪食機能のイメージが強いですが、ミクログリアとマクロファージは兄弟みたいなものですし、ミクログリアにとっても同じ様な役割を果たしていそうです。
切断された細胞外ドメインの sAXL, sTyro3, sMer については、まだ分かっていないことも多そうですが、知っている限りでは、sAXL や sMer は自身のレセプターにオートクリン的に結合し、他のリガンドと競合することでシグナルを阻害することが知られています。
Axl/Mer がミクログリアの死細胞除去やシナプス障害などに関与していることを考えると、
「AD病理(この論文によるとAβ<タウ)によってミクログリアが活性化し、死細胞やタウ+細胞などを除去するけど、その活性化にともなって可溶性細胞外ドメインが増え、シグナルを阻害する方向に働くので、結果的にタウ+ニューロンの貪食が免れて細胞↓認知機能↓が抑えられるってことかなー」
と推察しました。
sTyro3 に関してはミクログリアにはほとんど発現せず、主に神経細胞に発現しているので、別の作用かもしれません。
でも、Fig3 では sAXL↑、sTryo3↑ と脳萎縮の進行度(Braak Stageに沿った萎縮進行度)が相関するのに、
Fig 5 では認知機能低下は逆に sAXL や sTryo3 が低い群の方が強いって……どーゆーことなんでしょうか?
流石に脳萎縮と認知機能低下には強い相関があると思うので、
それぞれのファクターに対して逆の結果になるって、いまいちしっくりこないなー、という気もします。
……統計マジック?
Glossary
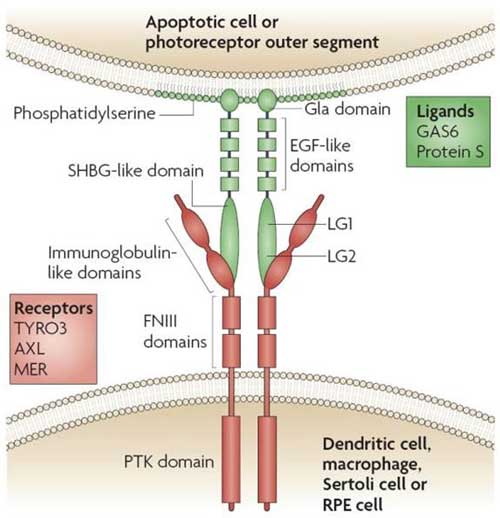
TAM受容体ファミリー
レセプター型チロシンキナーゼの1つ。
- Tyro3
- 894 aa, 98.3kDa。
神経系では主に神経細胞やオリゴデンドロサイトに発現。主なリガンドはプロテインS。
- 894 aa, 98.3kDa。
- Axl
- 890 aa, 96.9 kDa。
神経系では主にアストロサイトやミクログリアに発現。主なリガンドは GAS6。
- 890 aa, 96.9 kDa。
- Mer
- 999 aa, 110.2 kDa。
神経系では主に神経細胞やミクログリアやマクロファージに発現。主なリガンドは GAS6。
- 999 aa, 110.2 kDa。
の3種類が存在し、いずれもレセプターとなる細胞外ドメインは、2個の免疫グロブリン様ドメインと2個のフィブロネクチンIII型ドメインが直列に連なった構造をしている [4] 。
ヒトとマウスでは88.3% のホモロジーがある。
可溶性細胞外ドメイン
いずれも N末側で切断されて細胞外ドメイン(~80 kDa)が細胞外に放出され、sTyro3, sAxl, sMer として血漿中などで確認される [5, 6] 。
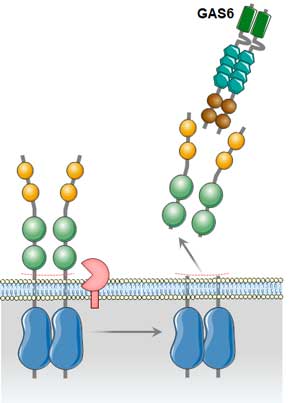
可溶性の細胞外ドメインの機能についてはまだ完全には解明されていないが、大体は各々のレセプターにオートクリン的に結合し、ネガティブ・フィードバック的に働くと考えられている。
機能
腫瘍や免疫疾患での研究が進んでおり [7] 、神経変性疾患では、"Eat-me" シグナルを介したミクログリアの貪食機能への関与(Axl & Mer)[1, 8] や、アミロイドプラークコアの形成 [2] 、変異PGNによるFTLD-TDPモデルでタウ介在性のシナプス障害への関与 [9] などが報告されている。
YRO3/AXL/MER の トリプルKOマウス
様々な組織でアポトーシス細胞の除去機能が落ち、TNF-α や IL-6 などの炎症誘発性サイトカイン(pro-inflammatory cytokine)レベルが上がり、自己抗体の産生も増え、年齢依存的に全身性エリテマトーデス(systemic lupus erythematosus, SLE)の症状が出現する [10] 。
TYRO3ノックアウトマウス
神経障害が起こる。
AXLノックアウトマウス
血管透過性が上がり、血管のリモデリング作用が障害される。
MERノックアウトマウス
トリプルKOマウスと同じような自己免疫障害が起こる。
3つのノックアウトマウスの比較 [11]
| Knockout type | Effects on | ||
|---|---|---|---|
| Hemostasis | Inflammation | Other | |
| Tyro3−/− | • Reduced thrombus formation. | Not described | • Young adults: diminished hippocampal long-term potential. |
| • Initial platelet aggregation is not reduced, but stabilization of the aggregates is, because of a decrease in outside-in signaling and platelet granule secretion. | • Aged: neural degeneration with seizures and paralysis. | ||
| Axl−/− | • Reduced thrombus formation. | • Increase in apoptosis in response to flow reduction in carotid artery. | • Elevated vascular permeability. |
| • Initial platelet aggregation is not reduced, but stabilization of the aggregates is, because of a decrease in outside-in signaling and platelet granule secretion. | • Impaired vascular remodeling: Increase in CD45+ cells and decrease in VSMC, macrophages, and neutrophils. | • Impaired vascular remodeling. | |
| • Enhanced inflammation in the CNS because of delayed removal of myelin debris during experimental autoimmune encephalomyelitis. | |||
| Merkd or Mer−/− | • Reduced thrombus formation. | • Delayed cell clearance of infused apoptotic cells. | • Blindness from impaired phagocytosis of photoreceptor outer segments by retinal pigment epithelial cells. |
| • Initial platelet aggregation is not reduced, but stabilization of the aggregates is, because of a decrease in outside-in signaling and platelet granule secretion. | • Animals develop a SLE-like autoimmunity with antibodies to chromatin, DNA, and IgG. | ||
| • Mice show increased susceptibility and death in response to endotoxic shock. | |||
| • Monocytes stimulated with LPS express more NF-κB and produce more TNF-α. | |||
| • NK T cells have a defect in in vivo GC-α–stimulated production of IL-4 and IFN-γ. | |||
| • Enhanced B-cell responses in splenic marginal zone. | |||
| • Increased migration of macrophages, DCs, plasmacytoid DCs, T cells, and B cells into the peritoneal cavity. | |||
| • Increased renal inflammation in nephrotoxic serum–induced nephritis. | |||
| • Decreased induction of c-Src and STAT3. | |||
References
- Fourgeaud L, Través PG, Tufail Y, Leal-Bailey H, Lew ED, Burrola PG, Callaway P, Zagórska A, Rothlin CV, Nimmerjahn A, Lemke G. TAM receptors regulate multiple features of microglial physiology. Nature. 2016 Apr 14;532(7598):240-244. doi: 10.1038/nature17630. Epub 2016 Apr 6. PMID: 27049947; PMCID: PMC5358512.
- Huang Y, Happonen KE, Burrola PG, O'Connor C, Hah N, Huang L, Nimmerjahn A, Lemke G. Microglia use TAM receptors to detect and engulf amyloid β plaques. Nat Immunol. 2021 May;22(5):586-594. doi: 10.1038/s41590-021-00913-5. Epub 2021 Apr 15. PMID: 33859405; PMCID: PMC8102389.
- Brosseron F, Maass A, Kleineidam L, Ravichandran KA, González PG, McManus RM, Ising C, Santarelli F, Kolbe CC, Häsler LM, Wolfsgruber S, Marquié M, Boada M, Orellana A, de Rojas I, Röske S, Peters O, Cosma NC, Cetindag A, Wang X, Priller J, Spruth EJ, Altenstein S, Schneider A, Fliessbach K, Wiltfang J, Schott BH, Bürger K, Janowitz D, Dichgans M, Perneczky R, Rauchmann BS, Teipel S, Kilimann I, Goerss D, Laske C, Munk MH, Düzel E, Yakupov R, Dobisch L, Metzger CD, Glanz W, Ewers M, Dechent P, Haynes JD, Scheffler K, Roy N, Rostamzadeh A, Teunissen CE, Marchant NL, Spottke A, Jucker M, Latz E, Wagner M, Mengel D, Synofzik M, Jessen F, Ramirez A, Ruiz A, Heneka MT; DELCODE study group. Soluble TAM receptors sAXL and sTyro3 predict structural and functional protection in Alzheimer's disease. Neuron. 2022 Mar 16;110(6):1009-1022.e4. doi: 10.1016/j.neuron.2021.12.016. Epub 2022 Jan 6. PMID: 34995486.
- Lemke G, Rothlin CV. Immunobiology of the TAM receptors. Nat Rev Immunol. 2008 May;8(5):327-36. doi: 10.1038/nri2303. PMID: 18421305; PMCID: PMC2856445.
- Orme JJ, Du Y, Vanarsa K, Mayeux J, Li L, Mutwally A, Arriens C, Min S, Hutcheson J, Davis LS, Chong BF, Satterthwaite AB, Wu T, Mohan C. Heightened cleavage of Axl receptor tyrosine kinase by ADAM metalloproteases may contribute to disease pathogenesis in SLE. Clin Immunol. 2016 Aug;169:58-68. doi: 10.1016/j.clim.2016.05.011. Epub 2016 May 27. PMID: 27237127; PMCID: PMC5193537.
- Sather S, Kenyon KD, Lefkowitz JB, Liang X, Varnum BC, Henson PM, Graham DK. A soluble form of the Mer receptor tyrosine kinase inhibits macrophage clearance of apoptotic cells and platelet aggregation. Blood. 2007 Feb 1;109(3):1026-33. doi: 10.1182/blood-2006-05-021634. Epub 2006 Oct 17. PMID: 17047157; PMCID: PMC1785151.
- Myers KV, Amend SR, Pienta KJ. Targeting Tyro3, Axl and MerTK (TAM receptors): implications for macrophages in the tumor microenvironment. Mol Cancer. 2019 May 14;18(1):94. doi: 10.1186/s12943-019-1022-2. PMID: 31088471; PMCID: PMC6515593.
- Scott RS, McMahon EJ, Pop SM, Reap EA, Caricchio R, Cohen PL, Earp HS, Matsushima GK. Phagocytosis and clearance of apoptotic cells is mediated by MER. Nature. 2001 May 10;411(6834):207-11. doi: 10.1038/35075603. PMID: 11346799.
- Fujita K, Chen X, Homma H, Tagawa K, Amano M, Saito A, Imoto S, Akatsu H, Hashizume Y, Kaibuchi K, Miyano S, Okazawa H. Targeting Tyro3 ameliorates a model of PGRN-mutant FTLD-TDP via tau-mediated synaptic pathology. Nat Commun. 2018 Jan 30;9(1):433. doi: 10.1038/s41467-018-02821-z. PMID: 29382817; PMCID: PMC5789822.
- Lu Q, Lemke G. Homeostatic regulation of the immune system by receptor tyrosine kinases of the Tyro 3 family. Science. 2001 Jul 13;293(5528):306-11. doi: 10.1126/science.1061663. PMID: 11452127.
- van der Meer JH, van der Poll T, van 't Veer C. TAM receptors, Gas6, and protein S: roles in inflammation and hemostasis. Blood. 2014 Apr 17;123(16):2460-9. doi: 10.1182/blood-2013-09-528752. Epub 2014 Mar 4. PMID: 24596417.