
今年に入ってから、身内の手術やメンターの他界などであまり頭が働かず、論文もアブストをさらっと見るだけで、内容をまともに読めていませんでした。
でも、このまま停滞していても良くないので、一人抄読会を再開しようと思います。
仕切り直しの初回は、論文ではなく Alzforum から。
Founded in 1996, Alzforum is a news website and information resource dedicated to helping researchers accelerate discovery and advance development of diagnostics and treatments for Alzheimer’s disease and related disorders. Our site expands the traditional mode of scientific communication by reporting the latest scientific findings and industry news with insightful analysis that puts breaking news into context. In addition, we advance research by developing open-access databases of curated, highly specific scientific content to visualize and facilitate the exploration of complex data. Alzforum is a platform to disseminate the evolving knowledge around basic, translational, and clinical research in the field of AD.
先月に投稿されていた2021年のまとめ記事で、頭を整理し直したいと思います。
Aβ抗体による治療
アデュカヌマブ(Aducanumab)
2020年から常に注目されてきたアデュカヌマブ。
現在、アデュヘルム (Aduhelm) として製品化され、アルツハイマー病(Alzheimer's disease, AD)治療薬として使用されています。
FDAは6月にアデュカヌマブを承認し、一部では「AD治療に新たな時代が来た」と期待で迎えられましたが、
一部では
- 不十分なデータで無理やり通した
- コストがかかる($56,000/year(約560万円/年) + MRI等の検査費)
- 適応範囲が広すぎる
- Phase 3 の論文が査読なしに publish された
などの理由でこの薬の使用を懐疑的にみています。
それから半年経って、アデュカヌマブ側もバックアップデータが出たり、提示された問題に向き合って色々改善されたりしています。
- アデュカヌマブ投与で血漿中p-tau181レベルが下がり、タウ病理抑制にも関与する可能性が示唆された
- 適応範囲が早期ADに狭められた
- Biogenは薬価を半分に
- Phage 4 試験を予定
アデュカヌマブといえばアミロイド関連画像異常(amyloid-related imaging abnormalities, ARIA)の副作用問題も気になりますが、去年12月 Phase 3 試験における ARIA の程度が正式に発表され、ARIA 関連の死亡例や治療例の過半数がADに血管障害を合併している事が報告されました。
今後、アデュカヌマブを投与してもよいかどうか、慎重に判断する必要がありそうです。
Accelerated Approval Pathway で FDA の承認を受けたアデュカヌマブ。 この動きに乗って、その他のAβ抗体(レカネマブ(エーザイ/バイオジェン)、ドナネマブ(イーライリリー)、ガンテネルマブ …
This secondary analysis of 2 phase 3 randomized clinical trials describes the radiographic and clinical characteristics of amyloid-related imaging abnormalities that occurred in the EMERGE and ENGAGE trials.
ただ色々問題を抱えてはいますが、アデュカヌマブは他のAβ治療薬に対するFDA承認の門戸を開いた、という事は確実のようです。
This Viewpoint offers potential changes to improve the process of US Food and Drug Administration accelerated approval.
This Viewpoint discusses the US Food and Drug Administration’s accelerated approval pathway and proposes the need for reforms as well as the timely completion of postapproval trials.
レカネマブ(Lecanemab)
レカネマブ(Eisai/Biogen)については、ARIAの発症がアデュカヌマブよりも少ない事が報告されています。
2021年のPhase 2 open-label 試験では、
- Aβ減少
- 血漿中Aβ42/40比の変化
- 血漿中p-tau217の減少
- 認知機能低下を抑制
などが報告されており、特に認知機能低下を抑制した、というデータはとても期待が持てます。
ドナネマブ(Donanemab)
ドナネマブ(Lilly)も、2021年の試験でレカネマブと似たような結果が得られています。
- 認知機能低下は若干抑制
- Aβはほぼ消失
- 血漿中p-tau217の減少
- タウPETでのタウ蓄積の減少
Lillyは、スタディデザインをちょっと変えて、Phase 3 試験を予定しています。
アルツハイマー病 (Alzheimer's disease, AD) の疾患修飾療法 (disease modifying therapies, DMTs) の1つとして注目されているアミロイドβ (Amyloid be …
In patients with early Alzheimer’s disease, donanemab resulted in a better composite score for cognition and for the ability to perform activities of daily living than placebo at 76 weeks, although results for secondary outcomes were mixed. Longer and larger trials are necessary to study the efficacy and safety of donanemab in Alzheimer’s disease.
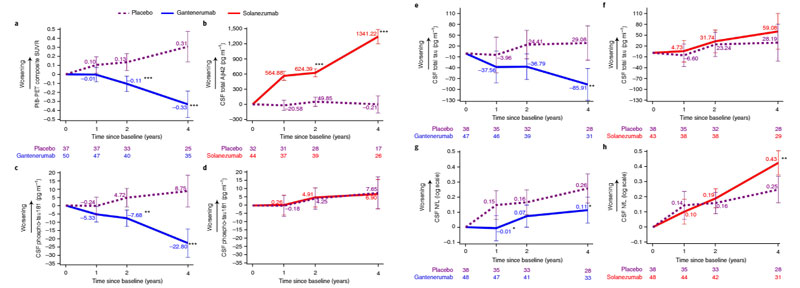
ガンテネルマブ(Gantenerumab)
ガンテネルマブ(Chugai Pharmaceutical Co., Ltd., Hoffmann-La Roche)は、ちょっと毛色の違ったAβ抗体で、皮下注投与になります。
Roche は FDA の accelerated approval を避け、じっくりと Phase 3 データを解析する予定のようです。
DIAN-TU では、常染色体顕性遺伝のAD患者のうち、18歳でまだ脳内のAβ沈着が少ない人達を対象にスタディをデザインしましたが、
そこでガンテネルマブを primary prevention トライアルに使用することを決定しています。
また、改定Ver.のガンテネルマブは、Transferrin受容体1を介して、よりBBBを通過しやすいように改善しており、効率的に脳内のAβに届くようになっています。
家族性アルツハイマー病 (Alzheimer's disease, AD) の患者さんを対象に、薬剤の治療効果を観察する DIAN-TU 研究で、 ガンテネルマブ (Gantenerumab) ソラネズマブ (Solan …
タウを標的とした治療
タウ抗体
タウ抗体に関しては、4つのタウN末抗体中、3つが失敗に終わり、
- ザゴテネマブ(Zagotenemab, Lilly): Phase 2、360人を対象、認知機能改善なし。
- チラボネマブ(Tilavonemab, Abbvie): Phase 2、453人を対象、認知機能改善なし。
- ゴスラネマブ(Gosuranemab, Biogen): 654人の早期ADを対象、ADAS-cog13のスコアが悪化。
残り1つはギリギリ崖っぷちの状態。
- セモリネマブ(Semorinemab, Genentech): 2つの共同主要評価項目のうちの1つで効果ありそうな結果。非盲検試験で同様の結果が出るかどうか注目。
これらの結果を受けて、科学者達は、タウ抗体のターゲットをタウの中間部にシフトしています。
まだ結果は出ていませんが、少なくとも6つのタウ抗体で、FDA承認に向けての治験が進んでいるようです。
- JNJ-63733657(Janssen, Phase 2)
- べプラネマブ(Bepranemab, UCB, Phase 2)
- E2814(Eisai, Phase 1 終了)
- PNT001(Phase 1 終了)
- AF87908(Lundbeck, Phase1 終了)
- BIIB076(Biogen, Phase 1 終了)
低分子化合物
タウを標的とした低分子化合物は、
- O-GlcNAcase enzyme inhibitor(Lilly, Phase 2)
- ASN51(Asceneuron, Phase 1)
で治験が進められています。
両剤とも、タウのグリコシル化を促し、タウの凝集化を防ぐ機能を持っています。
遺伝子治療
遺伝子治療は、
- BIIB080(Ionis/Biogen, Phase 1/2): タウのアンチセンスオリゴヌクレオチド(ASO)。明らかな副作用なしに、脳脊髄液(cerebrospinal fluid, CSF)タウレベルを半分にまで減少させた。
がPhase 1/2 で良好な結果を得、今年 Phase 2 が予定されています。
ASO に関しては、去年3月にハンチントン病をターゲットとしたトミネルセン(Tominersen)が効果なしという結果が出てがっかりしましたが、
今年は少なくとも6つの ASO で治験が予定されています。
ターゲット遺伝子は、
- C9ORF72
- SOD1
- LRRK2
- FUS
- 家族性PDの遺伝子
などです。
その他のAD治療ターゲット
AD治療薬は、Aβやタウだけが標的ではありません。
- APOE
- 脂質代謝
- エンドソーム
- リソソーム
- オートファジー
- 神経炎症
- TREM2
などをターゲットにした薬剤も続々と開発され、治験が進められています。
アルツハイマー病 (Alzheimer's disease, AD) は、 アミロイドβ (Amyloid beta, Aβ) を主体とするAβプラーク 過リン酸化タウを主体とする神経原線維変化 (neurofibril …
アポリポタンパクE4(Apolipoprotein E4, APOE4)は、アルツハイマー病(Alzheimer's disease, AD)の強力なリスク因子として注目されています [1]。 APOE4のAD増悪の機序 …
バイオマーカー
一昨年に引き続き、新たなバイオマーカーや既存のバイオマーカーの見直しなど、続々と報告がありました。
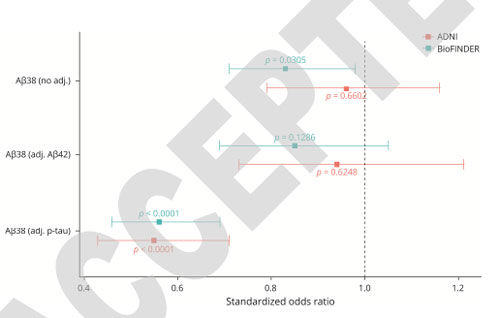
CSF/血漿中Aβ
体液マーカーについては、血漿中のAβ42/40の測定が質量分析法 (mass spectrometry, MS)で可能になり、C2N社の mass-spec である Precivity は、CSF中よりも血漿中のAβ42/40比の変化を何年も前から検出できることを報告し、
脳のAβ42クリアランスの遅れがADの初期症状の1つである可能性が示唆されました。
アミロイド陽性者と陰性者の差が小さい事が懸念されていますが、現在進行中の AHEAD3 および AHEAD45 の二次予防試験において、Precivity はスクリーニングに使用されています。
This cross-sectional study compares the performance of plasma amyloid-β 42/40 (Aβ42/40) measured using 8 different Aβ assays and methods in detecting abnormal brain Aβ status in patients with early Alzheimer disease.
CSF/血漿中タウ
タウの体液マーカーとしては、血漿中 p-tau181 がアミロイドや脳萎縮だけでなく、神経障害や認知機能低下も予測できる事が報告されました。
アルツハイマー病(Alzheimer's disease, AD)の2大病理といえば「アミロイドβ(Amyloid beta, Aβ)」と「タウ」ですが、 この2つの病理はどちらが先か、という議論は以前から続いていました …
また、p-tau231がリン酸化タウとして最初に上がってくる可能性や、CSF/血漿中のグリアのマーカー(GFAP, YKL40)がそれよりも早い段階で上昇してくる可能性などが報告され、
現在 19種類の血漿中のタンパクを調べる事で、97%の精度でAD発症を予測できる、と考えられています。
Yuanbing Jiang,Xiaopu Zhou,Fanny C. Ip,Philip Chan,Yu Chen,Nicole C.H. Lai,Kit Cheung,Ronnie M.N. Lo,Estella P.S. Tong,Bonnie W.Y. Wong,Andrew L.T. Chan,Vincent C.T. Mok,Timothy C.Y. Kwok,Kin Y. Mok,John Hardy,Henrik Zetterberg,Amy K.Y. Fu,Nancy Y. Ip
イメージング
去年はイメージングの分野も躍進しました。
MRI上の青斑核(locus coeruleus, LC)の変性が早期ADのバイオマーカーと相関することが報告されました。
LCは最初にタウタングルが溜まる所ですが、細胞群が非常に小さいので、現在のタウPETでは検出できません。
けれどもMRIで変性を見ることで、早期ADでの変化を捉える事が可能ということがわかりました。
The locus coeruleus (LC) has been recognized as initial site of TAU aggregation in Alzheimer’s disease (AD). However, how LC pathology relates to disease progression and symptoms remains to be elucidated. Now, Jacobs et al. used MRI and PET longitudinal data in cognitively impaired and unimpaired individuals and postmortem data from two large cohorts of patients with AD and showed that the integrity of the LC is associated with the main pathological and cognitive features of preclinical AD, suggesting that monitoring LC using noninvasive imaging methods might help to predict cognitive trajectories and AD pathology later in life.
またアミロイドPETの研究では、ある一定レベルのAβが脳内に蓄積した段階(SUVR 1.2)からAD発症までを予測可能、という報告もありました。
Background and Objectives To predict when cognitively normal individuals with brain amyloidosis will develop symptoms of Alzheimer disease (AD). Methods Brain amyloid burden was measured by amyloid PET with Pittsburgh compound B. The mean cortical standardized uptake value ratio (SUVR) was transformed into a timescale with the use of longitudinal data. Results Amyloid accumulation was evaluated in 236 individuals who underwent >1 amyloid PET scan. The average age was 66.5 ± 9.2 years, and 12 individuals (5%) had cognitive impairment at their baseline amyloid PET scan. A tipping point in amyloid accumulation was identified at a low level of amyloid burden (SUVR 1.2), after which nearly all individuals accumulated amyloid at a relatively consistent rate until reaching a high level of amyloid burden (SUVR 3.0). The average time between levels of amyloid burden was used to estimate the age at which an individual reached SUVR 1.2. Longitudinal clinical diagnoses for 180 individuals were aligned by the estimated age at SUVR 1.2. In the 22 individuals who progressed from cognitively normal to a typical AD dementia syndrome, the estimated age at which an individual reached SUVR 1.2 predicted the age at symptom onset ( R 2 = 0.54, p
一方で、タウPETも、早期ADの認知機能低下を予測できる、という報告があり、イメージングの精度もどんどん上がってきているようです。
This prognostic study examines the prognostic accuracy of baseline [18F]flortaucipir and [18F]RO948 (tau) positron emission tomography (PET) in individuals across the Alzheimer disease clinical spectrum and performs a head-to-head comparison with established magnetic resonance imaging and amyloid...
ジェネティックス
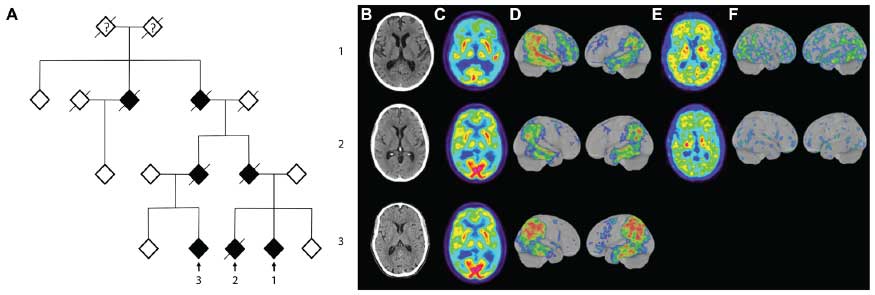
去年の報告で、家族性ADの新たな変異として、APP の Uppsala変異が報告されました。
家族性アルツハイマー病 (Alzheimer's disease, AD) の殆どはAβ産生系の遺伝子に変異があり、10%はアミロイド前駆蛋白 (Amyloid precursor protein, APP) の遺伝子に …
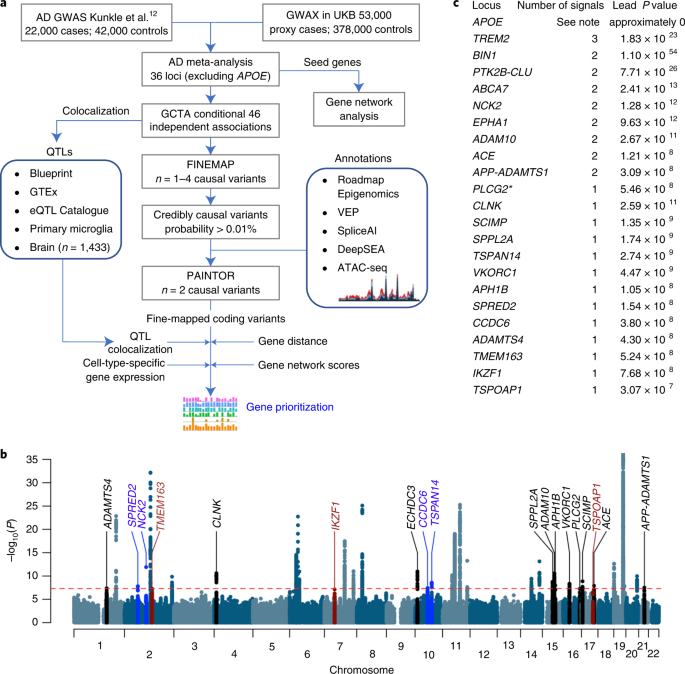
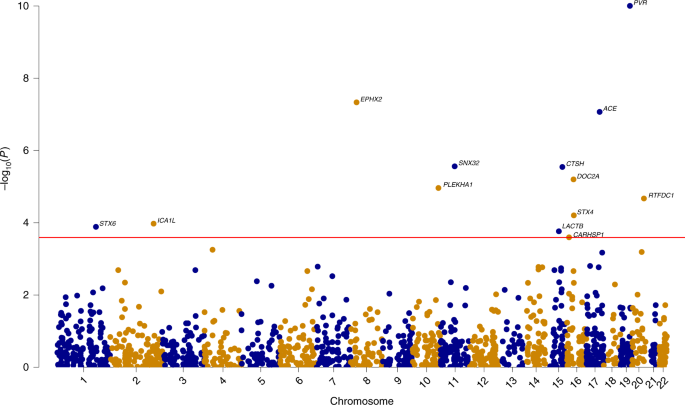
また、ゲノムワイド関連解析(genome-wide association study, GWAS)も、他の解析法と組み合わせ(eg. PWAS x GWAS, TWAS x GWAS)、新たなリスク遺伝子を同定しました。
Genome-wide meta-analysis, fine-mapping and integrative prioritization using expression quantitative trait loci, protein interaction networks and tissue-specific expression implicate new candidate susceptibility genes for Alzheimer’s disease.
Integrating human brain proteomes with genome-wide association data followed by Mendelian randomization identifies 11 genes with potentially causal roles in Alzheimer’s disease pathogenesis.
This genetic association study investigates what genes and genomic processes underlie the risk of sporadic Parkinson disease.
ミクログリア
多機能ミクログリア。その機能も、毎年少しずつ解明されてきています。
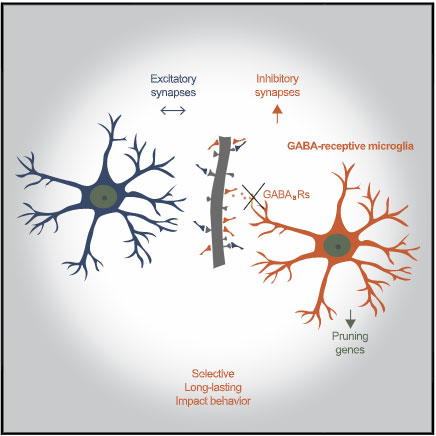
2021年には、シナプス可塑性に関与するミクログリアのサブタイプが報告され、
ミクログリアが神経シナプスの剪定を行い、シナプスの再編や可塑性に重要な役割を果たしている事は周知の事実ですが、 その働きについては主に興奮性シナプスについて研究されてきました [1, 2]。 ただ、最近明らかになってきた …
ミエリンをすり減らすミクログリア "White-matter-associated microglia (WAM)" がAβプラーク形成を助長する、という報告もありました。
scRNA-seq identifies age-dependent white matter-associated microglia (WAMs) . WAMs form nodules that are engaged in clearing degenerated myelin. WAM formation depends on TREM2 but not on APOE signaling. In mouse models of Alzheimer’s disease, the WAM response occurs before DAM.
The prevalence of Alzheimer’s disease (AD), the leading cause of dementia, shows a strict age-dependency, but why ageing constitutes the main risk factor for this disease is still poorly understood. Brain ageing affects oligodendrocytes[1][1] and the structural integrity of myelin sheaths[2][2], the latter associated with secondary neuroinflammation[3][3]. Since oligodendrocytes support axonal and neuronal health[4][4]–[7][5], we hypothesised that ageing-associated loss of myelin integrity could be an upstream risk factor for neuronal amyloid-β (Aβ) deposition, the primary neuropathological hallmark of AD. Here, we show that in AD mouse models different genetically induced defects of myelin integrity or demyelinating injuries are indeed potent drivers of amyloid deposition in vivo , quantified by whole brain light sheet microscopy. Conversely, the lack of myelin in the forebrain provides protection against plaque deposition. Mechanistically, we find that myelin dysfunction causes the accumulation of the Aβ producing machinery within axonal swellings and increases cortical amyloid precursor protein (APP) cleavage. Surprisingly, AD mice with dysfunctional myelin lack plaque-corralling microglia but show a disease-associated microglia (DAM)-like signature as revealed by bulk and single cell transcriptomics. These activated microglia, however, are primarily engaged with myelin, preventing the protective reactions of microglia to Aβ plaques. Our data suggest a working model, in which age-dependent structural defects of myelin promote plaque formation, directly and indirectly, and are thus an upstream AD risk factor. Improving oligodendrocyte health and myelin integrity could be a promising target to delay AD.g ### Competing Interest Statement The authors have declared no competing interest. [1]: #ref-1 [2]: #ref-2 [3]: #ref-3 [4]: #ref-4 [5]: #ref-7
他にも、ミクログリアがリソソームをゴミ圧縮機のように利用して、Aβを圧縮し、Aβコアプラーク内に吐き出している、というエビデンスも出ており、この機能によってミクログリアは毒性の高いAβが拡散するのを防いでいる可能性が示唆されました。
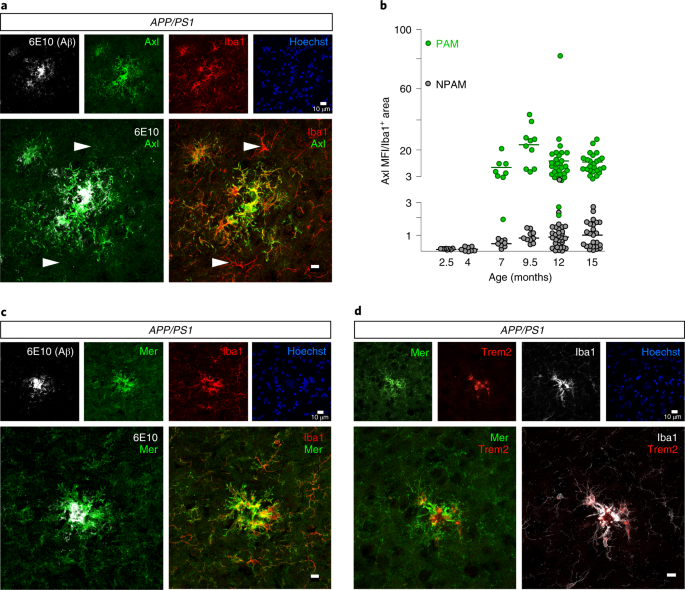
How microglia sense amyloid plaques in Alzheimer’s disease has remained mysterious. Lemke and colleagues report that TAM receptor kinases are absolutely required for normal microglial recognition of, response to and phagocytosis of Aβ plaques. Surprisingly, TAM-mediated microglial phagocytosis of Aβ material does not constrain, but rather promotes, the formation of dense-core plaques.
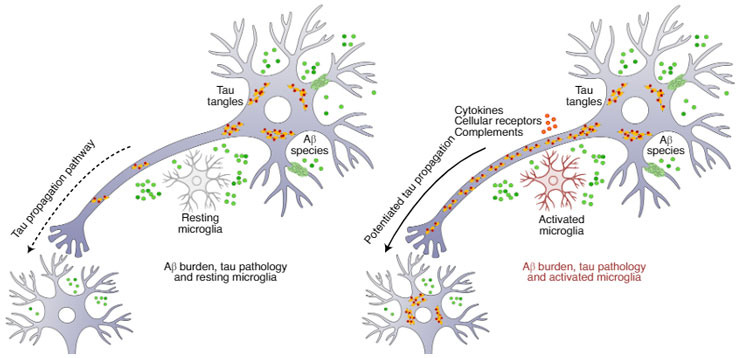
一方で、ミクログリアの活性化がタウの広がりに先行する、という報告もあり、
アルツハイマー病(Alzheimer's disease, AD)の代表的な病理といえば、 アミロイドβ(Amyloid beta, Aβ) タウ 神経炎症 血管病変 神経障害 などが挙げられるかと思います。 これらの変 …
脳のお掃除屋さんのミクログリア。 アミロイドβ(Amyloid beta, Aβ)とかタウとか、脳内で蓄積すると困るタンパク達を貪食して除去しようとしてくれていますが、反面、活性化したミクログリアが炎症性サイトカインを出 …
タウ伝播だけでなく、Aβの伝播にも関与する可能性を示唆する報告もありました。
先日、ミクログリアがタウの伝播に一役買っているかも…という内容の論文 [1] を紹介しましたが、 今回はアミロイドβ(Amyloid beta, Aβ)の話。 ドイツ・Freiburg大学の Dr. Meyer-Lueh …
結局、ミクログリアはAD病理に対して良い働きも悪い働きもしているような感じで、まだまだわからない事だらけ、という印象です。
新しく作製されたAPPノックインマウスでは、Aβプラークが大量に沈着するのに並行して、ADでみられるようなミクログリアの転写プロファイル(TREM2の上昇、プラークを取り込むグリア内にAβと脂質が取り込まれる etc.)が観察され、Aβとミクログリアの関係を明らかにするツールの1つとして期待されています。
Microglial dysfunction is believed to play a pathogenic role in Alzheimer’s disease (AD). Here, we characterize the amyloid-β related pathology and microglial responses in an engineered APP knock-in mouse model of familial AD. This model recapitulates key pathological features of AD such as a progressive accumulation of parenchymal amyloid plaques and vascular amyloid deposits, altered glial responses and neurodegeneration. Leveraging multi-omics approaches, we found lipid accumulation and an exacerbated disease-associated transcriptomic response in methoxy-X04-positive, phagocytic microglia. Together, these findings highlight the potential of this novel, open-access mouse model to investigate AD pathogenesis and demonstrate that fibrillar Aβ triggers lipid dysregulation and immuno-metabolic perturbations in phagocytic microglia. Highlights ### Competing Interest Statement D.X., S.L., T.S., M.C., J.S., E.T., J.D., M.P., S.L.D., T.K.E., C.C.L., S.D., C.H., H.H., R.C., E.Y., H.S., S.T.M., R.L., K.L., R.G.T., K.S.L., J.W.L., G.D.P.and P.E.S are paid employees and shareholders of Denali Therapeutic Inc. J.D.W. and J.A.H are currently employed by Cajal Neuroscience.
アストロサイト/APOE
数年前まではミクログリアの影に隠れがちだったアストロサイトの機能についても、続々と報告されるようになりました。
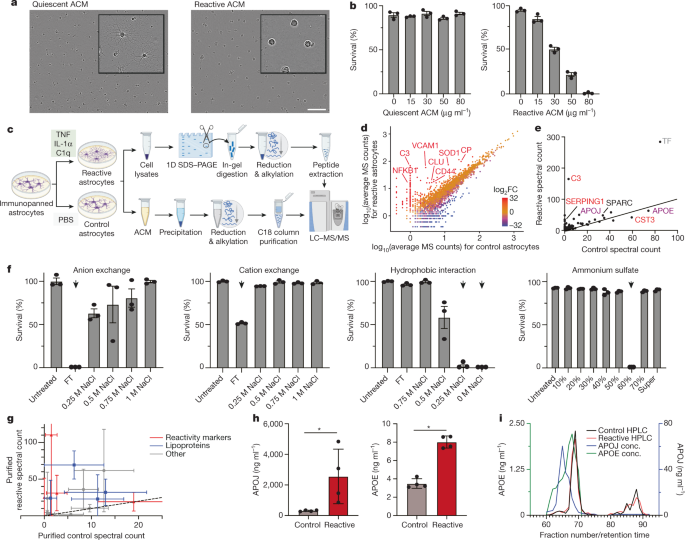
アストロサイトは、リソソームが機能しなくなると、その小器官と内容物を細胞外に捨てて、それによって近くにいるニューロンを殺してしまうこと、
Inflammatory reactive astrocytes lose homeostatic functions and can be neurotoxic, potentially contributing to neurodegenerative diseases. However, the underlying cell biological mechanisms are not fully understood. Here, we demonstrate that lysosomes are remodeled and alkalinized in inflammatory reactive astrocytes, and that lysosome exocytosis drives astrocyte-mediated neurotoxicity. CRISPRi screens uncover mTOR as a regulator of neurotoxic lysosome exocytosis. These results pinpoint lysosome remodeling and exocytosis in inflammatory reactive astrocytes as a potential therapeutic target. ### Competing Interest Statement A.W.K is a member of the Scientific Advisory Board for Nine Square Therapeutics, Inc. J.E. is an advisor to Seer, Inc. M. K. has filed a patent application related to CRISPRi and CRISPRa screening (PCT/US15/40449) and serves on the Scientific Advisory Board of Engine Biosciences, Casma Therapeutics, and Cajal Neuroscience, and is an advisor to Modulo Bio and Recursion Therapeutics. None of the other authors declare competing interests.
アストロサイトの神経毒性が長鎖脂肪酸に起因し、ELOVL1という脂質エロンガーゼを処理すると反応性アストロサイトが抑制されること、
Astrocytes can respond to diseases and injuries of the central nervous system by driving the death of neurons and mature oligodendrocytes through the delivery of long-chain saturated fatty acids contained in lipoparticles.
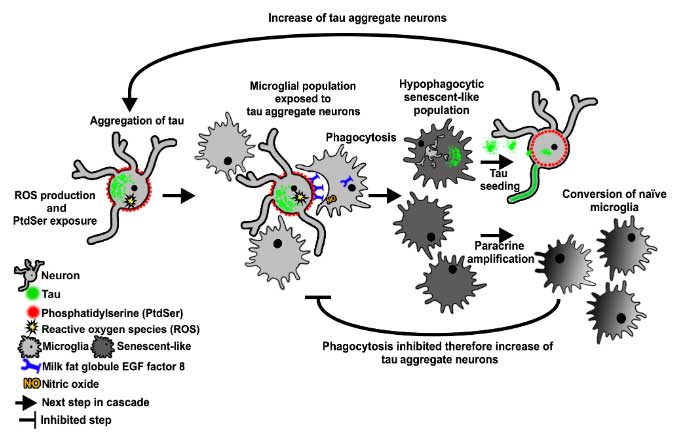
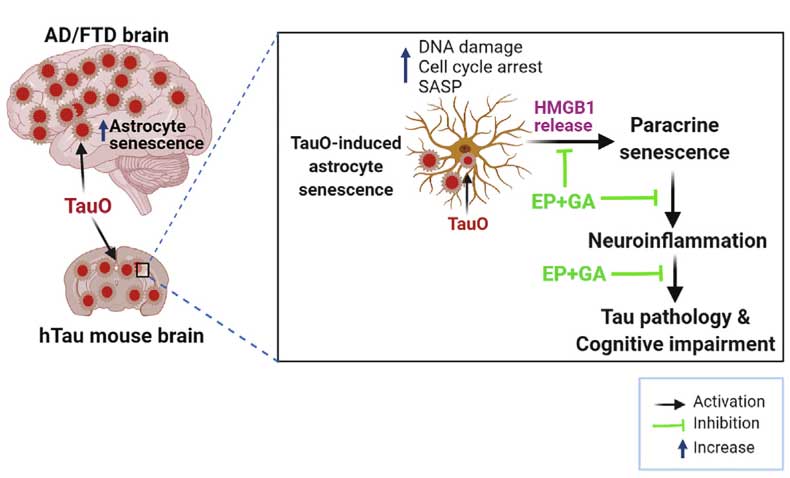
タウオリゴマーに晒されたアストロサイトは老化状態に入り、老化を近傍の細胞に伝播させるタンパクを放出、これによってタウの毒性を悪化させ、タウ伝播を促進すること、
神経変性疾患分野では、老化細胞 (senescent cells) への注目が集まっていると思います。 以前、老化したグリアを除去するとモデルマウスのタウ病理と認知機能が改善したという論文を紹介しましたが、 今回は、その …
などが報告されました。
専門家の間では、多様な反応性アストロサイトをうまく表現する terminology はないかと検討中らしいです。
Good–bad binary classifications fail to describe reactive astrocytes in CNS disorders. Here, 81 researchers reach consensus on widespread misconceptions and provide definitions and recommendations for future research on reactive astrocytes.
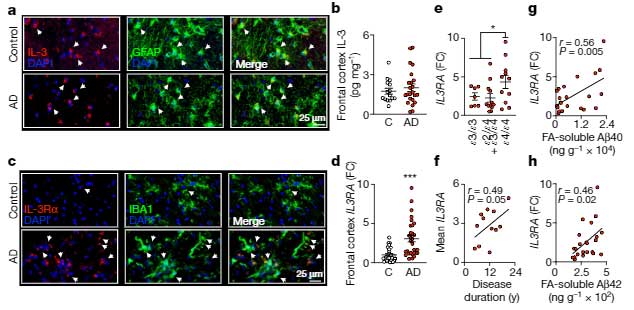
また、アストロサイトと他の細胞とのクロストークに関する研究も報告されました。
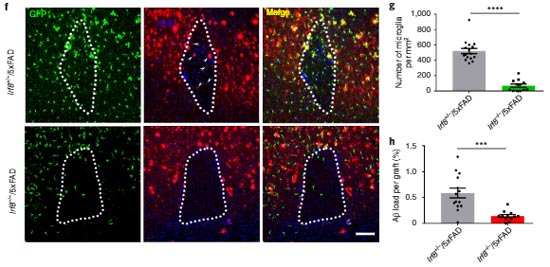
アストロサイトーミクログリアのクロストークに関しては、ADでミクログリアがより多くのIL-3受容体を作り、アストロサイト由来のIL-3によってミクログリア細胞表面受容体TREM2の下流シグナル伝達が強化され、Aβ除去が促進される、という報告がありました。
アルツハイマー病 (Alzheimer's disease, AD) などの神経変性疾患において、ニューロンだけでなくグリアやサイトカインの役割も次々と明らかになってきています [1]。 インターロイキン3 (Inter …
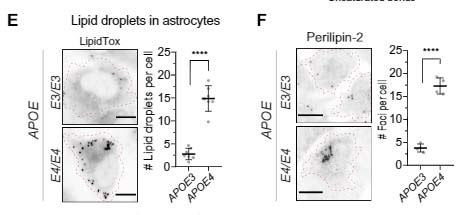
アストロサイトとAPOEについても去年多数報告があり、APOE4を発現するアストロサイトは、不飽和脂肪酸を蓄積する事や、
アポリポタンパクは、脂質等と結合して、脂質の運搬や脂質代謝関連酵素の活性化、あるいは補酵素として働く一連のタンパクの総称です。 このうち、アポリポタンパクE (Apolipoprotein E, APOE) は、主に3つ …
ヒトAPOE発現マウスでアストロサイトのAPOE4を特異的に欠失させると、タウ毒性および神経変性が改善する事が報告されました。
先日アポリポタンパクE4(Apolipoprotein E4, APOE4)とタウについての論文を紹介しましたが[1]、 その記事を書いた翌日に同じラボからこの論文が出たので、 「どーしよーかなー。」 と思いましたが、つ …
APOEに関しては、エンドソーム・リソソーム系を介したリサイクリングの促進が治療ターゲットとなる可能性も示唆されました。
APOE4は、初期エンドソームのpH6.4で粘着性を帯び、この小胞のpHをほんのちょっと下げるだけでAPOE4のトラフィッキングを改善し、アミロイドーシスを抑制する効果が有ることが報告されました。
Genetic disruption of sodium-hydrogen exchanger 6 (NHE6) reduces amyloid plaques in humanized Alzheimer's disease mouse models and restores normal synaptic responses to neuromodulatory input in humanized ApoE4-expressing animals.
またAPOEがエンドソームの取り込まれる際に結合するLDL受容体の発現を上げると、APOEレベルが減少し、ミクログリアの活動を抑え、タウオパチーマウス(P301S)のタウ毒性を和らげる事も報告されました。
• LDLR OX lowers apoE and reduces tau pathology and neurodegeneration in P301S mice • LDLR-overexpressing microglia downregulate Apoe and show suppressed activation • ApoE KO and LDLR OX drive microglial catabolism over anabolism • ApoE KO and LDLR OX increase the OPC pool and preserve myelin integrity
免疫細胞
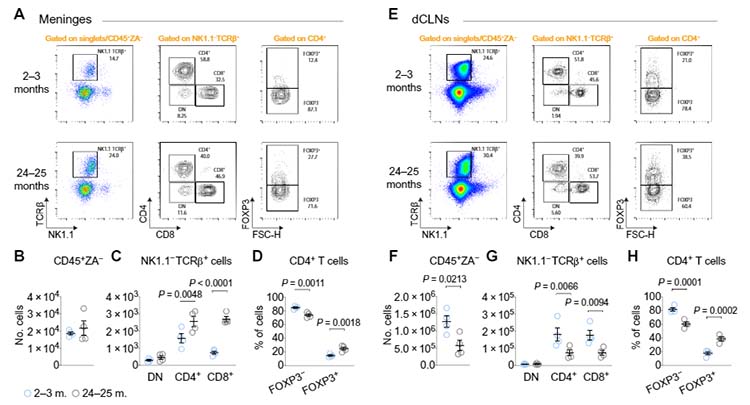
去年は、硬膜に存在する免疫細胞について色々と驚きの結果が報告されました。
Cugurra et al. found in mice that a large proportion of continuously replenished myeloid cells in the dura mater are not blood derived, but rather transit from cranial bone marrow through specialized channels. In models of CNS injury and neuroinflammation, the authors demonstrated that these myeloid cells have an immunoregulatory phenotype compared with their more inflammatory blood-derived counterparts. Similarly, Brioschi et al. show that the meninges host B cells that are also derived from skull bone marrow, mature locally, and likely acquire a tolerogenic phenotype. They further found that the brains of aging mice are infiltrated by a second population of age-associated B cells, which come from the periphery and may differentiate into autoantibody-secreting plasma cells after encountering CNS antigens. Together, these two studies may inform future treatment of neurological diseases.
Heterogeneity of meningeal B cells reveals a lymphopoietic niche at the CNS borders | Science | AAASCugurra et al. found in mice that a large proportion of continuously replenished myeloid cells in the dura mater are not blood derived, but rather transit from cranial bone marrow through specialized channels. In models of CNS injury and neuroinflammation, the authors demonstrated that these myeloid cells have an immunoregulatory phenotype compared with their more inflammatory blood-derived counterparts. Similarly, Brioschi et al. show that the meninges host B cells that are also derived from skull bone marrow, mature locally, and likely acquire a tolerogenic phenotype. They further found that the brains of aging mice are infiltrated by a second population of age-associated B cells, which come from the periphery and may differentiate into autoantibody-secreting plasma cells after encountering CNS antigens. Together, these two studies may inform future treatment of neurological diseases.
頭蓋骨の骨髄には単球とB細胞で満たされている事が発見され、これらの細胞は頭蓋内の狭い通路を通って髄膜に押し出されます。
この細胞はB細胞やT細胞が成熟する場所である脾臓や胸線に行くことはなく、もっと言えば血管に入る事もなく、そこから炎症性シグナルに反応して脳実質や脊髄に浸潤していきます。
このような適応免疫細胞の "private stock" は、脳を "自己" として区別し、このような特別な機能を与えたのではないかと考える科学者もいるようです。
一方で、頭蓋骨の骨髄の役割に懐疑的な人達もいるようです。
ある研究チームは、髄膜自体がB細胞を生成している事を報告しており、シングルセルRNA-Seqで、硬膜に成熟および未熟なB細胞のニッチがあることがわかりました。
これらの機能は、加齢に伴う神経変性疾患において、重要な発見と言えると思います。
脳の髄膜リンパドレナージがAβやα-シヌクレイン(α-synuclein, α-syn)等、異常タンパクの排泄に重要であることも続々と報告されていますし、
アミロイドβ (Amyloid beta, Aβ) の抗体療法は、アルツハイマー病 (Alzheimer's disease, AD) の治療として最も期待がかかっている治療法の一つですが、 治験の結果は、マウスの実験結 …
長らく、脳にはリンパ管が存在しないと言われていましたが、 1987年、脳の表層にある髄膜には「リンパ管がある」と報告されていました [1]。 その後この発見はしばらく歴史に埋もれていましたが、 40年程経った2013年以 …
加齢によって髄膜のCCR7+リンパ球が減り、認知機能が悪くなることも報告されました。
脳の髄膜リンパ管が "再発見" されてから [1, 2]、神経変性疾患と髄膜リンパ管との関連についての研究が立て続けに報告されています [3, 4, 5]。 それと並行して、髄膜内の免疫系についても注目が集まっているよう …
また、末梢の免疫細胞に関しても重要な報告がありました。
パーキンソン病では、T細胞がα-Synを認識して血管内からレヴィ小体の周囲に動員される様子が観察され、炎症性サイトカイン IL-17A を放出するようです。
Gate et al. observed immune cells known as T cells in the brains of LBD patients (see the Perspective by Krot and Rolls). Genomics analysis revealed that T cells traffic to the LBD brain and are associated with neuronal damage. When stimulated with α-synuclein, LBD patient T cells secrete an inflammatory protein known to damage neurons. These findings suggest an unexpected detrimental role of the immune system in LBD.
これら末梢の免疫細胞達がどのようにして血液脳関門(blood-brain barrier, BBB)を通過するのかはまだ完全には解明されていません。
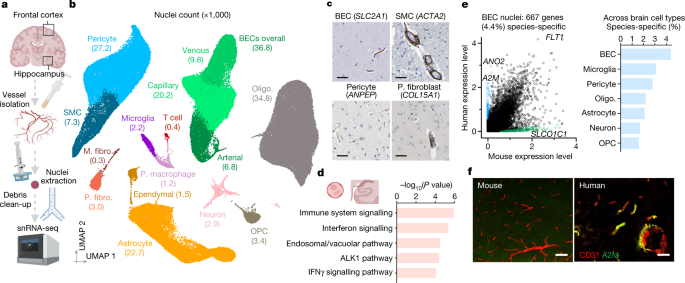
去年プレプリントで報告(今年Natureに掲載)された、人の脳血管系の高解像度発現マップは、この疑問や血管と神経変性に関するその他の疑問の解決に役立つかもしれません。
A method called vessel isolation and nuclei extraction for sequencing (VINE-seq) produces a molecular map of vascular and perivascular cell types in the human brain and reveals their contributions to Alzheimer’s disease risk.
この報告では、剖検脳から血管や血管周囲の細胞を分離する方法を発見し、single-nuclei RNA-Seq を行いました(VINE-Seqと命名)。
この方法により、新しいタイプのペリサイトや繊維が細胞が同定された他、血管細胞がADリスク遺伝子上位45個のうち30個を発現している事が明らかになり、ADにおける血管細胞の役割について新たな情報を提示することとなりました。
また、同様のシングル核による空間発現解析により、マウスが加齢するにつれて、脳室を取り囲みCSFを生成する血管網である脈絡叢で炎症が急速に進行することがわかりました。
• A detailed map of mouse choroid plexus (ChP) cells across ventricles and ages • Ventricle- and age-dependent expression programs in epithelial and fibroblast cells • A common progenitor pool for embryonic epithelial and neuronal cells uncovered • Cell-cell interaction networks found cell-type-specific IL-1β signaling in aged ChP
プロテイノパチー
Aβ
去年のAβプラークに関する報告では、まずAβ42が高密度コアを作り、その周囲をAβ38が取り囲むようにして沈着する様子が観察されました。
We used metabolic isotope labeling in APPNL-G-F knock-in mice together with mass spectrometry imaging to monitor the earliest seeds of Aβ deposition through ongoing plaque development. This allowed visualizing Aβ aggregation dynamics within single plaques across different brain regions. We show that formation of structurally distinct plaques is associated with differential Aβ peptide deposition. Specifically, Aβ1-42 is forming an initial core structure followed by radial outgrowth and late secretion and deposition of Aβ1-38. These data describe a detailed picture of the earliest events of precipitating amyloid pathology at scales not previously possible.
アルツハイマー病 (Alzheimer's disease, AD) の主要病理の1つ、アミロイドβ (Amyloid beta, Aβ) 。 Aβは、アミロイド前駆蛋白 (Amyloid precursor prote …
タウ
タウに関しては、これまで神経原線維変化はほぼ死骸のように考えられていましたが、実は1週間程度の半減期でタウ凝集体が出たり入ったりしている事がわかりました
Accumulation of the tau protein in fibrillar intracellular aggregates is a defining feature of multiple neurodegenerative diseases collectively referred to as tauopathies. Despite intensive study of tau, there is limited information on the formation and clearance dynamics of tau inclusions. Using rAAV vectors to mediate expression of Dendra2-tagged human wild-type, P301L and pro-aggregant P301L/S320F tau proteins, with and without the addition of exogenous tau fibrillar seeds, we evaluated tau inclusion dynamics in organotypic brain slice culture (BSC) models using long-term optical pulse labeling methodology. Our studies reveal that tau inclusions typically form in 12–96 h in tauopathy BSC models. Unexpectedly, we demonstrate appreciable turnover of tau within inclusions with an average half-life of ~ 1 week when inclusions are newly formed. When BSCs with inclusions are aged in culture for extended periods, tau inclusions continue to turnover, but their half-lives increase to ~ 2 weeks and ~ 3 weeks after 1 and 2 months in culture, respectively. Individual tau inclusions can be long-lived structures that can persist for months in these BSC models and for even longer in the human brain. However, our data indicate that tau inclusions, are not ‘tombstones’, but dynamic structures with appreciable turnover. Understanding the cellular processes mediating this inclusion turnover may lead to new therapeutic strategies that could reverse pathological tau inclusion formation.
またAβプラークや神経原線維変化はAβやタウ以外にも多くのタンパクで構成されているようで、メチル化RNAとそのタンパクパートナーであるHNRNPA2Bがタウと結合し、ADの進行に伴って神経原線維変化内に蓄積することが報告されました。
• Tau oligomerization exhibits rapid aggregation of proteins linked to RNA metabolism • Oligomeric tau complexes with HNRNPA2B1 and m6A-RNA to regulate RNA translation • Knockdown of HNRNPA2B1 reduces the response to pathological tau • m6A progressively increases with disease severity in human AD brains
タウ病理がどのように広がるかについては、ある領域から関連領域にタウが移動していく事や、一部の脆弱な細胞でシードが新たに複製される事などでADや関連疾患の進行が決まるのではないかと考えられていましたが、去年報告されたアミロイド成長の速度論的モデルでは、後者の可能性が強そうです。
このモデルでは、タウの種が複製されることで蓄積ペースが決まり、拡散はごく僅かな役割に留まる事を示唆しています。
Both the replication of protein aggregates and their spreading throughout the brain are implicated in the progression of Alzheimer’s disease (AD). However, the rates of these processes are unknown and the identity of the rate-determining process in humans has therefore remained elusive. By bringing together chemical kinetics with measurements of tau seeds and aggregates across brain regions, we can quantify their replication rate in human brains. Notably, we obtain comparable rates in several different datasets, with five different methods of tau quantification, from postmortem seed amplification assays to tau PET studies in living individuals. Our results suggest that from Braak stage III onward, local replication, rather than spreading between brain regions, is the main process controlling the overall rate of accumulation of tau in neocortical regions. The number of seeds doubles only every ∼5 years. Thus, limiting local replication likely constitutes the most promising strategy to control tau accumulation during AD.
では何が細胞を脆弱化させるのか、この疑問に対して、single-nucleus RNA-Seq の研究が解決の緒を提示しました。
この報告では、興奮性ニューロンのサブセットが、神経原線維変化の近くで発見され、転写因子RORBを発現している事を指摘しています。
脳神経内科が取り扱う神経変性疾患の多くは、疾患ごとに特定の部位の神経細胞が障害されやすくなっており、それに伴って疾患特異的な神経症状を呈します。 例えば、 アルツハイマー病 (Alzheimer's disease, A …
Cryo-EM
プロテイノパチー全般に関しては、去年も cryo-EM が大活躍しました。
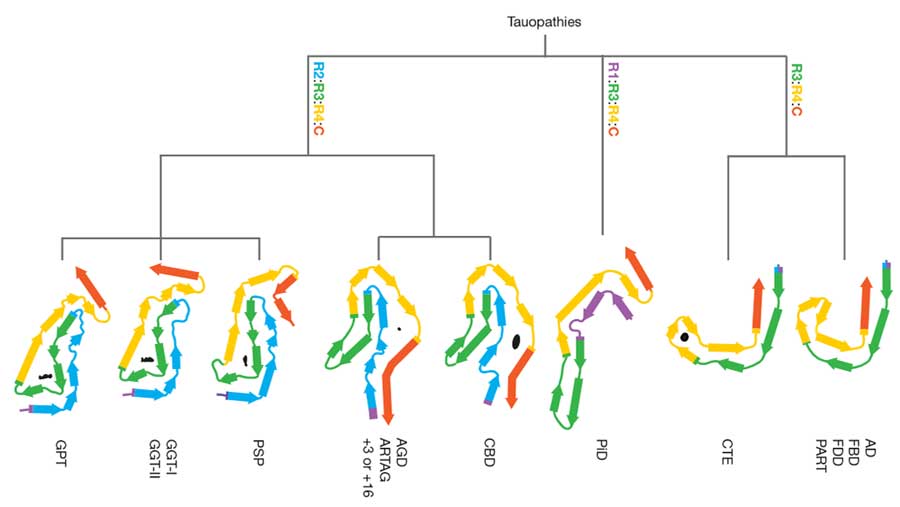
これまで cryo-EM で色々なタウオパチーの構造を解明してきたMichel Goedertらのグループが、cryo-EM上の構造を元にしたタウオパチーの新たな分類を提唱しました。
クライオ電子顕微鏡法(cryo-electron microscopy, cryo-EM)でのフィラメント構造解析については、このブログでも何回かとりあげました。 主に、イギリス・MRC分子生物学研究所の …
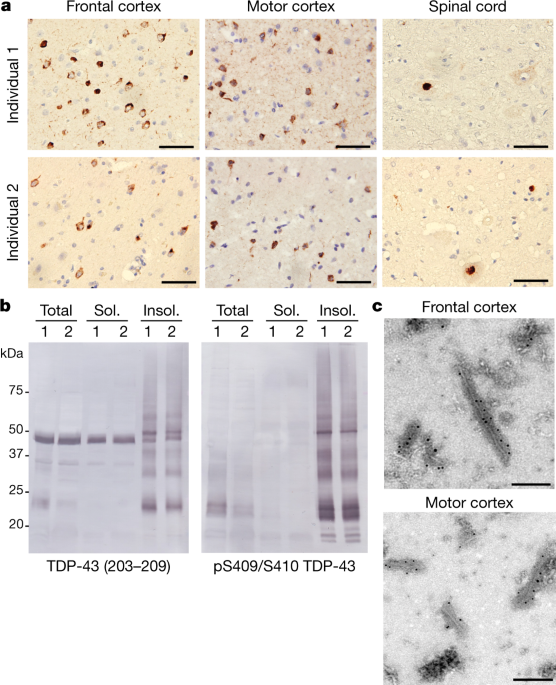
また、TDP-43 凝集体の cryo-EM 構造も報告され、これで主な神経変性疾患の原因タンパク凝集体のほとんどが cryo-EM で解析されたと言えそうです。
Cryo-electron microscopy of aggregated TDP-43 from postmortem brain tissue of individuals who had ALS with FTLD reveals a filament structure with distinct features to other neuropathological protein filaments, such as those of tau and α-synuclein.
ビッグデータ
今まで論文を読んできて、「ビッグデータを扱った研究が最近凄く増えているなー」と思います。
機械学習やAIなどの技術が進んだお陰で、それまでは不可能だった事が可能になってきている印象です。
勿論、頑張って宝探しをしても無駄骨に終わることも多いっぽい印象もありますが、解析手法や出てきた結果などは着実に進歩していると思います。
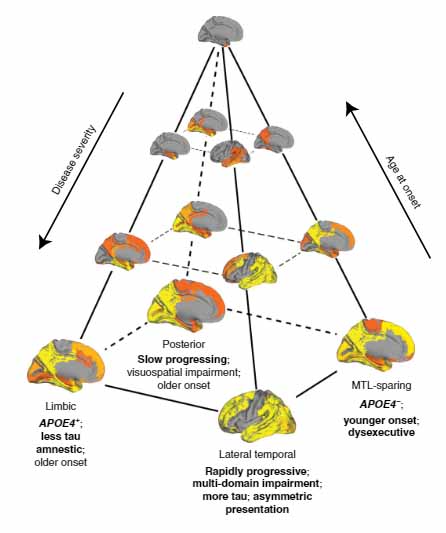
去年報告されたビッグデータからわかった事といえば、RNA-seqでADに3つの異なるタイプ
- Aβプラーク、神経原線維変化、神経炎症を伴う典型的なタイプ
- タウ病変が顕著にみられるタイプ1
- タウ病変が顕著にみられるタイプ2
がある事や、
タウの広がりにも4種類ある事
- 辺縁系タイプ
- 内側側頭葉タイプ
- 後頭葉タイプ
- 外側側頭葉タイプ
などが挙げられます。
アルツハイマー病 (Alzheimer's disease, AD) の主要病理の一つ、神経原線維変化 (neurofibrillary tangles, NFTs) は、主に過リン酸化タウで構成されています。 このタウ …
また、single-nucleus RNA-Seq で、常染色体顕性ADに特有の細胞集団が発見されました。
snRNA-Seq identifies unique subclusters of cells in ADAD. LOAD subclusters are driven by genetic variants—and are different. PU(.1)rification yields massive microglial nuclei haul—with some surprises.
またオミックス解析は、AD脳の初期変化を捉えるためにも使用され、プレプリントの報告では、ADの異なるステージで発現量が変化する53のタンパク質が同定されました。
エンドサイトーシスやシナプスでkのうするタンパクは、前臨床段階で変動しており、さらに45-70歳の健常人トランスクリプトーム解析から、将来ADになりそうなタンパク発現プロファイルを同定しました。
高齢になればなるほどアルツハイマー病 (Alzheimer's disease, AD) に罹患する人たちの数は増えていきますが、 同じ年齢でも AD になる人とならない人がいます(どんな病気でもそうですが。) その原因 …
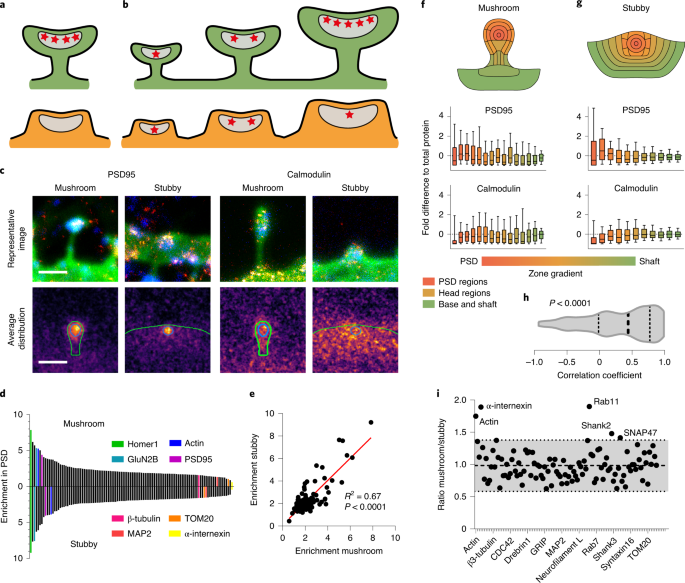
さらに(これは本当に超大作といえると思いますが)、オミックス解析を電験、超解像度顕微鏡、蛍光顕微鏡、質量分析と組み合わせる事で、樹状突起スパインを精密に描画することに成功しました。
この "nanoscopy" 法は、ADやその他の神経変性疾患でシナプスが失われた時に何が起こるかの重要な情報を提示しています。
This work provides a first molecular view of dendritic spines, for both the mushroom and stubby classes, obtained by integrating electron microscopy, quantitative biochemistry, super-resolution microscopy and 3D molecular visualizations.
また、"SynTOF(シナプス質量分析)" と呼ばれる新しい技術により、ADおよびコントロール脳の数百万個の個々のシナプスを分析することができるようになりました。
この研究では、CD47でコーディングされたスパインが、タウ病変を持つ人々で生き残る可能性が高いことを発見しました。
通常、この免疫受容体は癌と関連していますが、脳での研究はあまり進んでいませんでした。もしかしたら、ミクログリアがスパインを刈り取る際に "don't eat me" シグナルを出しているのかもしれません。
Synaptic molecular characterization is limited for Alzheimer’s disease (AD). Our newly invented mass cytometry–based method, synaptometry by time of flight (SynTOF), was used to measure 38 antibody probes in approximately 17 million single-synapse events from human brains without pathologic change or with pure AD or Lewy body disease (LBD), nonhuman primates (NHPs), and PS/APP mice. Synaptic molecular integrity in humans and NHP was similar.
大規模なオミックスプロジェクトでは、特にデータ収集と解析の標準がないため、再現性が問題となります。
そこで昨年、NIHは「ヒト人工多能性幹細胞神経変性疾患イニシアチブ(iNDI)」を発表しました。
IPSCは広く使われており、多くの場合、神経細胞やグリアに分化し、病気のリスクや進行のモデルとして役立っています。
iNDIは、神経変性に関連する134種類の遺伝子変異のいずれかを健康なドナー細胞に持たせ、分化した細胞やデータを利用できるようにするものです。
The iPSC Neurodegenerative Disease Initiative (iNDI) is the largest-ever iPSC genome engineering project. iNDI will model more than 100 mutations associated with Alzheimer’s disease and related dementias (ADRD) in isogenic iPSC lines. Resulting cell lines and phenotypic datasets will be broadly shared.
ウイルスと認知症
去年もCOVID-19がひたすら猛威を奮っていましたが、一方で、COVID-19と認知症に関する研究もたくさん発表されました。
先日のAlzforumで、コロナウイルスの脳内感染についてまとめられていたので、シェア。 内容としては、大きく2つ。 コロナウイルス(SARS-CoV-2)は、脳にも感染するか COVID19に感染後、アル …
新型コロナウイルス(SARS-Cov-2)の脳内感染等についてはこのブログでも何度か取り上げましたが、 現在、新型コロナウイルス感染後遺症の一つ「ブレインフォグ(brain fog)」に悩まされている人が多いという現状を …
報告によると、COVIDは既存の神経変性疾患の病態を悪くする可能性があり、特に ApoE4 キャリアの人たちはコロナウイルスに感染しやすく、重症化もしやすいようです。
• SARS-CoV-2 infects hiPSC-derived neurons, astrocytes, and brain organoids • ApoE4 neurons and astrocytes are more susceptible to SARS-CoV-2 infection • APOE4 astrocytes exhibit a more severe response to SARS-CoV-2 infection • RDV inhibits SARS-CoV-2 infection in neurons and astrocytes
Background: The older population has been especially affected by the severe acute respiratory syndrome coronavirus 2 pandemic (COVID-19). Objective: The aim of the study was to explore the incidence, severity, mortality rate, clinical features, and risk factors of symptoms of COVID-19 in home-dwelling older people, and its association with type of
We previously reported that the ApoE e4e4 genotype was associated with COVID-19 test positivity (odds ratio [OR] = 2.31, 95% CI: 1.65–3.24, p = 1.19 × 10−6) (1)
Four decades ago in 1985, alleles of apolipoprotein E (ApoE) ε2/ε3/ε4 became famous for explaining 16% of genetic variance in low-density lipoprotein cholestero
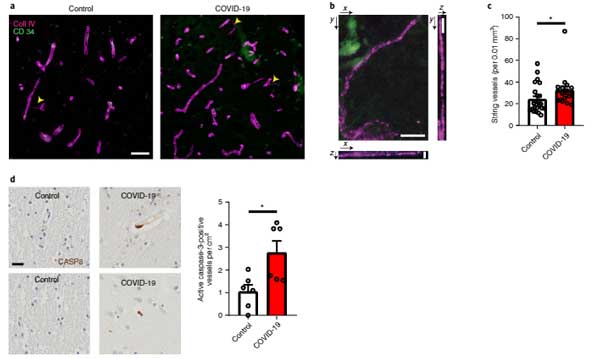
さらに、スパイクを含むSARSキャプシド糖タンパク質は、アミロイド形成タンパク質を拡散させる細胞外小胞の放出を促進する可能性があることもわかりました。
1997年、「狂牛病やクロイツフェルト・ヤコブ病(Creutzheldt-Jakob disease, CJD)ではプリオン蛋白が細胞間を伝播して病態を広げていく」という事を見出した Dr. Prusiner がノーベル …
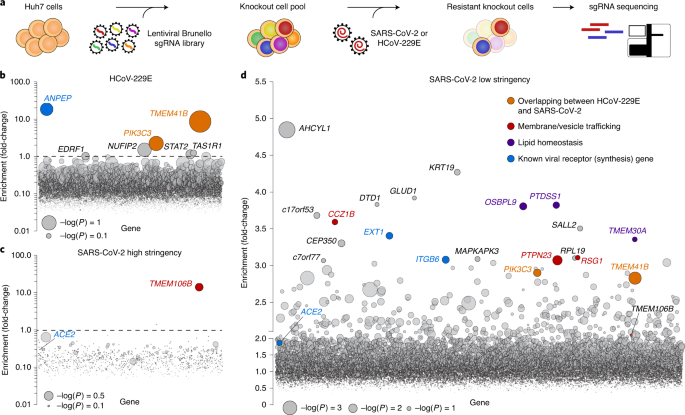
さらに、SARS-CoV-2はライソゾーム受容体TMEM106Bを発現する細胞にのみ感染することが判明しました。
この遺伝子はADやFTDのリスク変異が知られていますが、それがCOVIDに影響するかは未だ不明です。
Genome-wide CRISPR screens for proviral host factors of SARS-CoV-2 and HCoV-229E human coronaviruses show that the lysosomal protein TMEM106B is required for SARS-CoV-2 infection.
• Genome-wide CRISPR screens for SARS-CoV-2 and seasonal coronavirus host factors • Identification of host factors and pathways with pan-coronavirus and discrete roles • Coronaviruses co-opt multiple biological pathways • TMEM41B is a critical pan-coronavirus host factor
• Genome-wide CRISPR screens for SARS-CoV-2, HCoV-229E, and HCoV-OC43 host factors • Screens correctly identified divergent entry factors for the three coronaviruses • Cholesterol and phosphatidylinositol pathways are shared host dependency factors • Pharmacological inhibition of host factors reduces coronavirus replication
他のウイルスについては、単純ヘルペスとADのリスクに関する論争が続いています。
2021年に行われたある研究では、ヨーロッパ4カ国で一貫した相関は認められませんでしたが、スウェーデンの50万人以上を対象とした別の研究では、未治療のヘルペス感染が、特にApoE4キャリアにおける高い認知症リスクに関係していることが示唆されました。
Herpesviruses, including Herpes simplex virus type 1 (HSV1) and varicella zoster‐virus (VZV), have been implicated in Alzheimer's disease (AD) development. Likewise, antiviral treatment has been suggested to protect against dementia development ...
Short-term antiherpetic medication is not markedly associated with incident dementia. Because neither dementia subtype nor herpes subtype modified the association, the small but significant decrease in dementia incidence with antiherpetic administration may reflect confounding and misclassification.
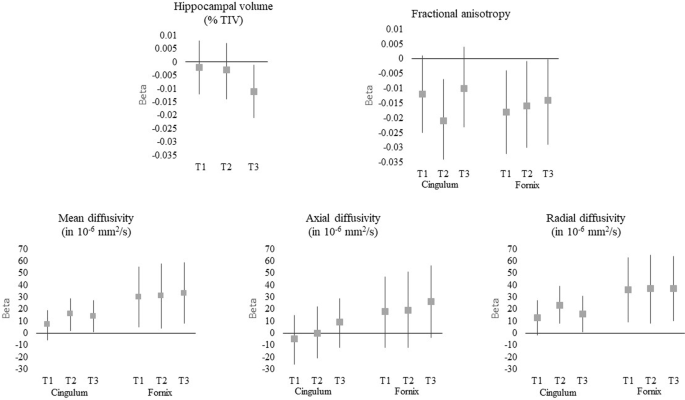
While previous studies suggest the implication of herpes simplex virus (HSV) in the onset of Alzheimer’s disease (AD), no study has investigated its association with early neuroimaging markers of AD. In the Three-City and the AMI cohorts, the associations between HSV infection and (i) hippocampal volume (n = 349), (ii) white matter alterations in the parahippocampal cingulum and fornix using diffusion tensor imaging (n = 260), and (iii) incidence of AD (n = 1599) were assessed according to APOE4 status. Regardless of APOE4 status, infected subjects presented (i) significantly more microstructural alterations of the parahippocampal cingulum and fornix, (ii) lower hippocampal volumes only when their anti-HSV IgG level was in the highest tercile—reflecting possibly more frequent reactivations of the virus (p = 0.03 for subjects with a high anti-HSV IgG level while there was no association for all infected subjects, p = 0.19), and (iii) had no increased risk of developing AD. Nevertheless, among APOE4 carriers, infected subjects presented lower hippocampal volumes, although not significant (p = 0.09), and a two or three times higher risk of developing AD (adjusted Hazard ratio (aHR) = 2.72 [1.07–6.91] p = 0.04 for infected subjects and aHR = 3.87 [1.45–10.28] p = 0.007 for infected subjects with an anti-HSV IgG level in the highest tercile) while no association was found among APOE4 noncarriers. Our findings support an association between HSV infection and AD and a potential interaction between HSV status and APOE4. This reinforces the need to further investigate the infectious hypothesis of AD, especially the associated susceptibility factors and the possibility of preventive treatments.
個人的な振り返り
こうしてAlzforumの1年のまとめ記事を眺めていると、ほとんどの内容は把握していましたが、記事にするつもりでそのまま書かなかった論文も多かったなーと思いました。
単純にテクニシャンが外れて執筆作業に宛がう時間が激減した、という事が理由ではありますが、
書かないくらいだったらさらっとでも書いた方が良さそうだなー、と思います。
Twitterではほぼ毎日配信していましたが、やっぱり記事にした方が、自分の理解が曖昧な部分も可視化されるし、記憶の定着も良いようです。
とゆーことで、今年は「さらっとでも書く」事を目標の1つに加えようと思いました。










































いつも楽しく拝見しています!
また、私は学生であり大変学ばせて頂いております。
一人抄読会は毎日のように更新を楽しみにしておりますが、心身ともにどうぞご自愛ください。
ありがとうございます。そう言っていただけると大変励みになります。
わかりにくい点などありましたら、いつでもコメントしてください。私にとっても勉強になりますので。
今後とも宜しくお願い致します。