新型コロナウイルス(SARS-Cov-2)の脳内感染等についてはこのブログでも何度か取り上げましたが、
先日のAlzforumで、コロナウイルスの脳内感染についてまとめられていたので、シェア。 内容としては、大きく2つ。 コロナウイルス(SARS-CoV-2)は、脳にも感染するか COVID19に感染後、アル …
1997年、「狂牛病やクロイツフェルト・ヤコブ病(Creutzheldt-Jakob disease, CJD)ではプリオン蛋白が細胞間を伝播して病態を広げていく」という事を見出した Dr. Prusiner がノーベル …
現在、新型コロナウイルス感染後遺症の一つ「ブレインフォグ(brain fog)」に悩まされている人が多いという現状を考えると、
やはりSARS-Cov-2は脳内に感染し、障害を起こす可能性がある、と考えた方がよさそうです。
今回、ドイツ・リューベック大学の Dr. Schwaniger らの研究グループは、
「SARS-Cov-2は脳の毛細血管に感染し、脳内の微小血管障害をきたす」
という内容の研究結果を報告しました。

新型コロナウイルス感染で脳の微小血管が障害される
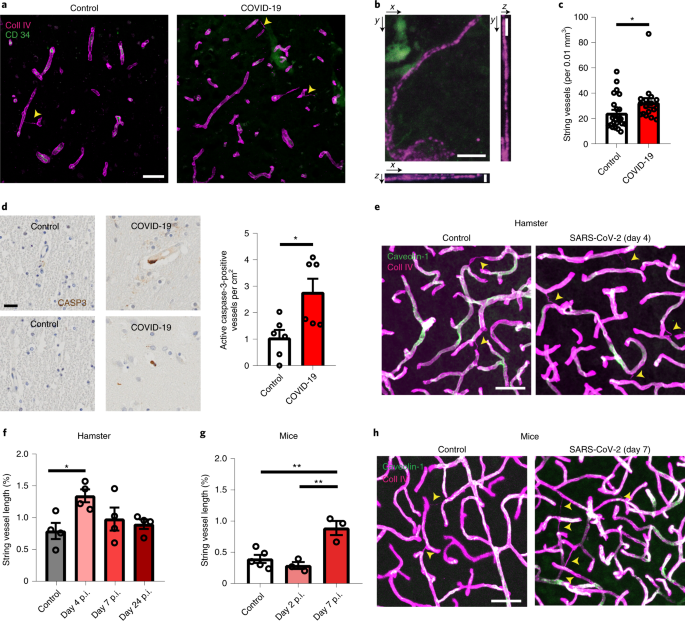
SARS-Cov-2感染脳では微小血管が障害されている
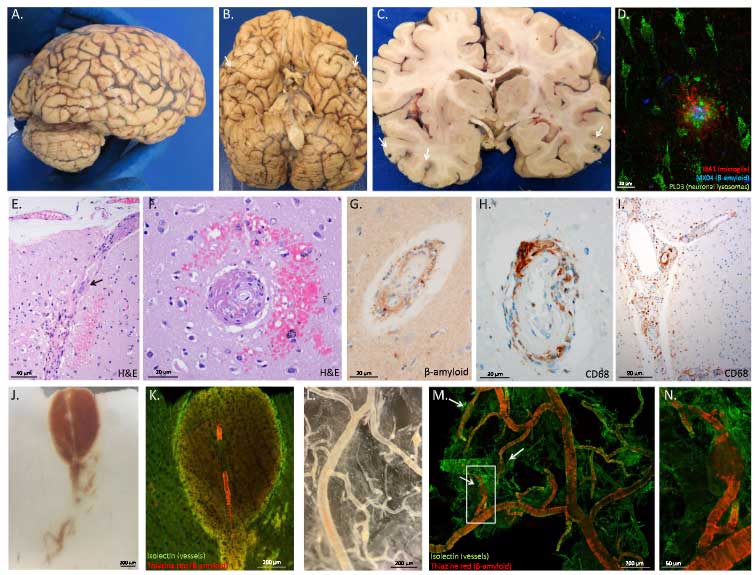
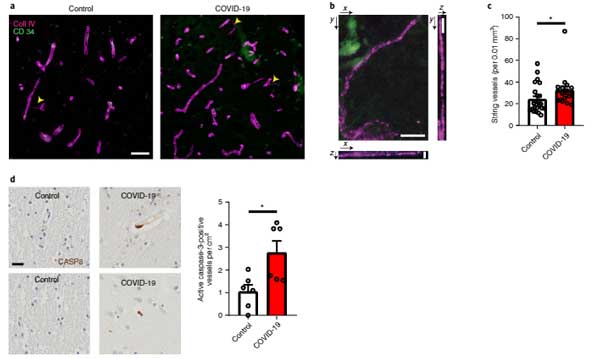
まず彼らは、新型コロナウイルス感染で亡くなった患者さんの脳内の血管を調べ、毛細血管が壊れた残骸(基底膜の管はあるのに、血管を構成する細胞がない構造物)である「string vessesl」が増えている事を確認しました。
またそれらの部分では、アポトーシス反応を示す、活性型のカスパーゼ3が多く発現していました。

SARS-Cov-2に感染させたハムスターやhACE2+マウスでも同様の結果を示し、
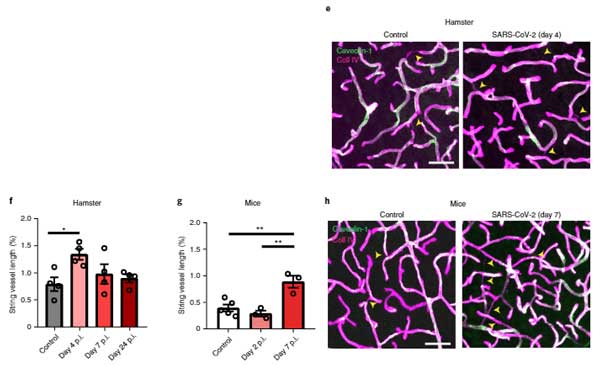
「SARS-Cov-2は脳内の毛細血管を傷害する」
という可能性が示唆されました。
SARS-Cov-2は毛細血管に感染する
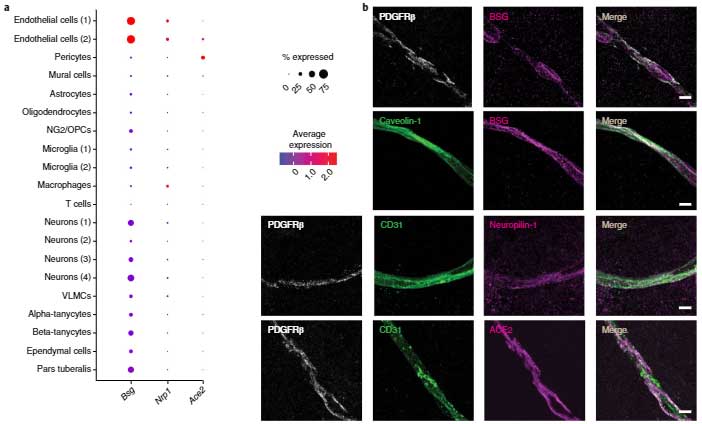
SARS-Cov-2が本当に毛細血管に感染できるかどうか、SARS-Cov-2のレセプターと言われている ACE2の発現を調べました。
すると、ACE2は主に毛細血管のペリサイトで発現しており、内皮細胞でも少し発現していました。
また他に可能性のありそうなタンパクを調べると、Nrp1とBsgも発現を認めました。
SARS-Cov-2が内皮細胞に感染するか調べるため、彼らはhCMEC/D3細胞にACE2を発現させ、SARS-Cov-2を培地に加えてみました。
すると、細胞内の各周囲にスパイクタンパクを認め、これは既報の、SARS-Cov-2が感染した肺内皮細胞の様子と一致しました。
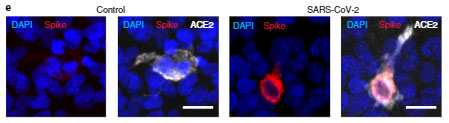
さらに新型コロナウイルス感染後の患者さんの脳内でも、内皮細胞にスパイクタンパクやdsRNAを認め、
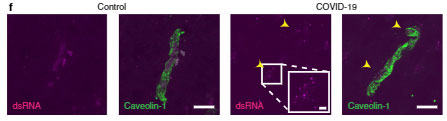
「SARS-Cov-2は脳の内皮細胞に感染する」
可能性が示唆されました。
SARS-Cov-2が保有するカスパーゼ「Mpro」は、内皮細胞のNEMOを分解する
SARS-Cov-2が脳内の毛細血管に感染し、微小血管障害をきたす原因を探るため、著者らは、抗ウイルス免疫反応であるNEMOに注目し、
「SARS-Cov-2がNEMOを切断するのかも」
と仮説を立てました。
実際、NEMOはSARS-Cov-2を感染させたVero E6やhCMEC/D3細胞で分解されており、実際の人の脳でもNEMOの分解の程度が多くなっているようでした。
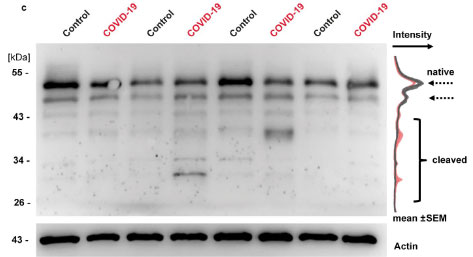
SARS-Cov-2が保有する2つのカスパーゼ
- Mpro
- papain-linke protease
のうち、Mproに注目し、MproがNEMOを切断するかどうか調べました。
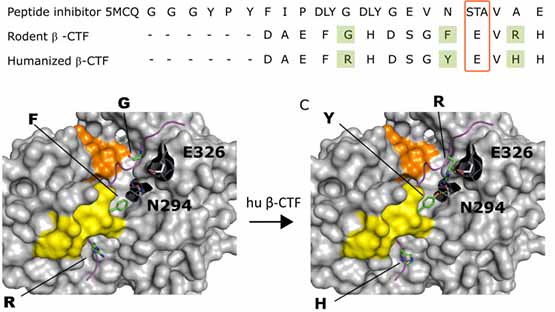
すると彼らの予想通り、MproはNEMOを用量依存的に分解しました。
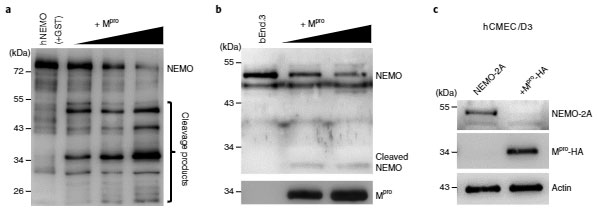
質量分析法 (mass spectrometry, MS)では、5箇所のNEMO切断部位が確認され、そのうちQ231がMproのNEMO切断部位として最も可能性が高そうでした。
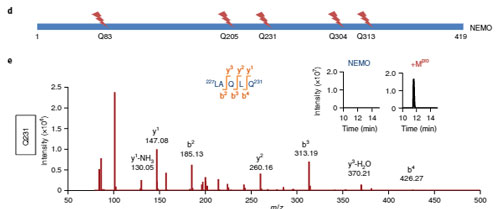
NEMOは、インターロイキン(IL)-1βなどを介して、NF-κBを活性化するので、MproがNEMOを分解してNF-κB活性を阻害するかどうか調べました。
hCMEC/D3細胞にMproを処置すると、NF-κBのサブユニットp65の核内移行は阻害され、フィードバックとしてIL-1βの転写も阻害されました。
同様の結果は、マウス内皮細胞のbEnd.3でも確認され、
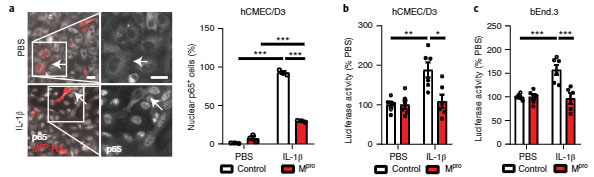
「Mproは、NEMOを切断してその機能を阻害する」
という可能性が示唆されました。
Mproは微小血管障害を起こす
以上の事がわかったので、著者らは新型コロナウイルス感染患者さんの脳内でみられるような微小血管障害が、実際にMproによって再現できるかどうか調べました。
彼らはhCMECD3細胞にHAタグを付けたMproU(Mpro-HA)をトランスフェクションし、新型コロナウイルス感染患者さんの脳内の状態 [2]を再現するために tumor necrosis factor (TNF) を添加しました。
結果、より多くのTUNEL+細胞死を認め、
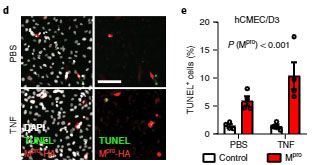
「Mproは内皮細胞を障害する」
という可能性が示唆されました。
また、Mproの触媒部位である Cys145 をアラニンに変えて(p.Cys145Ala-Mpro)Mproの機能を阻害すると、MproはNEMO-2Aを切断しなくなり、
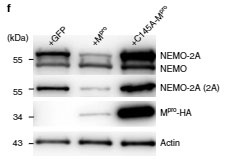
さらにNF-κB活性やIL-1βも阻害しなくなり
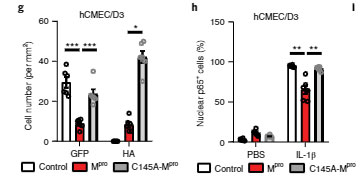
「NEMOの切断および細胞障害は、Mproのプロテアーゼ活性が関係している」
という可能性が考えられました。
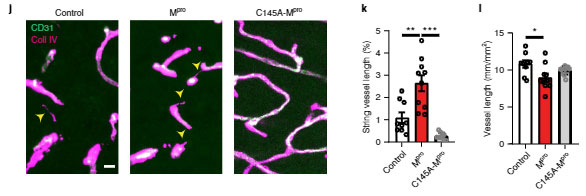
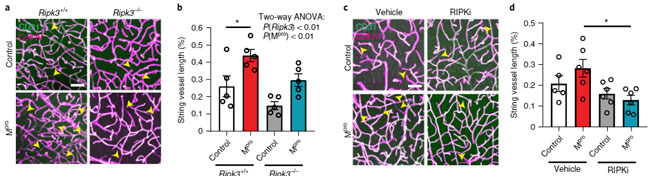
MproをAAV-BR1ベクターに組み込んで(AAV-BR1-Mpro)マウス脳内に注入したところ、同部位に string vessels を数多く認め、新型コロナウイルス感染患者さんの脳内を再現できました。
この効果は p.Cys145Ala-Mpro では起こらず、vitro と同じ結果が vivo でも再現できました。
NEMOを欠失すると、微小血管が死ぬ
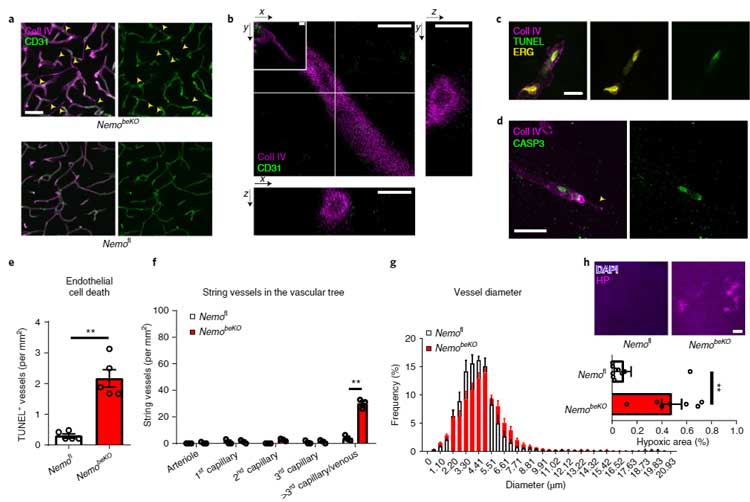
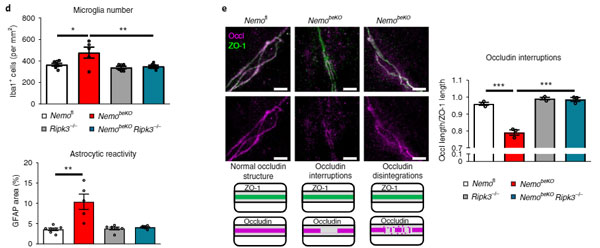
NEMOの微小血管における重要性を調べるため、著者らはNEMOを欠失したマウス(NemobeKO)の毛細血管を調べました。
Mproを過剰発現させたときと同じく、NemobeKOマウスでは string vessels の数が増えており、
特に細動脈の始めの方の分岐血管の内皮細胞でアポトーシスが亢進していました(TUNEL+細胞↑, カスパーゼ3活性↑)。
NEMO欠失により、PIPKシグナルを介して血管病理が誘導される
NEMOは内皮細胞のアポトーシスやネクローシスを抑えるという報告があるので [3]、
著者らは、その既報で言われている2つの経路
- Fas-associated death domain protein (FADD)
- PIPK2 (ネクローシスとアポトーシスへ導く重要なシグナルの一つ)
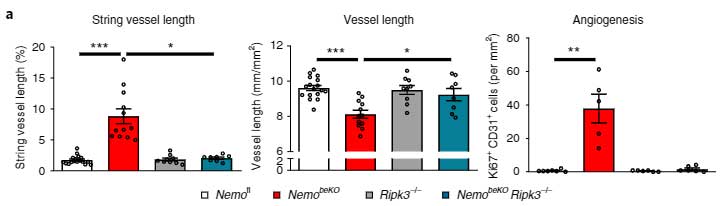
を、NemobeKOマウスでそれぞれ欠失させて効果を確認しました。
すると、FADD 欠失の方では特に変化がアリませんでしたが、PIPK3を欠失させるとNEMObeKOマウスの string vessels が減りました。
また、
- 新型コロナウイルス感染者脳内で多くみられる反応性血管新生 [4]
- ミクログリオーシス
- アストロサイトグリオーシス
- 血液脳関門(blood-brain barrier, BBB)の障害
などがNemobeKOで悪化していましたが、Pipk3欠失によりレスキューされました。
さらに、Mproによる微小血管障害も、Pipk3欠失によりレスキューされました。
・
・
・
以上の結果から、
SARS-Cov-2の脳血管内皮細胞感染
↓
SARS-Cov-2のMpro
↓
NEMOの切断↑
↓
PIPK3経路のシグナル↑
↓
血管内皮細胞死、string vessels
というメカニズムが考えられ、
「PIPK3を抑制する事で、新型コロナウイルス感染による血管障害を防げる可能性」
が示唆されました。
A novel study led by scientists in Lübeck, Germany, shows that SARS-CoV-2-infected brain endothelial cells undergo cell death due to the cleavage of NEMO by the viral protease Mpro, potentially causing cerebral COVID-19 and ‘long COVID’ symptoms.
References
- Wenzel J, Lampe J, Müller-Fielitz H, Schuster R, Zille M, Müller K, Krohn M, Körbelin J, Zhang L, Özorhan Ü, Neve V, Wagner JUG, Bojkova D, Shumliakivska M, Jiang Y, Fähnrich A, Ott F, Sencio V, Robil C, Pfefferle S, Sauve F, Coêlho CFF, Franz J, Spiecker F, Lembrich B, Binder S, Feller N, König P, Busch H, Collin L, Villaseñor R, Jöhren O, Altmeppen HC, Pasparakis M, Dimmeler S, Cinatl J, Püschel K, Zelic M, Ofengeim D, Stadelmann C, Trottein F, Nogueiras R, Hilgenfeld R, Glatzel M, Prevot V, Schwaninger M. The SARS-CoV-2 main protease Mpro causes microvascular brain pathology by cleaving NEMO in brain endothelial cells. Nat Neurosci. 2021 Nov;24(11):1522-1533. doi: 10.1038/s41593-021-00926-1. Epub 2021 Oct 21. PMID: 34675436; PMCID: PMC8553622.
- Hadjadj J, Yatim N, Barnabei L, Corneau A, Boussier J, Smith N, Péré H, Charbit B, Bondet V, Chenevier-Gobeaux C, Breillat P, Carlier N, Gauzit R, Morbieu C, Pène F, Marin N, Roche N, Szwebel TA, Merkling SH, Treluyer JM, Veyer D, Mouthon L, Blanc C, Tharaux PL, Rozenberg F, Fischer A, Duffy D, Rieux-Laucat F, Kernéis S, Terrier B. Impaired type I interferon activity and inflammatory responses in severe COVID-19 patients. Science. 2020 Aug 7;369(6504):718-724. doi: 10.1126/science.abc6027. Epub 2020 Jul 13. PMID: 32661059; PMCID: PMC7402632.
- Kondylis V, Kumari S, Vlantis K, Pasparakis M. The interplay of IKK, NF-κB and RIPK1 signaling in the regulation of cell death, tissue homeostasis and inflammation. Immunol Rev. 2017 May;277(1):113-127. doi: 10.1111/imr.12550. PMID:28462531.
- Ackermann M, Verleden SE, Kuehnel M, Haverich A, Welte T, Laenger F, Vanstapel A, Werlein C, Stark H, Tzankov A, Li WW, Li VW, Mentzer SJ, Jonigk D. Pulmonary Vascular Endothelialitis, Thrombosis, and Angiogenesis in Covid-19. N Engl J Med. 2020 Jul 9;383(2):120-128. doi: 10.1056/NEJMoa2015432. Epub 2020 May 21. PMID: 32437596; PMCID: PMC7412750.