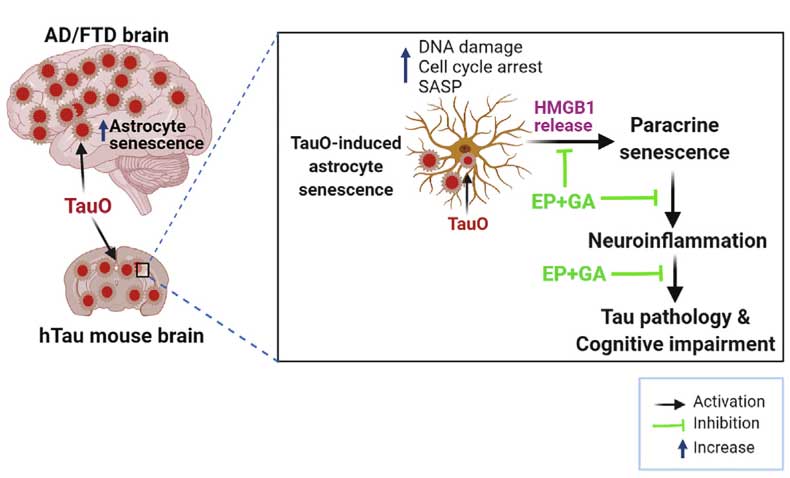
神経変性疾患分野では、老化細胞 (senescent cells) への注目が集まっていると思います。
このブログでも何度か取り上げましたが、 老化細胞(senescent cells)の除去(senolysis)は、アンチエイジングだけでなく、加齢に伴う様々な疾患の予防・治療ターゲットとして注目されています [1, 2] …
中脳黒質緻密部のドパミン神経細胞の変性は、加齢と共に進行し、とくにパーキンソン病(Parkinson's disease, PD)に特徴的である。 加齢はPDの最も大きなリスク因子である事から、アメリカ・フロリダ医科大学 …
Aβプラークはアルツハイマー病(Alzheimer's disease; AD)のhallmarkである。 NIHのZhang, Mattsonらは、AD患者の脳内およびADマウスモデル(APP/PS1)の脳内を調べ、A …
以前、老化したグリアを除去するとモデルマウスのタウ病理と認知機能が改善したという論文を紹介しましたが、
細胞の老化は不可逆的な細胞周期の停止に特徴的な分泌の表現型を伴う現象で、様々な細胞内および細胞外の要因から引き起こされる。 p16INK4Kという細胞周期停止タンパクは、加齢に伴う組織の変性を促し、動脈硬化や関節炎などに …
今回は、そのメカニズムに注目した論文。
アメリカ・テキサス大学の Dr. Kayed らの研究グループは、アルツハイマー病 (Alzheimer's disease, AD) や 前頭側頭葉変性症(Frontotemporal lobar degeneration, FTLD)の患者さん脳内でアストロサイトが老化しており、
老化アストロサイトがタウ病理や神経障害などを引き起こす機序に high mobility group box 1 (HMGB1) Glossary参照 が関与することを報告しました [1]。

タウのオリゴマーはアストロサイトの老化および HMGB1 分泌を促し、神経障害や認知機能障害を悪化させる
AD と FTLD の脳内ではアストロサイトがタウオリゴマーを取り込み、老化している
著者らは、
- AD (n=8)
- FTLD (n=6)
- age-matched コントロール (n=8)
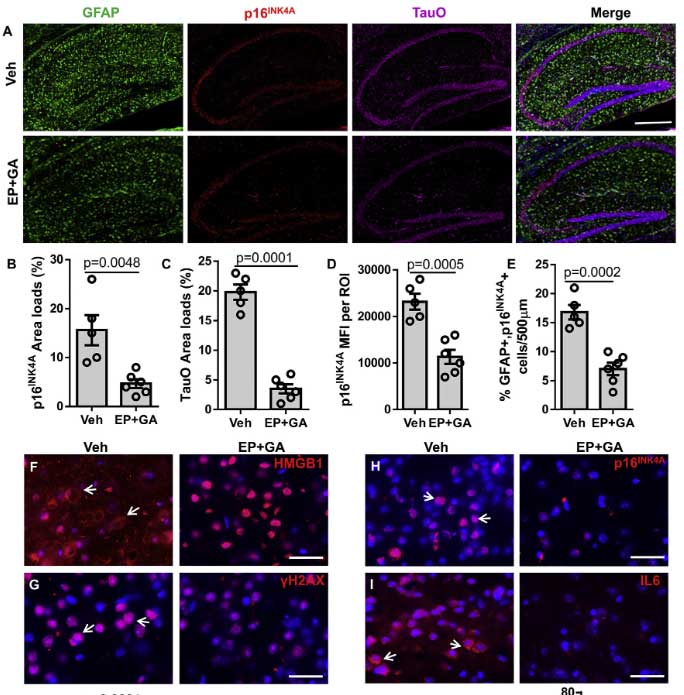
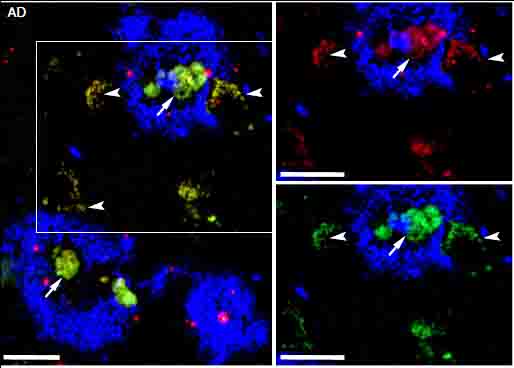
の脳内を調べ、AD と FTLD の患者さん脳内で GFAP陽性アストロサイトにタウオリゴマー (TOMA [2]) が取り込まれている事、その部分と共局在するように老化マーカーの p16INK4A が増加していることを確認しました。
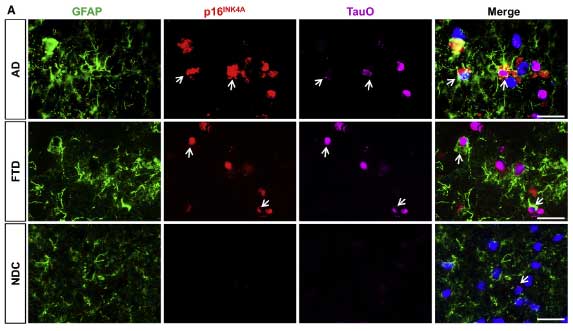
タウオリゴマーはアストロサイトの HMGB1 分泌を促す
次に著者らは、アストロサイトの初代培養細胞にタウオリゴマーを処置し、
HMGB1の一部が核→細胞質へ局在変化すること、p16INK4A の発現が増える事を確認しました。
また、タウオリゴマー処置後の培養アストロサイトの培地を別のアストロサイトに処置すると同様に p16INK4A が誘導され、この現象は HMGB1 抗体によって抑制されました。
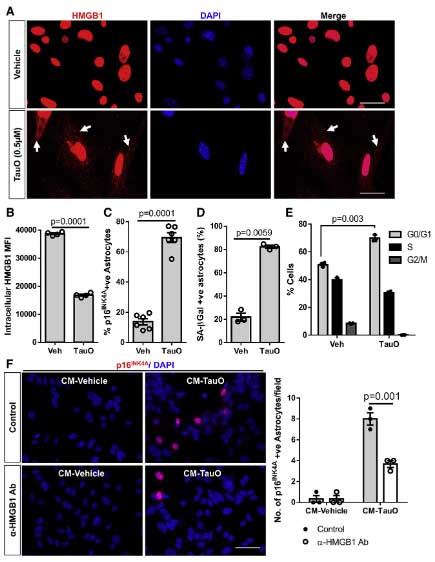
タウオリゴマー
↓
アストロサイト内での HMGB1 の局在変化および細胞外への分泌 ↑
↓
p16INK4A ↑
の流れが示唆されました。
HMGB1 を抑制すると、アストロサイトの老化が改善する
更に著者らは、初代培養アストロサイトに HMGB1 阻害薬の EP (10mM) と GA (250 mM) を処置し、その30分後にタウオリゴマーを処置して HMGB1 阻害効果を確認しました。
フローサイトメトリーで p16INK4A陽性アストロサイトの数を確認すると、EP, GA 単独でも減少していましたが、両方処置でさらに減少していました。
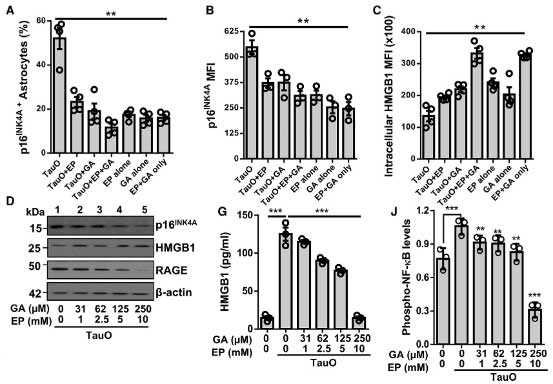
また、EP + GA 処置により、タウオリゴマー処置によって増加した IL-6 や TNF-α などの炎症性サイトカインの分泌も抑制されました。

HMGB1 分泌を抑制すると、タウマウスのタウ病理、細胞老化、神経炎症が改善する
最後に著者らは、HMGB1 阻害がタウオリゴマーによるアストロサイトの老化を防げるかどうか、hTau マウスを使って確認しました。
hTau マウスは 12 ヶ月で神経原性変化やグリオーシス、神経変性、認知機能低下を認めます。
このマウスに EP (90 mg/kg) + GA (20 mg/kg) を1週間に3回、8週間かけて腹腔内投与しました。
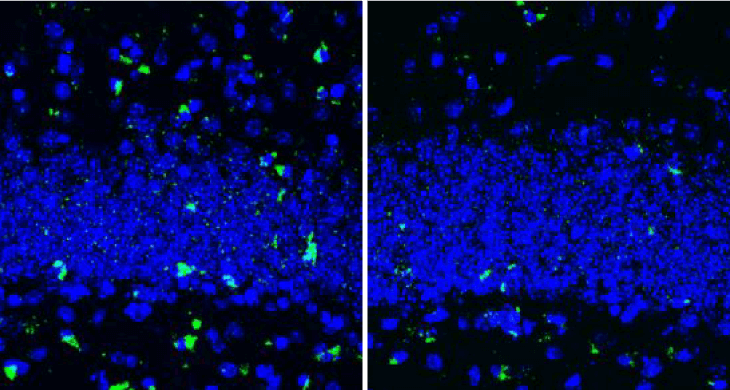
p16INK4A の発現は、hTau マウス内でアストロサイトだけでなくニューロンでも増えており、タウオリゴマーの局在と一致しました。
EP + GA を投与したマウスでは、リン酸化タウや神経変性などが改善しており、
novel-object recognition テストや Y-maze テストでの認知機能障害も改善しました。
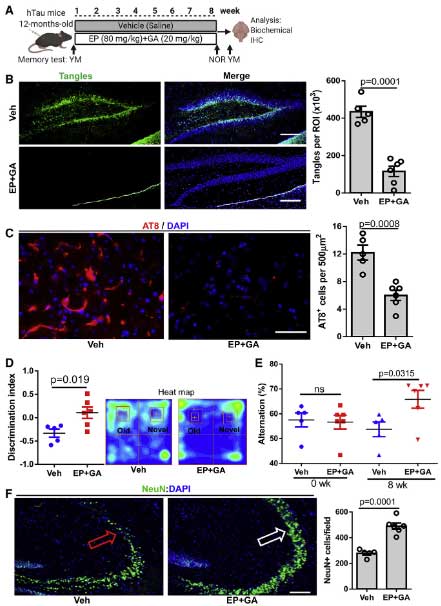
EP + GA 投与群では、HMGB1 の局在変化の改善および全体の p16INK4A 発現量減少も認めました。
以上の結果から、
タウオリゴマー
↓
アストロサイトがタウオリゴマーを取り込み、老化
↓
老化アストロサイトからの HMGB1 分泌
↓
神経炎症、タウ病理の悪化、神経障害、認知機能障害
の流れが考えられ、EP や GA などの HMGB1 阻害薬が AD や FTLD などのタウオパチーへの治療薬候補となる可能性が考えられました。

Gaikwad S, Puangmalai N, Bittar A, Montalbano M, Garcia S, McAllen S, Bhatt N, Sonawane M, Sengupta U, Kayed R. Tau oligomer induced HMGB1 release contributes to cellular senescence and neuropathology linked to Alzheimer's disease and frontotemporal dementia. Cell Rep. 2021 Jul 20;36(3):109419. doi: 10.1016/j.celrep.2021.109419. PMID: 34289368; PMCID: PMC8341760.
My View
Graphical Abstract が面白そうだったので読んでみましたが、実験内容に穴が多くて、正直「これだけの結果でここまで言っていいのかなー。」と思ってしまいました(関係者の人がこの記事を読んでいない事を祈ります)。
まず最初に使っているタウオリゴマーの抗体 (TOMA) ですが、私は実際に使った事はないですが、オリゴマーへの特異性は低いと聞いたことがあります。
人の脳をTauO で染色していますが、本当にオリゴマーだったらこんな凝集体みたいに染色されるんじゃなくて、もっと点状に染色されるように思います。可溶性タウオリゴマーというより不溶性のタウフィブリルと言われた方がまだ納得する感じ。
著者らは最初からアストロサイト狙いで研究を進めていますが、ニューロンはどんな感じに染色されるかとか、他のタウ抗体(リン酸化やコンフォメーション抗体など)でも確認した方がいいんじゃないかとか、色々気になりました。
またマウスの実験でも TOMA で染めていますが、海馬は見事に歯状回の顆粒細胞層が染まっており、GFAP とのマージはかなり少ない印象です。
「彼らがタウオリゴマーと言って掲示した画像に写っているもの達は、本当は何なんだろう?」と疑問が残りました。
また、タウオリゴマーをアストロサイトに処置して HMGB1 の分泌が増え、p16INK4A の発現を誘導、というストーリーですが、
HMGB1 抗体で減ったから、というだけで直接 HMGB1 を見に行っていないので、「なんで見に行かなかったんだろ?見に行ったけどいい結果が得られなかったのかな?」と、ちょっと邪推したりしました。
最後のマウスの実験では、EP + GA で色々改善していますが、神経炎症やタウ病理増加などの機序が詰められていない感じがあって、「うーん……」と若干不完全燃焼。
ストーリー自体は面白そうなんだけどなー。
Glossary
high mobility group box 1 (HMGB1)
核タンパクで、グリアやニューロンに発現 [2]。
HMBG1 は、DNA修復、複製、ヌクレオソーム構造、転写などに重要な働きを持つ [4]。
HMBG1欠失マウスは生後すぐに死亡し、強い低血糖をきたす [5]。
HMGB1 の「核 → 細胞質」移行は、senescence の最初のステージと考えられており [6, 7]、タウオリゴマーは、HMGB1の核→細胞質への移行を誘導する。
HMGB1 は AD 患者さんの CSF 中でも増加している [3]。
老化細胞は、HMGB1を細胞外に分泌して [7] Damage-associated molecular pattern (DAMP) として働き、
ターゲット細胞の receptor for advanced glycation end products (RAGE) や Toll-like receptor 4 (TLR4) を活性化して炎症性サイトカイン (IL-1β, IL-6, TNF-α etc.) の分泌を促す [7, 8, 9]。
References
- Gaikwad S, Puangmalai N, Bittar A, Montalbano M, Garcia S, McAllen S, Bhatt N, Sonawane M, Sengupta U, Kayed R. Tau oligomer induced HMGB1 release contributes to cellular senescence and neuropathology linked to Alzheimer's disease and frontotemporal dementia. Cell Rep. 2021 Jul 20;36(3):109419. doi: 10.1016/j.celrep.2021.109419. PMID: 34289368; PMCID: PMC8341760.
- Montalbano M, McAllen S, Puangmalai N, Sengupta U, Bhatt N, Johnson OD, Kharas MG, Kayed R. RNA-binding proteins Musashi and tau soluble aggregates initiate nuclear dysfunction. Nat Commun. 2020 Aug 27;11(1):4305. doi: 10.1038/s41467-020-18022-6. PMID: 32855391; PMCID: PMC7453003.
- Lotze MT, Tracey KJ. High-mobility group box 1 protein (HMGB1): nuclear weapon in the immune arsenal. Nat Rev Immunol. 2005 Apr;5(4):331-42. doi: 10.1038/nri1594. PMID: 15803152.
- Calogero S, Grassi F, Aguzzi A, Voigtländer T, Ferrier P, Ferrari S, Bianchi ME. The lack of chromosomal protein Hmg1 does not disrupt cell growth but causes lethal hypoglycaemia in newborn mice. Nat Genet. 1999 Jul;22(3):276-80. doi: 10.1038/10338. PMID: 10391216.
- Paudel YN, Shaikh MF, Chakraborti A, Kumari Y, Aledo-Serrano Á, Aleksovska K, Alvim MKM, Othman I. HMGB1: A Common Biomarker and Potential Target for TBI, Neuroinflammation, Epilepsy, and Cognitive Dysfunction. Front Neurosci. 2018 Sep 11;12:628. doi: 10.3389/fnins.2018.00628. PMID: 30271319; PMCID: PMC6142787.
- Kim DE, Davalos AR. Alarmin Detection in Senescent Cells. Methods Mol Biol. 2019;1896:71-81. doi: 10.1007/978-1-4939-8931-7_8. PMID: 30474841.
- Davalos AR, Kawahara M, Malhotra GK, Schaum N, Huang J, Ved U, Beausejour CM, Coppe JP, Rodier F, Campisi J. p53-dependent release of Alarmin HMGB1 is a central mediator of senescent phenotypes. J Cell Biol. 2013 May 13;201(4):613-29. doi: 10.1083/jcb.201206006. Epub 2013 May 6. PMID: 23649808; PMCID: PMC3653366.
- Basisty N, Kale A, Jeon OH, Kuehnemann C, Payne T, Rao C, Holtz A, Shah S, Sharma V, Ferrucci L, Campisi J, Schilling B. A proteomic atlas of senescence-associated secretomes for aging biomarker development. PLoS Biol. 2020 Jan 16;18(1):e3000599. doi: 10.1371/journal.pbio.3000599. PMID: 31945054; PMCID: PMC6964821.
- Salminen A, Kauppinen A, Kaarniranta K. Emerging role of NF-κB signaling in the induction of senescence-associated secretory phenotype (SASP). Cell Signal. 2012 Apr;24(4):835-45. doi: 10.1016/j.cellsig.2011.12.006. Epub 2011 Dec 11. PMID: 22182507.



このhTauマウス自体が微妙という話を聞いたことがあります。GFPが発現していることが影響しているのかも。同様のTgでGFPが発現しないものは、それだけではNFTも神経脱落も見られませんので。
そうなんですね!
私も、hTau や 6hTau はそれだけでは表現型がでないって言われているのに、なんでNFTやら神経脱落やらみられるんだろ?って思っていました。
教えていただきありがとうございます。