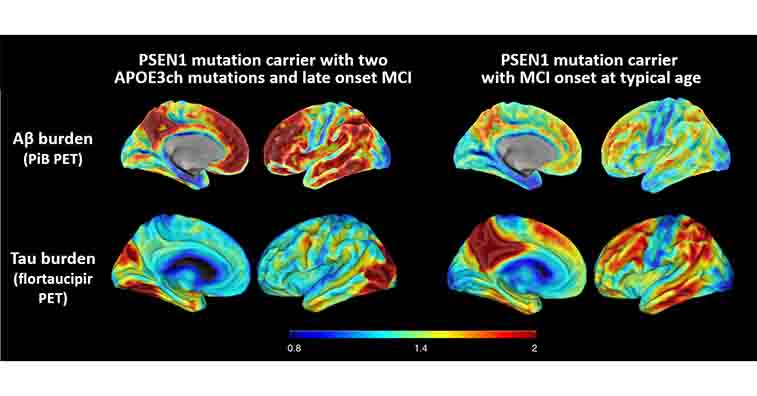
以前、PSEN1-E280A変異という強力な家族性アルツハイマー病(Alzheimer's disease, AD)の遺伝子変異を持ちながら、70歳まで認知症を発症しなかった、APOE3 R136S変異(Chistchurch変異、APOE3ch)の症例 [1] について取り上げましたが、
Presenilin1 E280A変異(PSEN1 E280A)は家族性アルツハイマー病(Familial Alzheimier's disease: FAD)の原因となる最も多い遺伝子変異である。 ハーバード大学のAr …
今回、米国ワシントン大学のDr.Holzmanらは、APOE3chのモデルマウスを作製し、マウスでもAD病理が少なくなることを報告しました [2]。
APOE3chマウスは、APOE3マウスよりもAD病理が軽い
彼らは、ヒトAPOE3をノックインしたマウス(hAPOE3)とヒトAPOEchをノックインしたマウス(hAPOE3ch)を作製し、両者を比較しました。
APOE3chマウスはVLDLコレステロール値が高くなる
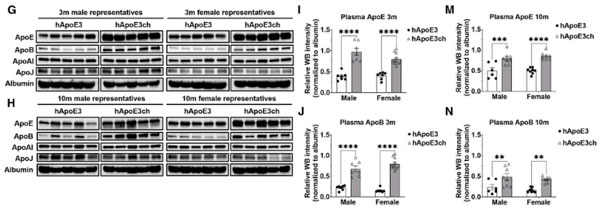
hAPOE3chマウスは、オスは3ヶ月齢、メスは10ヶ月齢の時点で、hAPOE3マウスよりも体重が増加し、症例報告と同じように、超低密度リポ蛋白質(very low density lipoprotein, VLDL)コレステロール値が高くなりました。
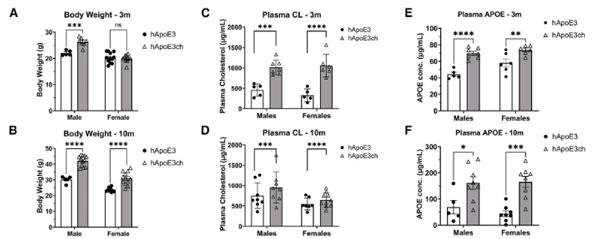
また、血漿中のAPOEやAPOBの量も、hAPOE3chマウスで増加していました。
APOE3chマウスは、Aβの沈着、Neuritic plaques、活性化ミクログリアの集簇が減少する
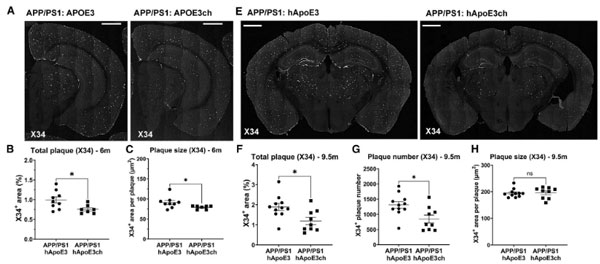
彼らはhAPOE3/hAPOE3chマウスをAPP/PS1マウスと交配し(APP/PS1:hAPOE3, APP/PS1:hAPOE3ch)、Aβの沈着を比較しました。
6ヶ月齢の時点で、APP/PS1:hAPOE3に比べてAPP/PS1:hAPOE3chでAβプラークの数と大きさが減少し、9ヶ月齢では更にその差が広がりました。

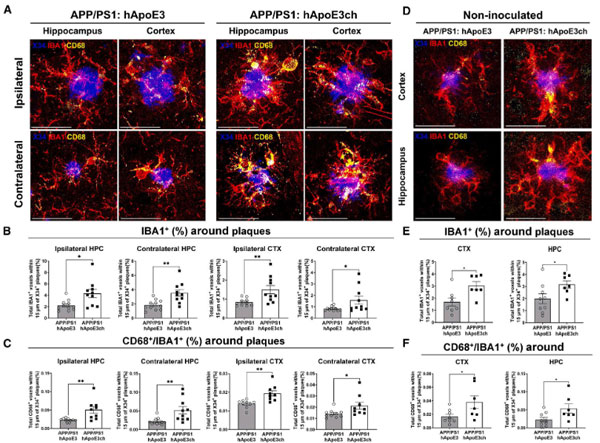
更にこれらのマウス6ヶ月齢にアルツハイマー病患者から抽出したタウ凝集体(ADタウ)を脳内接種すると、APP/PS1:hAPOE3chマウスではタウの脳内伝播や、Aβプラーク周囲のNeuritic Plaqueの量が抑えられました。
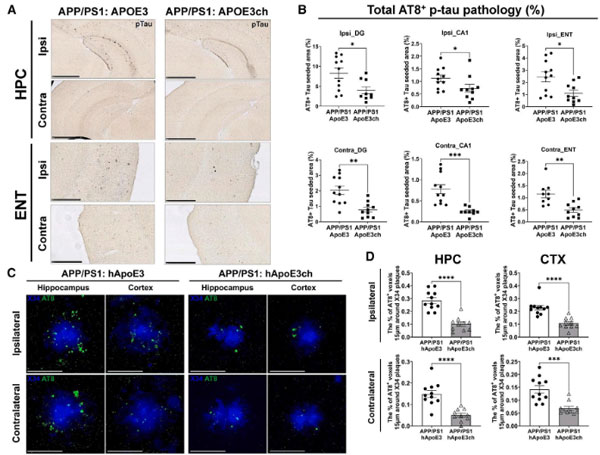
また、Aβプラーク周囲の活性化ミクログリアの集簇もAPP/PS1:hAPOE3chで抑制されました。
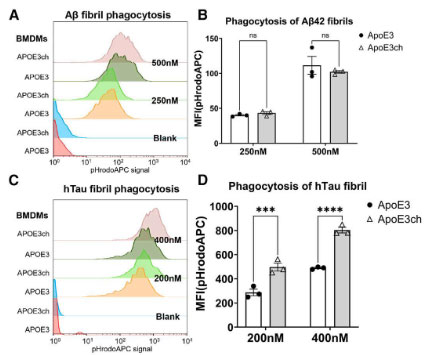
これらの変化について詳しく調べるため、彼らはpH感受性pHrodo™色素をリコンビナントのAβフィブリル、ヒトタウフィブリルに結合させ、骨髄由来マクロファージ(BMDMs)に貪食される様子を観察しました。
Aβフィブリルの貪食については、hAPOE3とhAPOE3マウスで違いはありませんでしたが、タウフィブリルの貪食は、hchAPOE3chマウスで明らかに亢進していました。
APOE3chは受容体に結合しにくく、その分タウが取り込まれやすくなる
これまでの研究で、APOE3は、低密度リポタンパク質受容体関連タンパク質1(LDL Receptor-Related Protein, LRP1)や(ヘパラン硫酸プロテオグリカン(Heparan sulfate proteoglycans, HSPGs)などの、タウが取り込まれる受容体と同じ受容体に結合することがわかっていたので [3, 4, 5, 6, 7] 彼らは、APOE3chはこの受容体に結合しにくく、そのため多くのタウがMGDMに取り込まれやすくなっている可能性を考えました。
そこで彼らは、脂質付加したAPOE3とAPOE3ch(それぞれ、lrhAPOE3, lrhAPOE3ch)を、リコンビナントヒトタウ(hタウ)とともにBMDMsに処置して、hタウの取り込みが、lrhAPOE3 or lrhAPOE3chによってどれくらい阻害されるか調べました。
pHrodoAPCで標識したタウとIrhApoe3/IrhApoE3chを同時にBMDMsに処置すると、IrhApoe3は受容体を競合してタウの取り込みが落ちましたが、lrhApoe3chの方ではそこまで落ちませんでした。
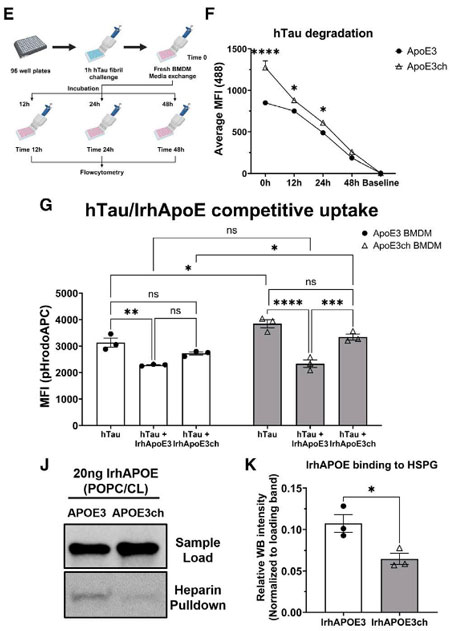
これらの結果から、ApoE3は、タウが結合する受容体に結合し、貪食細胞でのタウの取り込みに競合的に作用するのに対し、Apoe3chは受容体への結合力が下がってタウの取り込みが促進され、タウの伝播や病理形成が抑制される可能性が示唆されました。
Chen Y, Song S, Parhizkar S, Lord J, Zhu Y, Strickland MR, Wang C, Park J, Tabor GT, Jiang H, Li K, Davis AA, Yuede CM, Colonna M, Ulrich JD, Holtzman DM. APOE3ch alters microglial response and suppresses Aβ-induced tau seeding and spread. Cell. 2023 Dec 6:S0092-8674(23)01315-6. doi: 10.1016/j.cell.2023.11.029. Epub ahead of print. PMID: 38086389.
My View
プレセニリン変異は、ADの強力な原因遺伝子となりますが [8] 、そのプレセニリン変異を持ちながら、家族の中でADを発症しなかった女性のレポートは、衝撃的でした [1]。
今回は、そのメカニズムについて、ノックインマウス等を使って解析しています。
個人的に面白かったのは、APOE3chは貪食細胞の受容体への結合が弱くて、その分タウの取り込みがUPするけれども、Aβの取り込みは変わらなかったところ。
ではなぜAPP/PS1との掛け合わせでAβプラークの量が減ったのか――Aβ周囲のミクログリアは増えているので、ひとつひとつのミクログリアの貪食量は変わらなかったけれど、Aβを処理するミクログリアの数が増えて、全体的にAβプラークの量が減ったということでしょうか?――これから、もっと色々わかってくるかもしれません。
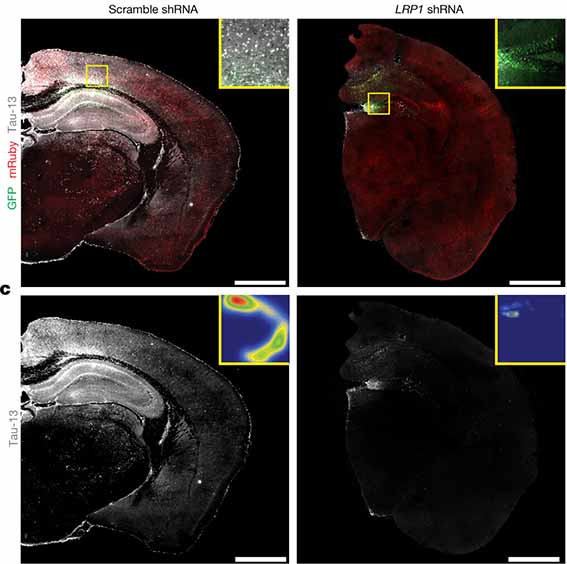
あと気になったのは、タウと結合する受容体として、LRP1やHSPGsを上げていますが、LDLRの一つのLRP1は、ニューロンではタウを取り込んでタウ凝集体の伝播に関与する可能性があったはず [9]。
アルツハイマー病(Alzheimer's disease, AD)や前頭側頭葉変性症(frontotemporal lober degeneration, FTLD)で主要な病的タンパクとして注目されているタウが、細胞間 …
この研究では特にHSPGsの方に注目しているようでしたが、APOEchがLRP1との結合力も弱くてタウの取り込みを促進するなら、ニューロンでは逆にタウ凝集体の伝播を促進する可能性もありそうな……でも、結果としてそのような事は起こっていないので、HSPGsの方が影響が高い、という事なのかもしれません。
今回は、APOE3のR136S変異について調べていますが、先日報告された、USCFのDr. Huangらの研究では、APOE4でも同じR136S変異にするとAD病理が抑えられたとのこと [10]。
Nelson et al. report that the APOE-R136S mutation protects against APOE4-promoted Alzheimer’s disease pathologies, including phosphorylated Tau accumulation, neuroinflammation and neurodegeneration, in mouse and human neuron models.
この変異ってかなり強力そうです。
ただ、この変異で気になるのは、VLDL高コレステロール値が上がること。
受容体への結合力が弱まることで、コレステロールが細胞内にとりこまれにくくなり、血中のVLDLコレステロールが高くなるようですが [11]、心血管系のリスクとかどうなのかなー?……でも、例の女性は少なくとも70代までは元気だったわけだし、そこまで悪くないのかな?
Glossary
APOE多型について
アポリポ蛋白E(Apolipoprotein E, APOE)は、VLDLやHDLなどのリポ蛋白複合体の構成成分で、全身では主に肝臓で産生され、全身臓器間のコレステロールや脂肪酸の輸送に関与する。
中枢神経系では、主にアストロサイトやミクログリアで産生され、細胞間のコレステロール輸送や、神経損傷後の修復に関与していると言われる。神経細胞表面には、APOEが結合する受容体がいくつか確認されており、HSPGはその一つ。
以前、テキサスのMarc Diamond教授らがタウの神経取り込みにHSPGが関与すると報告している [12]。
APOEにはいくつかのアイソフォームがあり、主にAPOE2, APOE3, APOE4の3つのアイソフォームが注目されている。
ほとんどの人はAPOE3(80%弱)だが、APOE4を1コピーでも持つと、ADのリスクが白人で3倍弱、日本人で4倍程度あがり、2コピーともAPOE4だと、そのオッズ比が12-13倍、日本人では20倍以上に跳ね上がり、発症年齢も若年化する。
逆にAPOE2はADの保護因子として働き、APOE2を持つ人はADになりにくい。
APOE2/3/4の一次構造的な違いは、112番目と158番目のアミノ酸残基(amino acid: aa)がシステインかアルギニンか、という違い(APOE2:112Cys,158Cys、APOE3:112Cys,158Arg、APOE4:112Arg,158Arg)で、これにより三次構造の違いが生じる。
APOE4の場合、61Argが112Argと電気的に反発して225Gluとsalt bridgeを形成し、N末とC末が近接した構造をとる。
APOE3、APOE2はこの112番目がCysなので、構造的に開いた状態となる。
これら構造の違いにより、結合しやすいリポプロテインの種類や、受容体への結合の強さの違いが生じる。
以前、APOE4の構造をAPOE3-likeに変化させる薬剤などの報告もあり、ADの治療ターゲットの一つとされている [13]。
APOEとADとの関係については、2010年代にはアミロイド病理との関係や血管障害のメカニズム等が主流だったが、その後、神経障害やタウの伝播抑制なども次々と報告されるようになり、今では様々な機序からADの病態に関与すると考えられている。
APOEのChristchrch変異について
1987年にⅢ型高脂血症の患者さんでAPOE2のR136Sの報告があり [14]、その後複数例のCase reportが報告されているが、変異としては稀。
機能的には、この変異があると、LDL受容体への結合能が落ちて、III型高脂血症を発症する [11] が、ヘテロで持っている場合には発症しない場合もある。
APOE3chを持つ人の割合
Hubackeらの報告によると、約4,000人の白人のAPOE変異を調べ、があり、それによると、APOE2 R136Sを1コピー(もう一方のalleleは普通のAPOE3)持つ人が2人いたとのこと(二人は母と子)[15]。
そこから考えると、割合的にはざっくりと0.05%くらい、Homozygousで持っている人の割合だと、0.000025%くらいかも。
また、Solanas-Barcaらの報告では、300人弱の家族性高脂血症のスクリーニングを行ったところ、1.8%にR136S変異が確認されたとのこと [16]。
References
- Arboleda-Velasquez JF, Lopera F, O'Hare M, Delgado-Tirado S, Marino C, Chmielewska N, Saez-Torres KL, Amarnani D, Schultz AP, Sperling RA, Leyton-Cifuentes D, Chen K, Baena A, Aguillon D, Rios-Romenets S, Giraldo M, Guzmán-Vélez E, Norton DJ, Pardilla-Delgado E, Artola A, Sanchez JS, Acosta-Uribe J, Lalli M, Kosik KS, Huentelman MJ, Zetterberg H, Blennow K, Reiman RA, Luo J, Chen Y, Thiyyagura P, Su Y, Jun GR, Naymik M, Gai X, Bootwalla M, Ji J, Shen L, Miller JB, Kim LA, Tariot PN, Johnson KA, Reiman EM, Quiroz YT. Resistance to autosomal dominant Alzheimer's disease in an APOE3 Christchurch homozygote: a case report. Nat Med. 2019 Nov;25(11):1680-1683. doi: 10.1038/s41591-019-0611-3. Epub 2019 Nov 4. PMID: 31686034; PMCID: PMC6898984.
- Chen Y, Song S, Parhizkar S, Lord J, Zhu Y, Strickland MR, Wang C, Park J, Tabor GT, Jiang H, Li K, Davis AA, Yuede CM, Colonna M, Ulrich JD, Holtzman DM. APOE3ch alters microglial response and suppresses Aβ-induced tau seeding and spread. Cell. 2023 Dec 6:S0092-8674(23)01315-6. doi: 10.1016/j.cell.2023.11.029. Epub ahead of print. PMID: 38086389.
- Kanekiyo T, Zhang J, Liu Q, Liu CC, Zhang L, Bu G. Heparan sulphate proteoglycan and the low-density lipoprotein receptor-related protein 1 constitute major pathways for neuronal amyloid-beta uptake. J Neurosci. 2011 Feb 2;31(5):1644-51. doi: 10.1523/JNEUROSCI.5491-10.2011. PMID: 21289173; PMCID: PMC3272839.
- Holmes BB, DeVos SL, Kfoury N, Li M, Jacks R, Yanamandra K, Ouidja MO, Brodsky FM, Marasa J, Bagchi DP, Kotzbauer PT, Miller TM, Papy-Garcia D, Diamond MI. Heparan sulfate proteoglycans mediate internalization and propagation of specific proteopathic seeds. Proc Natl Acad Sci U S A. 2013 Aug 13;110(33):E3138-47. doi: 10.1073/pnas.1301440110. Epub 2013 Jul 29. PMID: 23898162; PMCID: PMC3746848.
- Shinohara M, Tachibana M, Kanekiyo T, Bu G. Role of LRP1 in the pathogenesis of Alzheimer's disease: evidence from clinical and preclinical studies. J Lipid Res. 2017 Jul;58(7):1267-1281. doi: 10.1194/jlr.R075796. Epub 2017 Apr 4. PMID: 28381441; PMCID: PMC5496044.
- Tachibana M, Holm ML, Liu CC, Shinohara M, Aikawa T, Oue H, Yamazaki Y, Martens YA, Murray ME, Sullivan PM, Weyer K, Glerup S, Dickson DW, Bu G, Kanekiyo T. APOE4-mediated amyloid-β pathology depends on its neuronal receptor LRP1. J Clin Invest. 2019 Mar 1;129(3):1272-1277. doi: 10.1172/JCI124853. Epub 2019 Feb 11. PMID: 30741718; PMCID: PMC6391135.
- Rauch JN, Luna G, Guzman E, Audouard M, Challis C, Sibih YE, Leshuk C, Hernandez I, Wegmann S, Hyman BT, Gradinaru V, Kampmann M, Kosik KS. LRP1 is a master regulator of tau uptake and spread. Nature. 2020 Apr;580(7803):381-385. doi: 10.1038/s41586-020-2156-5. Epub 2020 Apr 1. PMID: 32296178; PMCID: PMC7687380.
- Sherrington R, Rogaev EI, Liang Y, Rogaeva EA, Levesque G, Ikeda M, Chi H, Lin C, Li G, Holman K, Tsuda T, Mar L, Foncin JF, Bruni AC, Montesi MP, Sorbi S, Rainero I, Pinessi L, Nee L, Chumakov I, Pollen D, Brookes A, Sanseau P, Polinsky RJ, Wasco W, Da Silva HA, Haines JL, Perkicak-Vance MA, Tanzi RE, Roses AD, Fraser PE, Rommens JM, St George-Hyslop PH. Cloning of a gene bearing missense mutations in early-onset familial Alzheimer's disease. Nature. 1995 Jun 29;375(6534):754-60. doi: 10.1038/375754a0. PMID: 7596406.</li>
- Rauch JN, Luna G, Guzman E, Audouard M, Challis C, Sibih YE, Leshuk C, Hernandez I, Wegmann S, Hyman BT, Gradinaru V, Kampmann M, Kosik KS. LRP1 is a master regulator of tau uptake and spread. Nature. 2020 Apr;580(7803):381-385. doi: 10.1038/s41586-020-2156-5. Epub 2020 Apr 1. PMID: 32296178; PMCID: PMC7687380.
- Nelson MR, Liu P, Agrawal A, Yip O, Blumenfeld J, Traglia M, Kim MJ, Koutsodendris N, Rao A, Grone B, Hao Y, Yoon SY, Xu Q, De Leon S, Choenyi T, Thomas R, Lopera F, Quiroz YT, Arboleda-Velasquez JF, Reiman EM, Mahley RW, Huang Y. The APOE-R136S mutation protects against APOE4-driven Tau pathology, neurodegeneration and neuroinflammation. Nat Neurosci. 2023 Dec;26(12):2104-2121. doi: 10.1038/s41593-023-01480-8. Epub 2023 Nov 13. PMID: 37957317; PMCID: PMC10689245.
- Wardell MR, Brennan SO, Janus ED, Fraser R, Carrell RW. Apolipoprotein E2-Christchurch (136 Arg----Ser). New variant of human apolipoprotein E in a patient with type III hyperlipoproteinemia. J Clin Invest. 1987 Aug;80(2):483-90. doi: 10.1172/JCI113096. PMID: 3038959; PMCID: PMC442261.
- Mirbaha H, Holmes BB, Sanders DW, Bieschke J, Diamond MI. Tau Trimers Are the Minimal Propagation Unit Spontaneously Internalized to Seed Intracellular Aggregation. J Biol Chem. 2015 Jun 12;290(24):14893-903. doi: 10.1074/jbc.M115.652693. Epub 2015 Apr 17. PMID: 25887395; PMCID: PMC4463437.
- Chen HK, Liu Z, Meyer-Franke A, Brodbeck J, Miranda RD, McGuire JG, Pleiss MA, Ji ZS, Balestra ME, Walker DW, Xu Q, Jeong DE, Budamagunta MS, Voss JC, Freedman SB, Weisgraber KH, Huang Y, Mahley RW. Small molecule structure correctors abolish detrimental effects of apolipoprotein E4 in cultured neurons. J Biol Chem. 2012 Feb 17;287(8):5253-66. doi: 10.1074/jbc.M111.276162. Epub 2011 Dec 12. PMID: 22158868; PMCID: PMC3285306.
- Lalazar A, Weisgraber KH, Rall SC Jr, Giladi H, Innerarity TL, Levanon AZ, Boyles JK, Amit B, Gorecki M, Mahley RW, et al. Site-specific mutagenesis of human apolipoprotein E. Receptor binding activity of variants with single amino acid substitutions. J Biol Chem. 1988 Mar 15;263(8):3542-5. PMID: 2831187.</li>
- Hubácek JA, Adámková V, Skodová Z. Rare variant of apolipoprotein E (Arg136 -> Ser) in two normolipidemic individuals. Physiol Res. 2005;54(5):573-5. Epub 2005 Jan 10. PMID: 15641930.
- Solanas-Barca M, de Castro-Orós I, Mateo-Gallego R, Cofán M, Plana N, Puzo J, Burillo E, Martín-Fuentes P, Ros E, Masana L, Pocoví M, Civeira F, Cenarro A. Apolipoprotein E gene mutations in subjects with mixed hyperlipidemia and a clinical diagnosis of familial combined hyperlipidemia. Atherosclerosis. 2012 Jun;222(2):449-55. doi: 10.1016/j.atherosclerosis.2012.03.011. Epub 2012 Mar 16. PMID: 22481068.