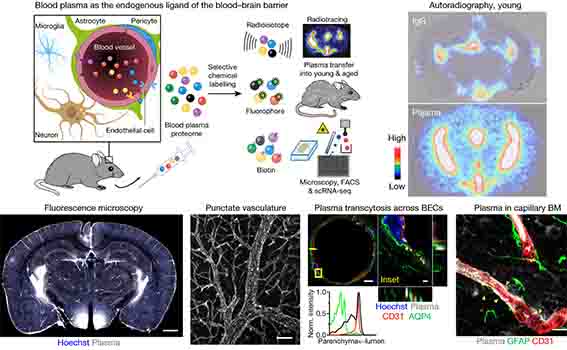
私達の脳は液体で満たされており、
- 脳の間質内:脳間質液(interstitial fluid, ISF)
- 脳室や脳周囲:脳脊髄液(cerebrospinal fluid, CSF)
と名付けられています。
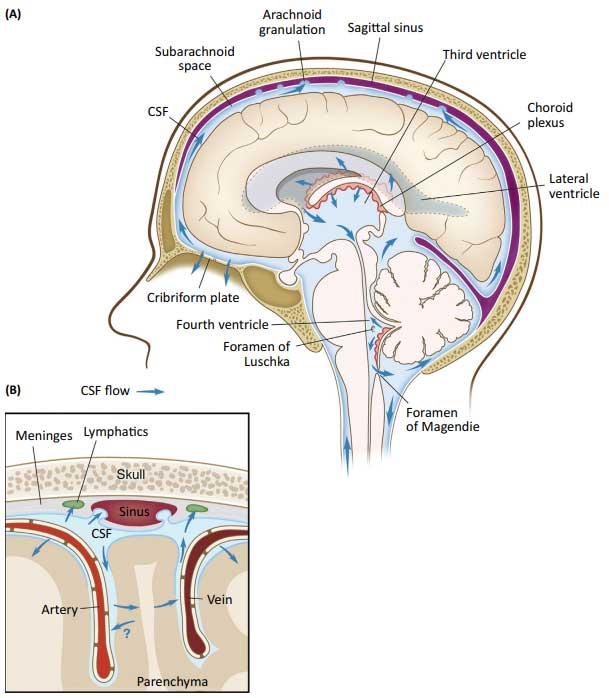
ISFは、間質に溜まった脳内の代謝産物などをCSFへ送り出し、CSFはそれらを篩骨篩板や鼻のリンパ節などを経由して深部頸部リンパ節へ排出するというドレナージ機能がありますが [1] 、
その排出されるタンパクの中に、Aβやタウ、α-シヌクレイン(α-synuclein, α-syn)なども含まれます [2, 3] 。
アミロイドβ (Amyloid beta, Aβ) の抗体療法は、アルツハイマー病 (Alzheimer's disease, AD) の治療として最も期待がかかっている治療法の一つですが、 治験の結果は、マウスの実験結 …
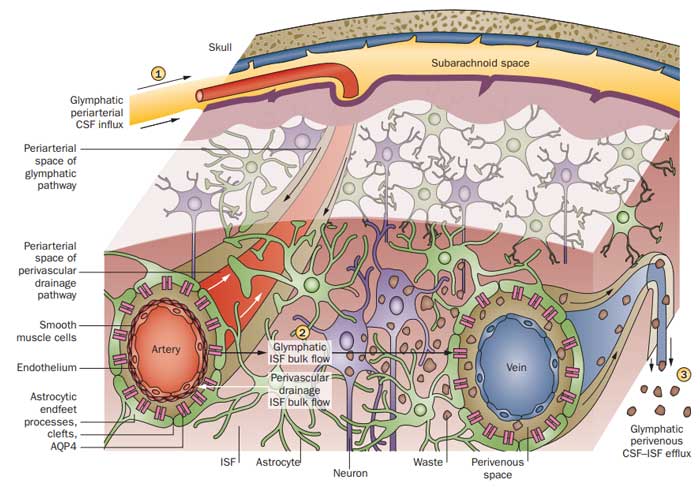
長らく、脳にはリンパ管が存在しないと言われていましたが、 1987年、脳の表層にある髄膜には「リンパ管がある」と報告されていました [1]。 その後この発見はしばらく歴史に埋もれていましたが、 40年程経った2013年以 …
で、このISFからリンパへ排出する機構には
- perivascular drenage:静脈側から動脈側に、血管壁(平滑筋層)を通って排出するパターン
- paravasular drenage:動脈側から静脈側に、血管の周りを通って排出するパターン
の2種類の排出経路が提唱されています [3, 4, 5, 6, 7, 8] 。
血管の周りを通るparavascular drenageには、アストロサイトの足にある水チャネルのアクアポリン4(aquaporin-4, AQP4)が重要な役割を果たしているので、
「グリア(glia)+リンパ(limph)」で「Glymphatic system」とも呼ばれています [7, 8] 。
AQP4の重要性については、様々報告があり、
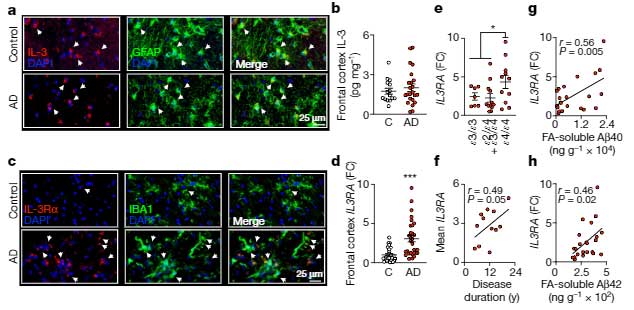
アルツハイマー病(Alzheimer's disease, AD)患者さんでAQP4の多型が関係してそうだったり [9]、血管周囲AQP4の局在が落ちていたり [10] 、
マウスでAQP4を欠失させるとAβのクリアランスが落ちて認知機能が悪化したり [7, 11] しています。
今回、東京大学の石田先生、山田先生、岩坪先生らの研究グループは、
「AQP4を欠失するとドレナージ機能が落ちてタウ病理が悪くなる」
事を報告しました。

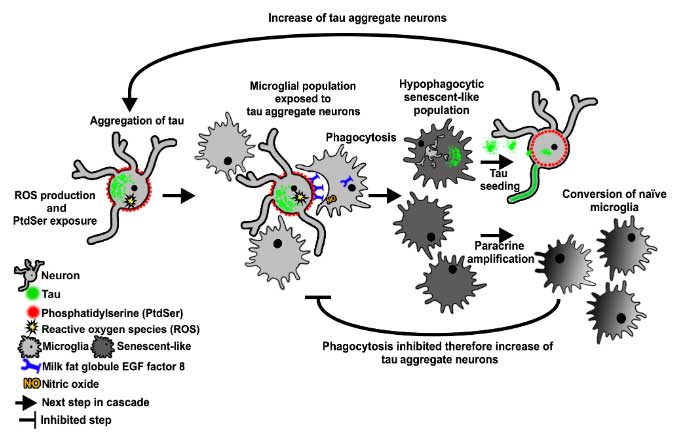
Glymphaticドレナージは細胞外タウを洗い流して、タウ凝集化や神経障害を防ぐ
タウはGlymphaticシステムで排出される
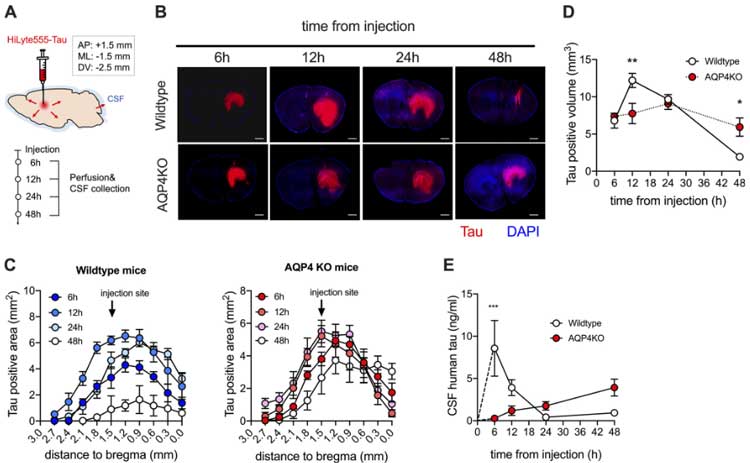
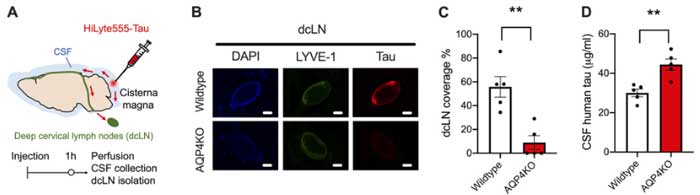
彼らは、タウがGlymphaticシステムで排出されるかどうか調べるため、AQP4ノックアウトマウス(AQP4 KO)に蛍光標識したタウ(HiLyte555-Tau)を注入し、タウの経時的なクリアランスを観察しました。
結果、HyLyte555-Tauが脳実質の留まっている量はAQP4 KOマウスで多く、CSF中への排出も遅延していました。

AQP4欠失でタウのドレナージが滞る
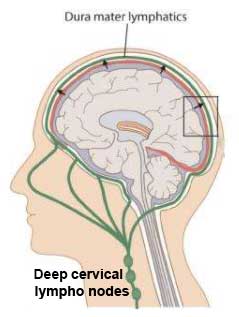
CSF中へ排泄された物質は深部経部リンパ節(Deep cervical nodes, dcLN)へ送られるので、彼らはこの部分の機能にAQP4が関与しているかどうか調べました。
CSFへHiLyte555-Tauを注入し、CSF中とdcLNの蛍光タウを1時間後に観察すると、
AQP4 KOマウスでは、CSF中に留まり、dcLNまで届いたタウの量が野生型(wild-type, WT)に比べてかなり低くなっていました。
CSFに排出された脳内代謝産物の一部は、再びISFに戻っていく事が報告されているので、著者らはdcLNに到達しなかった一部の蛍光タウがISFに移行したかどうか調べました。
CSF中の蛍光タウは、主に脳表層の動脈周囲腔を通ってISFへ流入していました。
そしてこの現象はAQP4 KOで障害されていました。
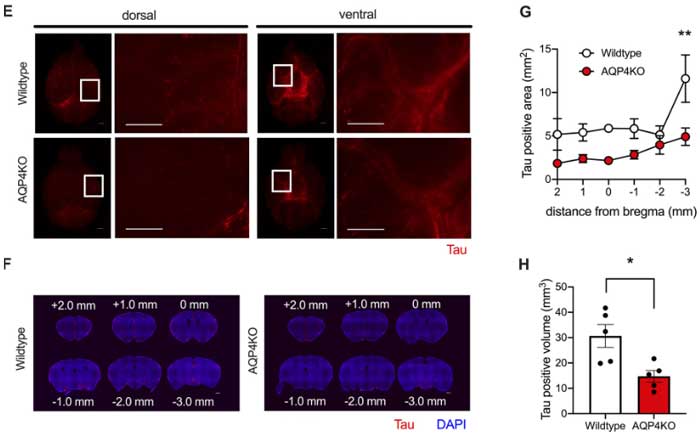
以上の結果から、AQP4欠失によって
- タウのISFからCSFへの排出
- タウのCSFからdcLNへの排出
- タウのCSFのからISFへの流入
の3つが障害される事が示唆されました。
AQP4欠失でタウの凝集・沈着が悪化する
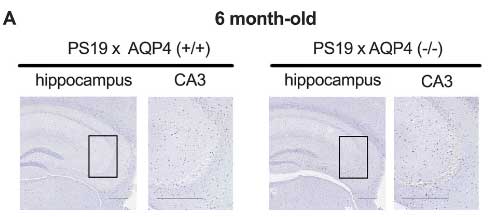
AQP4 KOマウスで急性のタウクリアランスが障害されることが示されたので、今度はタウ排出の慢性的な効果を調べるため、
彼らは、AQP4 KOとPS19マウス(P301S変異のタウTgマウス)を交配しました。
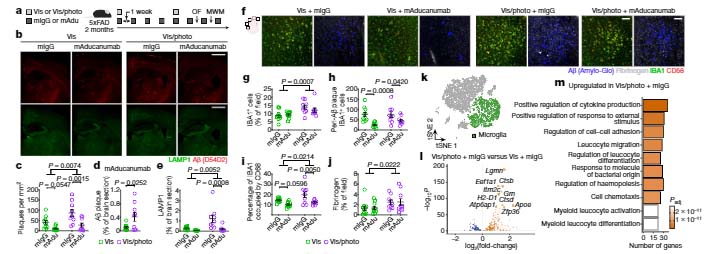
PS19;AQP4+/+は6ヶ月齢ではリン酸化タウ病理が現れませんでしたが、PS19;AQP4-/-マウスはリン酸化タウ病理が増えていました。
9ヶ月齢では、PS19;AQP4-/-のタウ病理はさらに顕著となり、
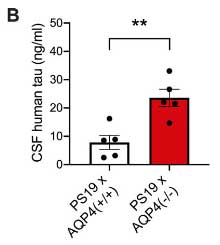
CSF中タウの量が増えており、
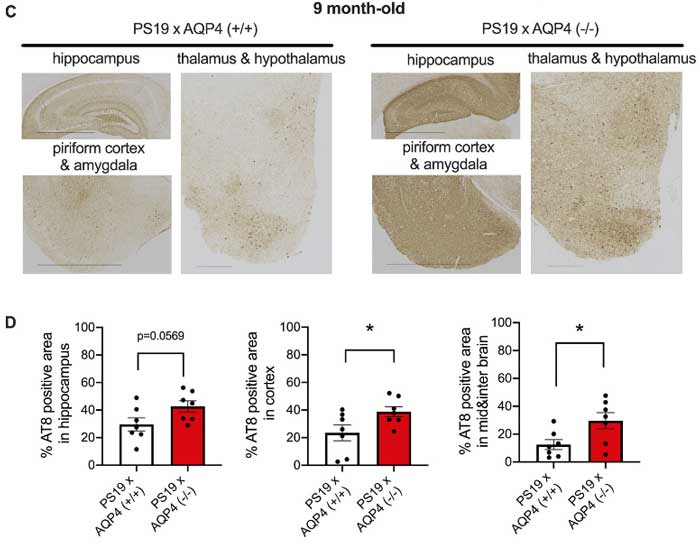
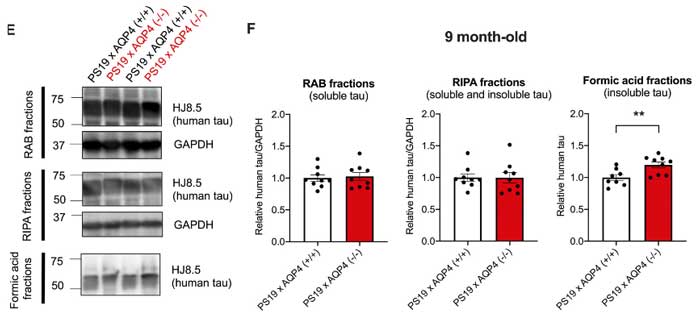
不溶性タウも増えていました。
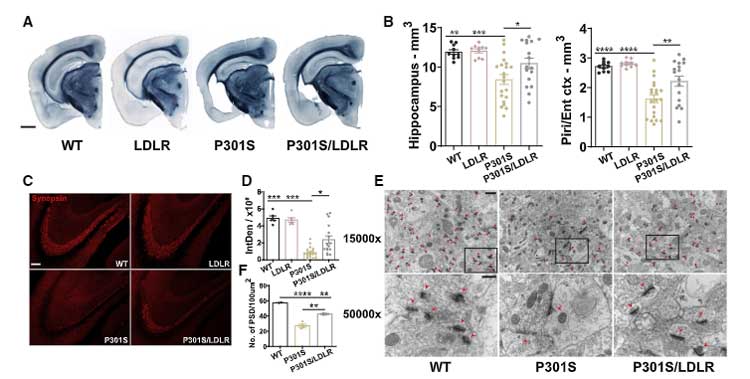
AQP4欠失で神経障害と脳萎縮も悪化する
強いタウ病理を反映するように、9ヶ月齢のPS19;AQP4-/-では皮質や海馬の萎縮及び脳室拡大が認められ、
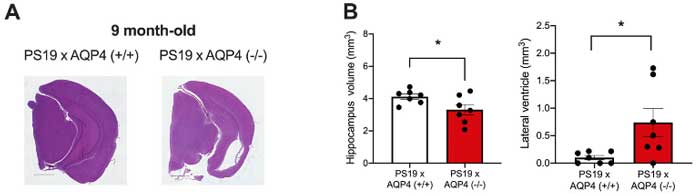
歯状回や梨状皮質の神経細胞の数も減少していました。
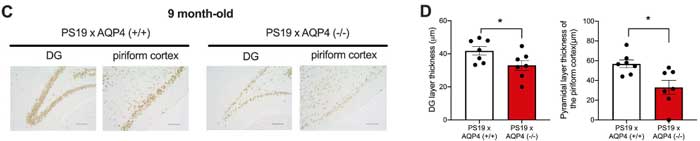
AQP4-/-のみではここまで強い萎縮はきたさなかったので、この現象はタウxAQP4-/-の相乗効果によって起こっていると考えられました。
・
・
・
以上の結果から、
AQP4欠失
↓
Glymphatic systemによるタウ排出の一連の障害
- ISF→CSF
- CSF→dcLN
- CSF→ISF
↓
タウ病理の悪化
↓
神経障害と脳萎縮
というメカニズムが考えられ、タウのクリアランスにGlymphatic systemが重要な役割を果たしている可能性が示唆されました。
Tau present in the extracellular fluids has a critical role in the pathogenesis of tauopathies. The authors describe that glymphatic clearance of extracellular
My View
脳の髄膜リンパ管が "再発見" されてから [13, 14] 脳リンパ管ドレナージに関する報告が次々と報告されており、個人的にはかなりアツい分野だと思っています。
その前から脳のドレナージシステムとして、Perivascular drainageとParavascular drainageとParavascular drainage(Glymphatic system)の2つが提唱され、2つとも最終的には頸部リンパ管に到達すると言われているわけですが、
この2つはドレナージの向きが逆(Periは静脈側→動脈側、Paraは動脈側→静脈側)な事もあり、本当に2つとも存在するのか、疑問視している人も多いと聞きます。
特にGlymphatic systemには反対意見も一定多数あり、モデルや計算上、対流ではなくただの拡散ではないか [15, 16, 17, 18]、対流の駆動力として考えられている動脈拍動も、分散を促進して輸送速度を早めているだけではないか [19] などという意見があります。
私自身はそんな複雑な物理計算はできないので、外野で見ていて「結局のところ、どうなんかなー」と思っているだけですが、
今回の論文から、
「少なくともAQP4が何らかの形でタウのクリアランスに関係してそうだ」
ということは言えるんじゃないかと思いました。
ただそれを"Glymphatic system"と断定するには、AQP4欠失の表現型をみるだけではちょっと弱い……かもしれないですけど……。
References
- Raper D, Louveau A, Kipnis J. How Do Meningeal Lymphatic Vessels Drain the CNS? Trends Neurosci. 2016 Sep;39(9):581-586. doi: 10.1016/j.tins.2016.07.001. Epub 2016 Jul 25. PMID: 27460561; PMCID: PMC5002390.
- Tarasoff-Conway JM, Carare RO, Osorio RS, Glodzik L, Butler T, Fieremans E, Axel L, Rusinek H, Nicholson C, Zlokovic BV, Frangione B, Blennow K, Ménard J, Zetterberg H, Wisniewski T, de Leon MJ. Clearance systems in the brain-implications for Alzheimer disease. Nat Rev Neurol. 2015 Aug;11(8):457-70. doi: 10.1038/nrneurol.2015.119. Epub 2015 Jul 21. Erratum in: Nat Rev Neurol. 2016 Apr;12(4):248. PMID: 26195256; PMCID: PMC4694579.
- Cheng Y, Wang YJ. Meningeal Lymphatic Vessels: A Drain of the Brain Involved in Neurodegeneration? Neurosci Bull. 2020 May;36(5):557-560. doi: 10.1007/s12264-019-00456-8. Epub 2020 Jan 1. PMID: 31893342; PMCID: PMC7186281.
- Uemura MT, Maki T, Ihara M, Lee VMY, Trojanowski JQ. Brain Microvascular Pericytes in Vascular Cognitive Impairment and Dementia. Front Aging Neurosci. 2020 Apr 14;12:80. doi: 10.3389/fnagi.2020.00080. PMID: 32317958; PMCID: PMC7171590.
- Carare RO, Hawkes CA, Weller RO. Afferent and efferent immunological pathways of the brain. Anatomy, function and failure. Brain Behav Immun. 2014 Feb;36:9-14. doi: 10.1016/j.bbi.2013.10.012. Epub 2013 Oct 18. PMID: 24145049.
- Engelhardt B, Carare RO, Bechmann I, Flügel A, Laman JD, Weller RO. Vascular, glial, and lymphatic immune gateways of the central nervous system. Acta Neuropathol. 2016 Sep;132(3):317-38. doi: 10.1007/s00401-016-1606-5. Epub 2016 Aug 13. PMID: 27522506; PMCID: PMC4992028.
- Iliff JJ, Wang M, Liao Y, Plogg BA, Peng W, Gundersen GA, Benveniste H, Vates GE, Deane R, Goldman SA, Nagelhus EA, Nedergaard M. A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid β. Sci Transl Med. 2012 Aug 15;4(147):147ra111. doi: 10.1126/scitranslmed.3003748. PMID: 22896675; PMCID: PMC3551275.
- Jessen NA, Munk AS, Lundgaard I, Nedergaard M. The Glymphatic System: A Beginner's Guide. Neurochem Res. 2015 Dec;40(12):2583-99. doi: 10.1007/s11064-015-1581-6. Epub 2015 May 7. PMID: 25947369; PMCID: PMC4636982.
- Burfeind KG, Murchison CF, Westaway SK, Simon MJ, Erten-Lyons D, Kaye JA, Quinn JF, Iliff JJ. The effects of noncoding aquaporin-4 single-nucleotide polymorphisms on cognition and functional progression of Alzheimer's disease. Alzheimers Dement (N Y). 2017 May 26;3(3):348-359. doi: 10.1016/j.trci.2017.05.001. PMID: 29067342; PMCID: PMC5651426.
- Zeppenfeld DM, Simon M, Haswell JD, D'Abreo D, Murchison C, Quinn JF, Grafe MR, Woltjer RL, Kaye J, Iliff JJ. Association of Perivascular Localization of Aquaporin-4 With Cognition and Alzheimer Disease in Aging Brains. JAMA Neurol. 2017 Jan 1;74(1):91-99. doi: 10.1001/jamaneurol.2016.4370. PMID: 27893874.
- Abe Y, Ikegawa N, Yoshida K, Muramatsu K, Hattori S, Kawai K, Murakami M, Tanaka T, Goda W, Goto M, Yamamoto T, Hashimoto T, Yamada K, Shibata T, Misawa H, Mimura M, Tanaka KF, Miyakawa T, Iwatsubo T, Hata JI, Niikura T, Yasui M. Behavioral and electrophysiological evidence for a neuroprotective role of aquaporin-4 in the 5xFAD transgenic mice model. Acta Neuropathol Commun. 2020 May 12;8(1):67. doi: 10.1186/s40478-020-00936-3. PMID: 32398151; PMCID: PMC7218576.
- Ishida K, Yamada K, Nishiyama R, Hashimoto T, Nishida I, Abe Y, Yasui M, Iwatsubo T. Glymphatic system clears extracellular tau and protects from tau aggregation and neurodegeneration. J Exp Med. 2022 Mar 7;219(3):e20211275. doi: 10.1084/jem.20211275. Epub 2022 Feb 25. PMID: 35212707; PMCID: PMC8932543.
- Louveau A, Smirnov I, Keyes TJ, Eccles JD, Rouhani SJ, Peske JD, Derecki NC, Castle D, Mandell JW, Lee KS, Harris TH, Kipnis J. Structural and functional features of central nervous system lymphatic vessels. Nature. 2015 Jul 16;523(7560):337-41. doi: 10.1038/nature14432. Epub 2015 Jun 1. Erratum in: Nature. 2016 May 12;533(7602):278. PMID: 26030524; PMCID: PMC4506234.
- Aspelund A, Antila S, Proulx ST, Karlsen TV, Karaman S, Detmar M, Wiig H, Alitalo K. A dural lymphatic vascular system that drains brain interstitial fluid and macromolecules. J Exp Med. 2015 Jun 29;212(7):991-9. doi: 10.1084/jem.20142290. Epub 2015 Jun 15. PMID: 26077718; PMC ID: PMC4493418.
- Hladky SB, Barrand MA. Is solute movement within the extracellular spaces of brain gray matter brought about primarily by diffusion or flow? A commentary on "Analysis of convective and diffusive transport in the brain interstitium" Fluids and Barriers of the CNS (2019) 16:6 by L. Ray, J.J. Iliff and J.J. Heys. Fluids Barriers CNS. 2019 Jul 12;16(1):24. doi: 10.1186/s12987-019-0141-x. PMID: 31299992; PMCID: PMC6626326.
- Jin BJ, Smith AJ, Verkman AS. Spatial model of convective solute transport in brain extracellular space does not support a "glymphatic" mechanism. J Gen Physiol. 2016 Dec;148(6):489-501. doi: 10.1085/jgp.201611684. Epub 2016 Nov 11. PMID: 27836940; PMCID: PMC5129742.
- Smith AJ, Yao X, Dix JA, Jin BJ, Verkman AS. Test of the 'glymphatic' hypothesis demonstrates diffusive and aquaporin-4-independent solute transport in rodent brain parenchyma. Elife. 2017 Aug 21;6:e27679. doi: 10.7554/eLife.27679. PMID: 28826498; PMCID: PMC5578736.
- Holter KE, Kehlet B, Devor A, Sejnowski TJ, Dale AM, Omholt SW, Ottersen OP, Nagelhus EA, Mardal KA, Pettersen KH. Interstitial solute transport in 3D reconstructed neuropil occurs by diffusion rather than bulk flow. Proc Natl Acad Sci U S A. 2017 Sep 12;114(37):9894-9899. doi: 10.1073/pnas.1706942114. Epub 2017 Aug 28. PMID: 28847942; PMCID: PMC5604020.
- Asgari M, de Zélicourt D, Kurtcuoglu V. Glymphatic solute transport does not require bulk flow. Sci Rep. 2016 Dec 8;6:38635. doi: 10.1038/srep38635. PMID: 27929105; PMCID: PMC5144134.