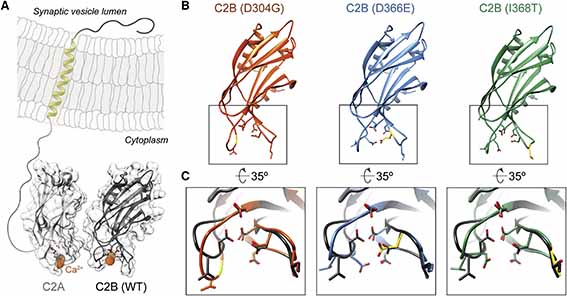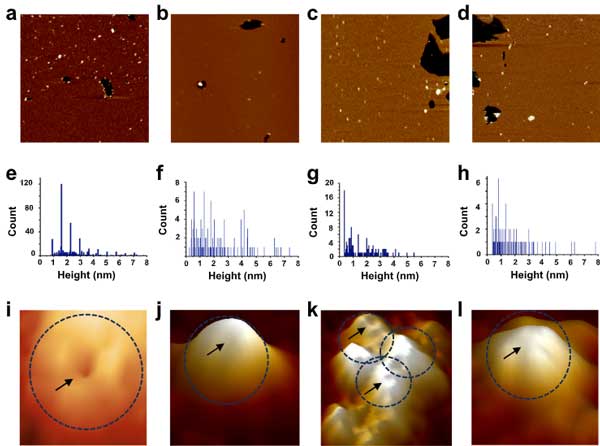
アミロイドβ (Amyloid beta, Aβ) のオリゴマー、フィブリルなどの集合体には神経毒性があり、シナプス障害を引き起こし、認知機能低下に繋がる事が示唆されています [1] 。
また、Aβがあると、神経活動が異常に興奮する事も分かっています。
では、Aβはどのように神経毒性を発揮するのでしょうか?
これまでの研究では、
などの可能性が報告されてきました。
今回、アメリカ・カリフォルニア大学サンディアゴ校の Dr. Lai, 中央フロリダ大学の Dr. Tatulian らのグループは、
「Aβは細胞膜に埋め込まれてイオンチャネルの働きをし、神経活動を誘導することで神経障害を引き起こす」
ということを、様々な実験系で検証しました [6]

Aβは細胞膜に埋め込まれてイオンチャネルの働きをし、細胞のホメオスタシスを乱す
The structural basis of membrane permeabilization by Alzheimer’s disease-related amyloid β (Aβ) peptides is elucidated. Membrane insertion of tyrosine-10 supports the most effective ionic conductance of the full-length Aβ1-42 compared to other isoforms.
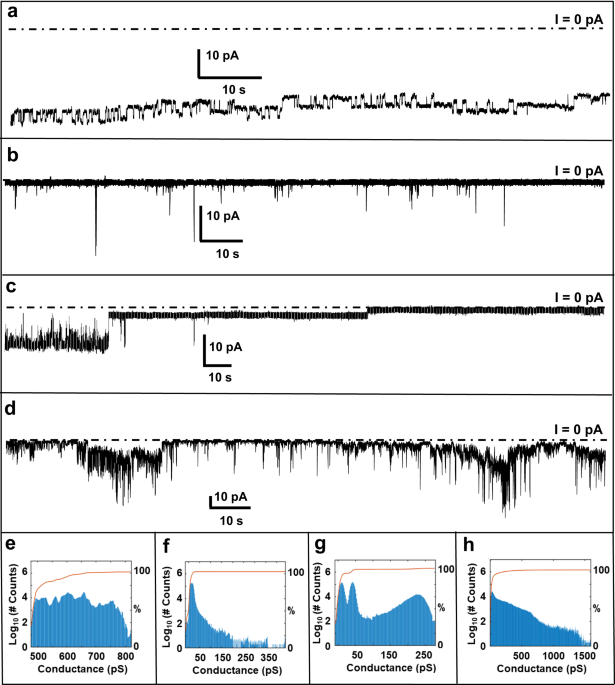
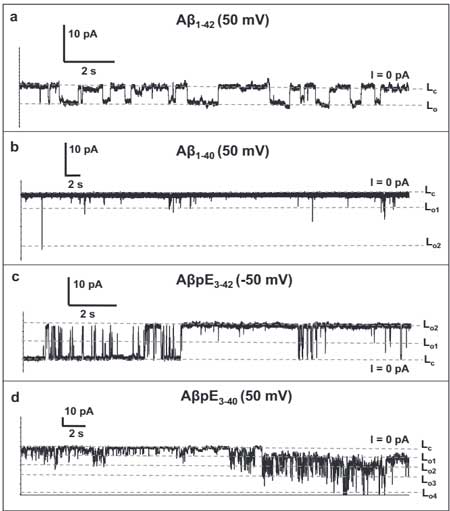
電圧クランプを用いた電気生理学的検証
彼らは、Aβの特性を調べるため、
- Aβ1-42
- Aβ1-40
- Aβ42のピログルタミル化形態(AβpE3-42)
- Aβ40のピログルタミル化形態(AβpE3-40)
の4つのペプチドを準備し、POPC, POPG, コレステロールを6:3:1の割合でC10H22に溶解したリポソーム膜に処置しました( バッファーは1M KCl + 10mM HEPES, pH7.4)。
すると、いずれのペプチドでも、リポソーム膜に貫入し、電流を通し、Aβペプチドがイオン伝導特性をもつことがわかりました。
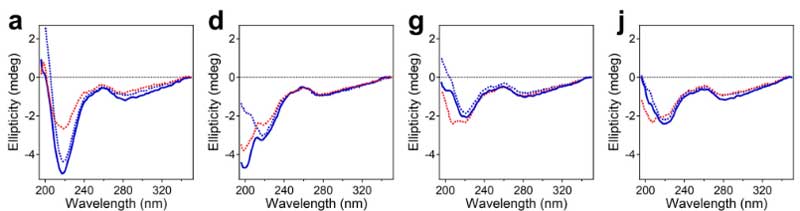
円偏光二色性スペクトロスコピー
円偏光二色性(far-UV circular dichroism, CD)スペクトロスコピーでは、Aβ1-42が最も明確なβシート構造を形成し(217-218nmのdeep minimum irresective of extrusion)、その次にAβpE3-42が続きました。
Aβ1‐40は、より不規則なβシート構造を形成しました。
これらのβシート構造とAβのチャネル様形成に相関が見られ、Aβのチャネル機能はβシート構造に関係している可能性が示唆されました。
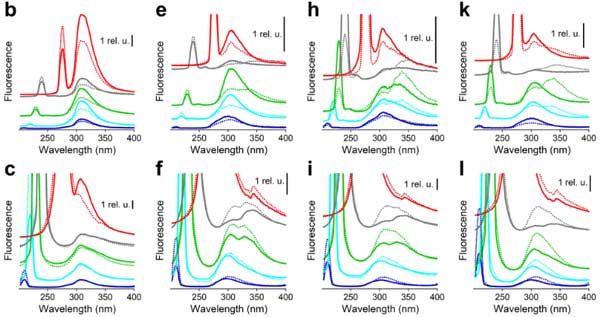
蛍光スペクトロスコピーでは、Aβ1-42がリポソーム膜に効果的に埋め込まれ、βシートを豊富に含むβバレル様構造を形成し、膜に多数のサブユニットの孔を形成し、イオンチャネルの特徴を示すことが示されました。
他のペプチドは部分的に溶媒にさらされ、最小限のβシート構造を含み、より不規則なアセンブリを形成し、不規則なイオン電流を生じさせることが示されました。
偏光減衰全反射フーリエ変換赤外分光法
さらに、リポソームとペプチドのサンプルを偏光減衰全反射フーリエ変換赤外(polarized ATR-FTIR)分光法で調べると、特にAβ1-42がリポソーム膜のリピッド秩序を高め、他の3つのペプチドがリピッド秩序を低下させました。
このことから、Aβ1-42が安定したイオン伝導チャネルを形成し、他のペプチドがイオン伝導による膜の不安定化メカニズムに関連する可能性がしさされました。
原子間力顕微鏡
最後二彼らは、原子間力顕微鏡(Atomic force microscopy, AFM)で、Aβペプチドがリポソーム膜に埋め込まれた様子の形態学的特徴を調べました。
各ペプチドは、24時間、37℃でインキュベートし、オリゴマー化しました。AβpE3-42とAβpE3-40はより高度な順序を持つオリゴマー構造を示しました。
リポソーム膜に再構成されたAβペプチド集合体をAFMで観察すると、それぞれのペプチドオリゴマーで2つの集団が観察されました。
- 脂質二重膜構造から0.5-2.0nmほど突出したペプチド(膜に挿入された構造)
- 2nmを超える膜吸着ペプチドプール
Aβ1-42は、4~6ユニットからなる環状集合体を形成し、約16nmの外径のポア様構造が確認されました。

まとめ
以上の結果から、
「Aβペプチドは、脂質膜に挿入され、イオンチャネルを形成し、これにより神経細胞内のイオン電流を乱す」
という可能性が示唆されました。
My View
今まで、「Aβが神経活動を見出し、神経毒性を発揮する」という論文は多く見かけていましたが、「どうやって?」という事は知りませんでした。
ただ、私が知らなかっただけで、そのメカニズムを調べた研究はたくさんあったようです。
今回は、様々なハイテク技術を用いて、「Aβが脂質膜に埋め込まれてイオンチャネルの働きをすることで、細胞内のイオン電流を乱す」という可能性を示しており、そのような現象があることを率直に「面白いなー」と思いました。
methodologyに関しては、専門外の手法が多く、正直、内容をちゃんと理解できているか不安です。。。解釈で間違ったところがあれば、誰か指摘してください。
Glossary
ピログルタミル化Aβ
Aβのピログルタミル化(AβpE3)、特にAβpE3-42およびAβpE3-40は、AβペプチドのN末端がピログルタミン酸に変換された化学修飾であり、ADとの関連が強い事で注目されている [7] 。
AβpE3はAD患者の脳内に豊富に存在し、AβpE3–42を生成するトランスジェニックマウスモデルでは、重度の神経細胞損失をきたす [7]。
Aβペプチドのピログルタミル化は、生体内でグルタミニルシクラーゼという酵素によって触媒され、これらのペプチドの神経毒性と凝集速度を増加する。
特にAβpE3–42は、酵素による分解への抵抗性が高まるだけでなく、Aβ毒性が増強される。
グルタミニルシクラーゼの阻害は、ADトランスジェニックマウスモデルにおいてAβpE3–42負荷、プラーク形成、およびグリオーシスを減少させることが示された [8]。
この増強された毒性は、疎水性の増加と、βシート構造と凝集体の形成能力に関連しており、ADの神経病理に寄与する [9]
上述のように、AβpE3-42およびAβpE3-40はAD患者で多く認め、Aβの凝集性や細胞毒性を増強させる機能を持つ事から、ADの治療および診断マーカーとして重要なターゲットと考えられている [10] 。
References
- Koffie RM, Meyer-Luehmann M, Hashimoto T, Adams KW, Mielke ML, Garcia-Alloza M, Micheva KD, Smith SJ, Kim ML, Lee VM, Hyman BT, Spires-Jones TL. Oligomeric amyloid beta associates with postsynaptic densities and correlates with excitatory synapse loss near senile plaques. Proc Natl Acad Sci U S A. 2009 Mar 10;106(10):4012-7. doi: 10.1073/pnas.0811698106. Epub 2009 Feb 19. PMID: 19228947; PMCID: PMC2656196.
- Wang X, Zheng W. Ca2+ homeostasis dysregulation in Alzheimer's disease: a focus on plasma membrane and cell organelles. FASEB J. 2019 Jun;33(6):6697-6712. doi: 10.1096/fj.201801751R. Epub 2019 Mar 8. PMID: 30848934.
- Arbel-Ornath M, Hudry E, Boivin JR, Hashimoto T, Takeda S, Kuchibhotla KV, Hou S, Lattarulo CR, Belcher AM, Shakerdge N, Trujillo PB, Muzikansky A, Betensky RA, Hyman BT, Bacskai BJ. Soluble oligomeric amyloid-β induces calcium dyshomeostasis that precedes synapse loss in the living mouse brain. Mol Neurodegener. 2017 Mar 21;12(1):27. doi: 10.1186/s13024-017-0169-9. PMID: 28327181; PMCID: PMC5361864.
- Diaz JC, Simakova O, Jacobson KA, Arispe N, Pollard HB. Small molecule blockers of the Alzheimer Abeta calcium channel potently protect neurons from Abeta cytotoxicity. Proc Natl Acad Sci U S A. 2009 Mar 3;106(9):3348-53. doi: 10.1073/pnas.0813355106. Epub 2009 Feb 9. PMID: 19204293; PMCID: PMC2637905.
- Gunn AP, Wong BX, Johanssen T, Griffith JC, Masters CL, Bush AI, Barnham KJ, Duce JA, Cherny RA. Amyloid-β Peptide Aβ3pE-42 Induces Lipid Peroxidation, Membrane Permeabilization, and Calcium Influx in Neurons. J Biol Chem. 2016 Mar 18;291(12):6134-45. doi: 10.1074/jbc.M115.655183. Epub 2015 Dec 23. PMID: 26697885; PMCID: PMC4813569.
- Karkisaval AG, Hassan R, Nguyen A, Balster B, Abedin F, Lal R, Tatulian SA. The structure of tyrosine-10 favors ionic conductance of Alzheimer's disease-associated full-length amyloid-β channels. Nat Commun. 2024 Feb 13;15(1):1296. doi: 10.1038/s41467-023-43821-y. PMID: 38351257; PMCID: PMC10864385.
- Jawhar S, Wirths O, Bayer TA. Pyroglutamate amyloid-β (Aβ): a hatchet man in Alzheimer disease. J Biol Chem. 2011 Nov 11;286(45):38825-32. doi: 10.1074/jbc.R111.288308. Epub 2011 Sep 29. PMID: 21965666; PMCID: PMC3234707.
- Schilling S, Zeitschel U, Hoffmann T, Heiser U, Francke M, Kehlen A, Holzer M, Hutter-Paier B, Prokesch M, Windisch M, Jagla W, Schlenzig D, Lindner C, Rudolph T, Reuter G, Cynis H, Montag D, Demuth HU, Rossner S. Glutaminyl cyclase inhibition attenuates pyroglutamate Abeta and Alzheimer's disease-like pathology. Nat Med. 2008 Oct;14(10):1106-11. doi: 10.1038/nm.1872. Epub 2008 Sep 28. PMID: 18836460.
- Gillman AL, Jang H, Lee J, Ramachandran S, Kagan BL, Nussinov R, Teran Arce F. Activity and architecture of pyroglutamate-modified amyloid-β (AβpE3-42) pores. J Phys Chem B. 2014 Jul 3;118(26):7335-44. doi: 10.1021/jp5040954. Epub 2014 Jun 24. PMID: 24922585; PMCID: PMC4096221.
- Jawhar S, Wirths O, Bayer TA. Pyroglutamate amyloid-β (Aβ): a hatchet man in Alzheimer disease. J Biol Chem. 2011 Nov 11;286(45):38825-32. doi: 10.1074/jbc.R111.288308. Epub 2011 Sep 29. PMID: 21965666; PMCID: PMC3234707.