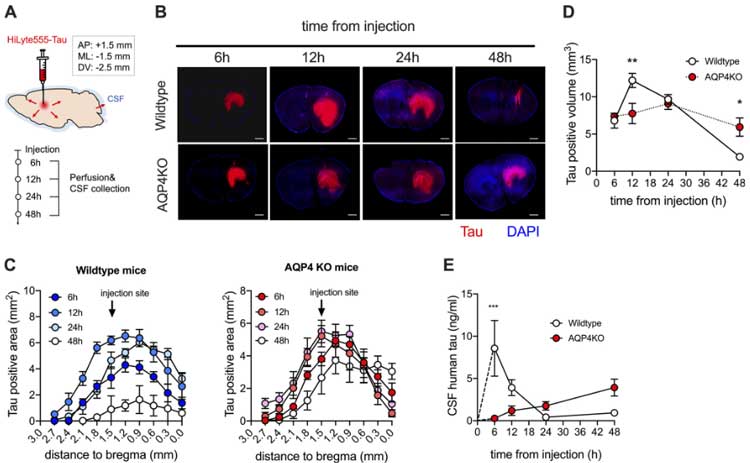
アルツハイマー病 (Alzheimer's disease, AD) と脂質異常症の関係は以前から報告されており、Low-density lipoproteins (LDL) とアミロイドβ (Amyloid beta, Aβ) 、タウとの関係も研究されてきました。
ADと脂質異常の関係で最も頭に浮かんでくるタンパクはアポリポタンパクE (Apolipoprotein E, APOE) ですね。
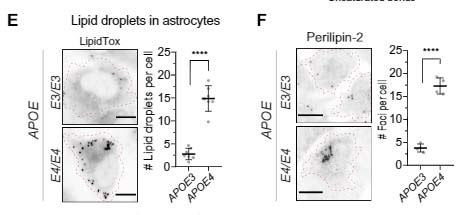
アポリポタンパクE (Apolipoprotein E, APOE) は、孤発性アルツハイマー病 (Alzheimer's disease, AD) の最大のリスク多型ですが、その多くはアストロサイトから分泌されます [ …
アポリポタンパクは、脂質等と結合して、脂質の運搬や脂質代謝関連酵素の活性化、あるいは補酵素として働く一連のタンパクの総称です。 このうち、アポリポタンパクE (Apolipoprotein E, APOE) は、主に3つ …
アメリカ・ワシントン大学の Dr. Holzman らの研究グループは、以前、
タウトランスジェニックマウス(P301S)の APOE をヒトの3つのアイソタイプ (APOE4, APOE3, APOE2) に置換すると、APOE4 > APOE3 > APOE2 の順に神経変性を誘導することを報告していました [1]。
また、タウ ✕ APOE による神経変性には、ミクログリアの活性化が関与していることも報告しました [2]。
今回は、APOE の受容体の一つである LDL受容体(LDLR)に着目し、APOE ✕ タウがミクログリアによる神経変性を誘導するメカニズムについて報告しました。

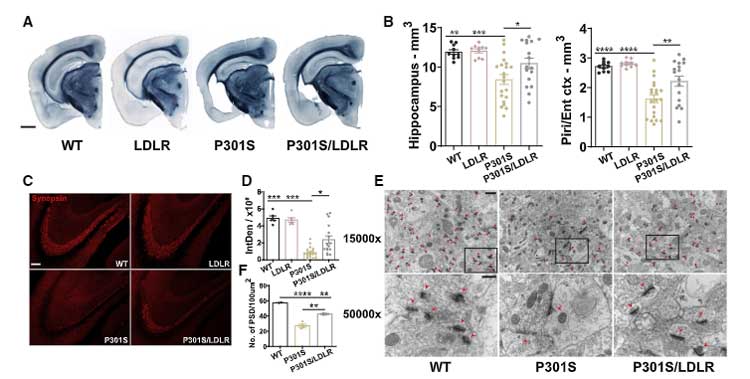
LDLレセプターを過剰発現すると、APOEを抑えてタウ介在性神経変性が改善する
LDLR過剰発現は、タウによる神経障害を改善する
著者らは、
- 野生型マウス (WT)
- LDLR過剰発現マウス (LDLR)
- P301Sタウトランスジェニックマウス (P301S)
- P301S/LDLR マウス
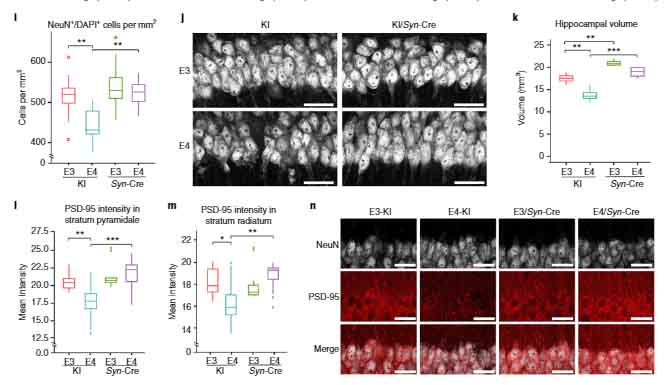
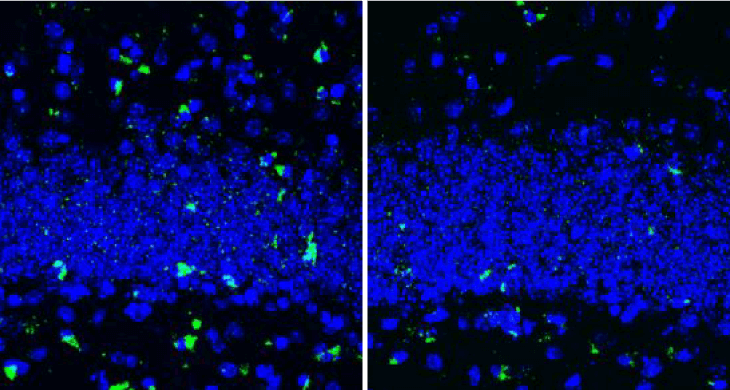
の4種類のマウスを作製し 9ヶ月齢での、神経変性、シナプス後肥厚 (postsynaptic density; PSD) 、タウ病理を比較しました。
結果、P301S で生じていた神経変性やシナプス障害は、LDLRの過剰発現で改善しました。

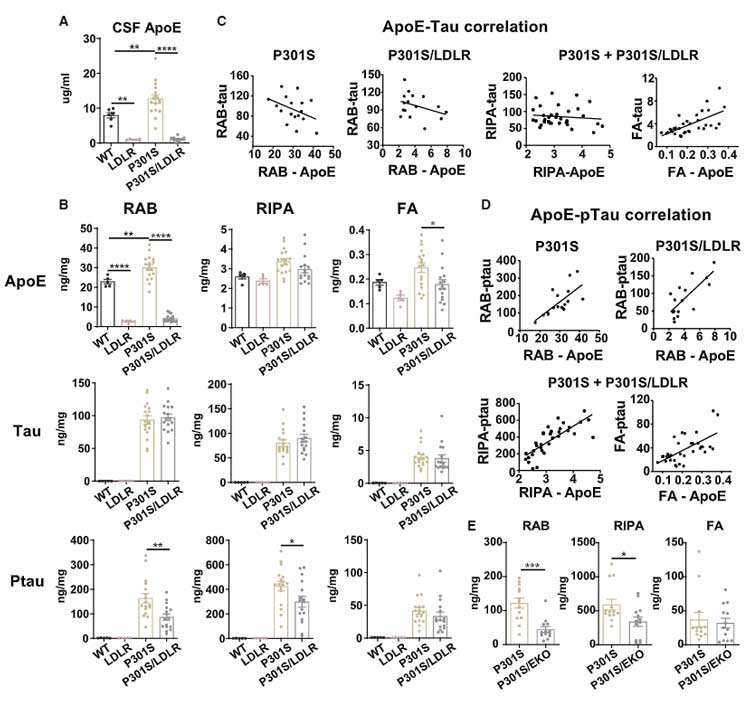
LDLR過剰発現は、P301SマウスのApoEやリン酸化タウレベルを下げる
上記4種類のマウスの CSF 中 ApoE を測定すると、LDLR マウス, P301S/LDLR マウスで CSF 中 ApoE 量が抑えられ、
P301S のタウ病理は LDLR の過剰発現にて抑制されました。
また、P301S/LDLRマウスの ApoE 量はタウ病理の程度と逆相関しました。
さらに著者らは、APOE4 ノックアウト (EKO) マウスと P301S マウスを交配し、P301S/EKO マウスを作製しました。
P301S/EKO マウスは、P301S/LDLR マウスと同様に、リン酸化タウの量を減少させました。
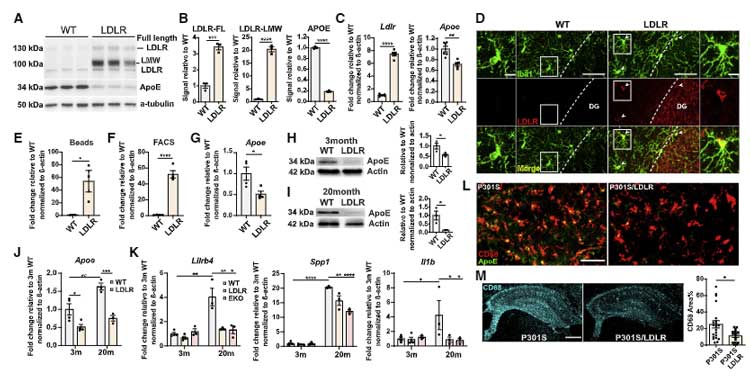
ミクログリアで LDLR を過剰発現すると、ミクログリア内の ApoE 量が減少し、ミクログリアの活性が抑えられる
著者らは以前、ミクログリアがタウ病理による神経変性に重要な役割を果たしている事を報告していたので [2]、
ミクログリアで LDLR の発現を上げるとどうなるか調べました。
結果、P301Sマウスのミクログリア-LDLRを過剰発現させると、ミクログリア内の Apoe の発現が抑えられ、CD68 などの活性化ミクログリアのマーカーが減少しました。
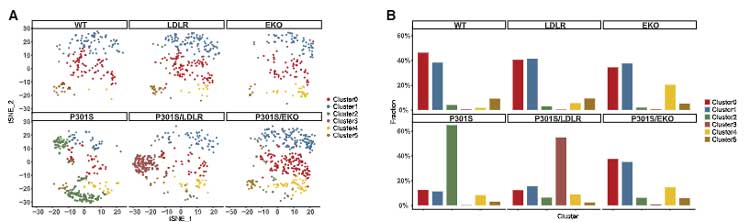
シングルセルRNA シークエンスで6種類のミクログリアにサブクラスタリングすると、
シナプス機能を調節するミクログリアマーカー(Grin2b, Grin2a, Fam19a1, Camkv etc.)は P301Sマウスで減少しており、
逆にApoe, Spp1, Cd74, Lilrb4a, Itgax, Axl, Trem2, B2m などの disease-associated microglia (DAM) のマーカーが上昇していました。
LDLRマウスと P301S/LDLR マウスでは違ったミクログリアプロファイルとなっており、分類 3 に属する遺伝子群は P301S/LDLR マウスでのみ上昇していました。
ミクログリアのApoEを抑制すると、同化関連遺伝子の発現が下がり、異化関連遺伝子の発現が上がる
LDLR過剰発現マウスでは、ApoE の発現減少と相関して同化関連遺伝子の発現が下がり、異化関連遺伝子の発現が上がっていました。
このような現象は、ミクログリアの活性化を防ぐ働きがあると考えられています。
EKO ミクログリアや LDLR↑ ミクログリア のプロファイルを詳細に観察すると、ニューロトランスミッターレセプターやイオンチャネル関連遺伝子の発現量が上昇しており、
これらの遺伝子群の働きがミクログリアの活性化に関係していると考えられました。
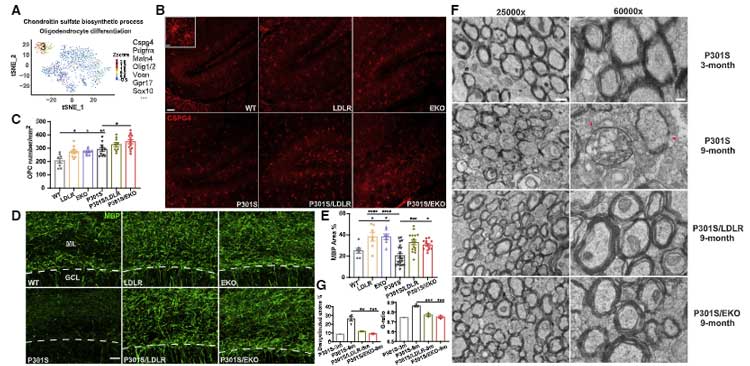
APOE KO や LDLR↑ マウスでは、オリゴデンドロサイトの増速およびミエリンの安定化が得られる
オリゴデンドロサイト関連のマーカーをみてみると、
P301S/EKO や P301S/LDLR マウスでは、P301S マウスと比べて
Cspg4, Pdgfra などのオリゴデンドロサイト前駆細胞 (oligodendrocyte precursor cell, OPC) 関連マーカーの発現が上昇しており、
免染では、分子層のミエリン形成が促進されていました。
以上の結果から、
タウトランスジェニック (P301S) マウスの LDLRの発現を上げる
↓
ApoE の発現量が下がる
↓
ミクログリアの ApoE低下は、ミクログリアの活性化を抑える
&
オリゴデンドロサイトの増殖及びミエリン形成を促す
という流れが示唆されました。
APOE is the strongest genetic risk factor for late-onset Alzheimer's disease. ApoE exacerbates tau-associated neurodegeneration by driving microglial activation. However, how apoE regulates microglial activation and whether targeting apoE is therapeutically beneficial in tauopathy is unclear. Here, …
My View
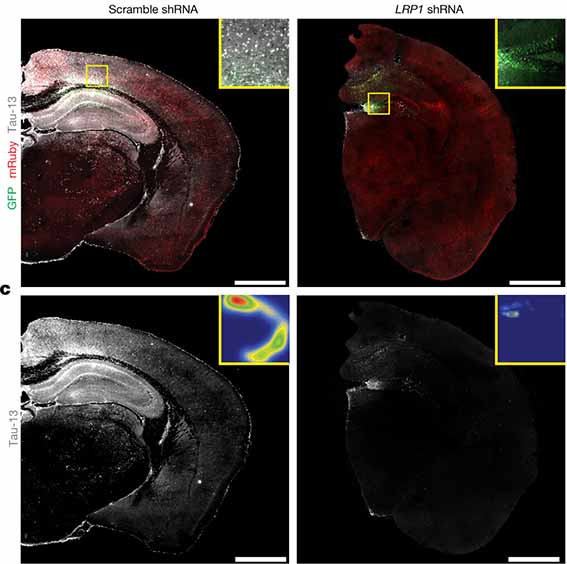
以前は、「同じ LDLR の一つである LRP1 を抑制すると、タウの伝播を抑えられる」という論文を紹介しましたが、
アルツハイマー病(Alzheimer's disease, AD)や前頭側頭葉変性症(frontotemporal lober degeneration, FTLD)で主要な病的タンパクとして注目されているタウが、細胞間 …
今回のは、「むしろ LDLR の発現を上げた方がタウマウスの神経障害が改善する」というお話。
前回の方は、LRP1 shRNA を AAV ベクターでトランスフェクションして LRP1 を抑制しており、
今回は、変異タウのトランスジェニックを長期的に観察している、という点が大きく異なります。
つまり、
「LRLR↑ はタウの取り込みや伝播には促進するけれども、長期的にみるとタウ介在性の神経障害を誘導するので、発現量は上げておいた方がよい」
……ということかな?
References
- Shi Y, Yamada K, Liddelow SA, Smith ST, Zhao L, Luo W, Tsai RM, Spina S, Grinberg LT, Rojas JC, Gallardo G, Wang K, Roh J, Robinson G, Finn MB, Jiang H, Sullivan PM, Baufeld C, Wood MW, Sutphen C, McCue L, Xiong C, Del-Aguila JL, Morris JC, Cruchaga C; Alzheimer’s Disease Neuroimaging Initiative, Fagan AM, Miller BL, Boxer AL, Seeley WW, Butovsky O, Barres BA, Paul SM, Holtzman DM. ApoE4 markedly exacerbates tau-mediated neurodegeneration in a mouse model of tauopathy. Nature. 2017 Sep 28;549(7673):523-527. doi: 10.1038/nature24016., Epub 2017 Sep 20. PMID: 28959956; PMCID: PMC5641217.
- Shi Y, Manis M, Long J, Wang K, Sullivan PM, Remolina Serrano J, Hoyle R, Holtzman DM. Microglia drive APOE-dependent neurodegeneration in a tauopathy mouse model. J Exp Med. 2019 Nov 4;216(11):2546-2561. doi:10.1084/jem.20190980., Epub 2019 Oct 10. PMID: 1601677; PMCID: PMC6829593.
- Shi Y, Andhey PS, Ising C, Wang K, Snipes LL, Boyer K, Lawson S, Yamada K, Qin W, Manis M, Serrano JR, Benitez BA, Schmidt RE, Artyomov M, Ulrich JD, Holtzman DM. Overexpressing low-density lipoprotein receptor reduces tau-associated neurodegeneration in relation to apoE-linked mechanisms. Neuron. 2021 Jun 10:S0896-6273(21)00413-X. doi:10.1016/j.neuron.2021.05.034., Epub ahead of print. PMID: 34157306.