TMEM106Bは、TDP-43陽性封入体を伴う前頭側頭葉変性症(frontotemporal lobar denegeration with TDP-43 immunoreactive inclusions, FTLD-TDP)のリスク遺伝子として同定されました [1]。
またTDP-43タンパク凝集体はFTLD [2] や辺縁系優位型加齢性TDP-43脳症(limbic-predominant age-related TDP-43 encephalopathy, LATE) [3] など様々なTDP-43プロテイノパチーの脳内で観察されており、
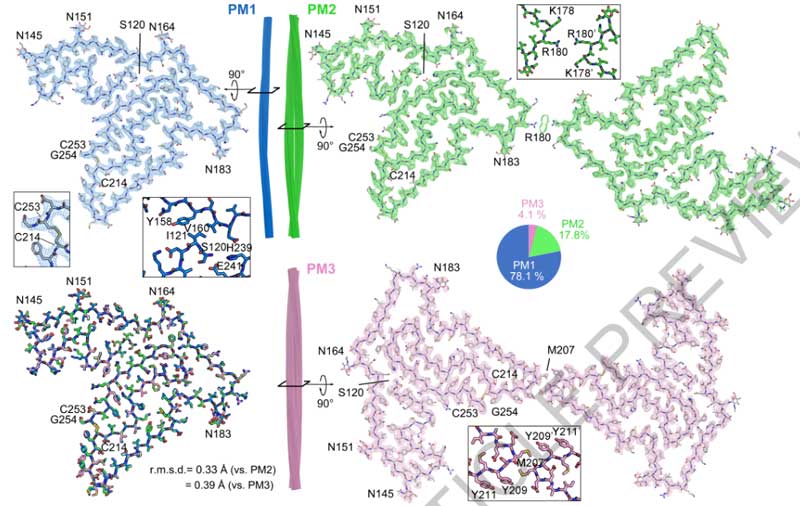
TMEM106B凝集体のcryo-EM解析第3段。 前回までのおさらいですが、最近、TMEM106B凝集体に関する論文がCellに1報、Natureに2報掲載されました。 Cellの論文は、アメリカ・コロンビア大学のDr …
TMEM106Bは、後期エンドソーム/リソソームの膜タンパクで、TDP-43プロテイノパチーのリスク多型となる遺伝子の一つでもあり [1]、以前から注目されていました。 特に昨年、FTLD-TDPや、普通のAging脳内 …
これまで、TMEM106BとTDP-43プロテイノパチーとの関係について、色々と調べられてきました [4, 5, 6, 7] 。
以前は全く別の疾患と考えられていたものが、共通のリスク因子や病理を持つことが多いという認識が広まり、神経変性疾患の枠組みも大きく変わってきていると感じます。 今回の論文は、frontotemporal lobar deg …
今回は、前頭側頭葉変性症(Frontotemporal lobar degeneration, FTLD)の約半数を占める 「TDP43凝集体を伴うFTLD(FTLD-TDP)」 …に深く関与する、 Progranuli …
今回、アメリカ・メイヨークリニックの Dr. Prudencio, Dr. Petrucelli, Dr. Cook らのグループは、
「TMEM106Bで、FTLD-TDPの進行を遅らせるバリアントがあり、TMEM106bのコアタンパク部分の沈着がFTLD-TDPの病態進行に関わっていそうだ」
という事を報告しました [8]。

TMEM106Bのコア蛋白の蓄積がTDP-43の病態に関与
FTLD-TDPの進行抑制と関連がありそうなTMEM106Bバリアント
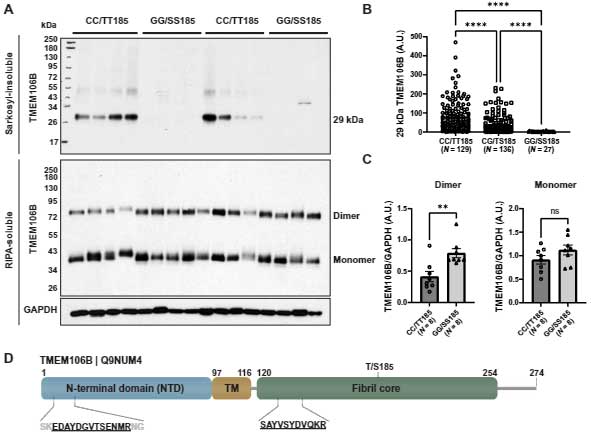
彼らは、メイヨー・クリニックに保管されている患者のデータをもとに、TMEM106BのバリアントとFLTD-TDPの罹患期間との関係を調べました(N=228)。
すると、「TMEM106B rs3173614」のGG/SS185のバリアントを持つFTLD-TDPの患者は罹病期間の中央値が他のバリアント(CC/TT185, CG/TS185)と比べて4年ほど長い事がわかりました。
TMEM106bのフィブリルコア部分を認識する抗体の作製
この保護variantとFTLD-TDPとの関係を調べるため、彼らは従来のTMEM106B抗体ではなく、TMEM106Bフィブリルコア部分に特異的に結合する抗体を作製しました。
この抗体を用いて、ウェスタンブロット(WB)でサルコシル不溶画分を観察すると、グリコシル化されたTMEM106Bが29kDaの部分に観察されました(脱グリコシル剤 PNGase で処置すると、14kDaに観察)。
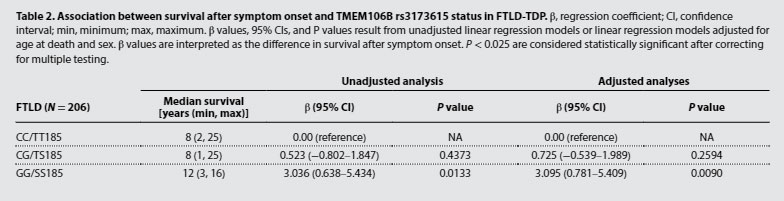
TMEM106Bのフィブリルコア部分は、TEME106BのFTLD-TDP保護バリアントで減少
彼らはTMEM106b N末抗体と、TMEM106b コア抗体とで、患者脳内にある TMEM106b のサルコシル不溶画分とRIPA可溶画分を WB で観察すると、TMEM106BのFTLD-TDP保護バリアントではN末抗体で認識されるTMEM106bは差がありませんでしたが、コア抗体で認識されるグリコシル化TMEM106bは他のバリアントよりも有意に減少していました。

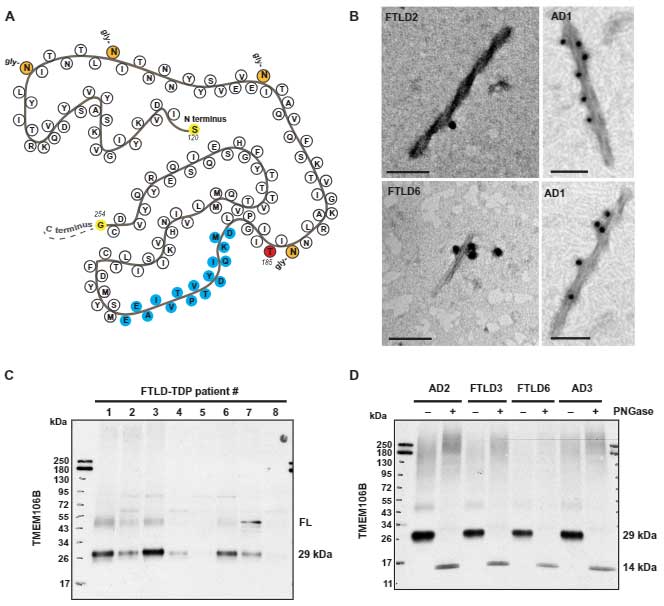
TME106bのフィブリルコア蓄積はFTLD-TDP TypeAと最も関連が強い
FTLD-TDPはA, B, C, D, Eと5つの病理タイプが報告されていますが、サルコシル不溶TMEM106bフィブリルコアの量が最も多かったのは、FDLD-TDP TypeA の症例でした。
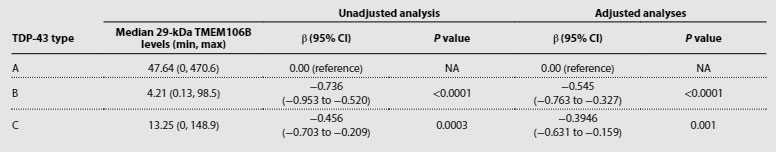
TME106bのフィブリルコア蓄積はTDP-43の機能喪失と関連がある
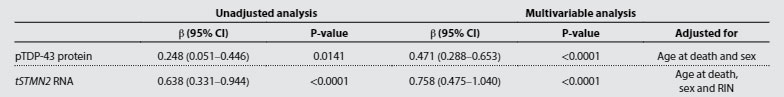
TMEM106bのフィブリルコア蓄積がTDP-43の病態と関連があるかどうか調べるため、彼らはリン酸化TDP-43の蓄積と、TDP-43欠失によって現れるcryptic exonの一つ、tSTMN2の RNA量を調べました。
すると、TMEM106bフィブリルコア蓄積が多い症例では、リン酸化TDP-43の量も、tSTMN2のRNA量も上昇しており、TMEM106bのフィブリルコア蓄積はTDP-43の病態と深く関連している可能性が示唆されました。
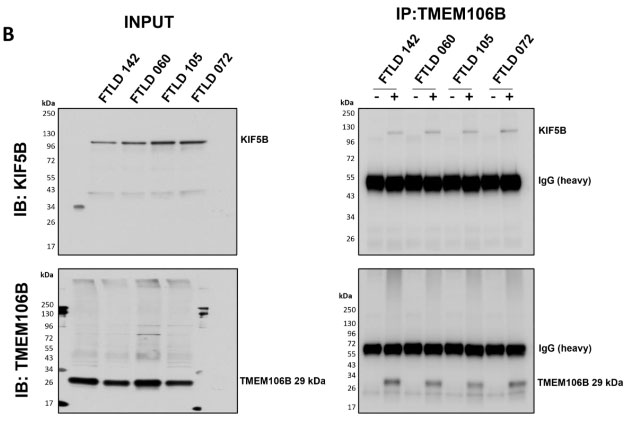
その他、TMEM106Bが関連していそうなパスウェイ等を調べるため、サルコシル不溶画分の29kDaTMEM10bを免疫沈降(Immunoprecipitation, IP)し、質量分析 (mass spectrometry, MS)にかけて関連タンパクを調べてみました。
Gene Ontology (GO) 解析の結果、
- cytoplasmic translation
- ribosome
- intracellular transport
- endocytosis
- pathways of neurodegeneration
などに関連するタンパクが共沈され、
特に、小胞体輸送や早期エンドソームに関連の強い、
- clathrin-mediated endocytosis
- early endosome antigen 1
- Ras-associated binding (RAB) family members
や、レトロマー複合体メンバーの
- vasuolar protein sorting-associated protein 26A (VPS16A)
- VPS35
- VPS29
などが有意にエンリッチメントされていました。
"Pathways of neurodegeneration" 関連では、
- TRAF family member associated NFKB activator (TANK)-binding kinase 1 (TBK1)
- optineurin
- valosin-containing protein (VCP)
などがエンリッチメントされており、KIF5Bは実際にTMEM106BのIPで確認されました。
My View
TMEM106Bは、FTLD-TDPやLATEの他、様々な変性疾患や加齢性疾患の脳内で観察されることがわかってきました [2, 3, 9, 10]。
その凝集体は、TMEM106BのS120領域で切断されたC末側で構成されていますが [8]、
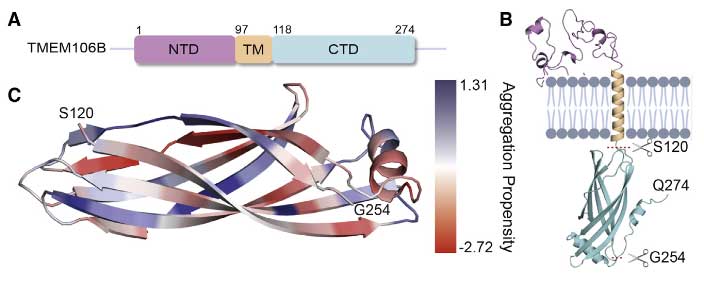
今回はそれよりC末側の191-206をエピトープとした抗体を作製し、TMEM106BフィブリルコアとTDP-43凝集体蓄積、TDP-43機能障害、そして、FTLD-TDPの病期に関連するハプロタイプとの関係について調べていました。
この凝集体、TDP-43と同じく、変性疾患脳と加齢脳に現れるという事で、加齢性疾患の謎を解く鍵があるんじゃないかと、個人的に多いに興味をもって動向を観察しています。
今のところは、TMEM106Bはリソソームの膜タンパクという事で、リソソーム系の機能低下が関連している可能性が高いと思いますが、それだけだったらTDP-43が核内から喪失しなくてもいいんじゃないかとも思うので……何か+αのメカニズムがこれからも色々出てくるんじゃないかなー?
References
- Van Deerlin VM, Sleiman PM, Martinez-Lage M, Chen-Plotkin A, Wang LS, Graff-Radford NR, Dickson DW, Rademakers R, Boeve BF, Grossman M, Arnold SE, Mann DM, Pickering-Brown SM, Seelaar H, Heutink P, van Swieten JC, Murrell JR, Ghetti B, Spina S, Grafman J, Hodges J, Spillantini MG, Gilman S, Lieberman AP, Kaye JA, Woltjer RL, Bigio EH, Mesulam M, Al-Sarraj S, Troakes C, Rosenberg RN, White CL 3rd, Ferrer I, Lladó A, Neumann M, Kretzschmar HA, Hulette CM, Welsh-Bohmer KA, Miller BL, Alzualde A, Lopez de Munain A, McKee AC, Gearing M, Levey AI, Lah JJ, Hardy J, Rohrer JD, Lashley T, Mackenzie IR, Feldman HH, Hamilton RL, Dekosky ST, van der Zee J, Kumar-Singh S, Van Broeckhoven C, Mayeux R, Vonsattel JP, Troncoso JC, Kril JJ, Kwok JB, Halliday GM, Bird TD, Ince PG, Shaw PJ, Cairns NJ, Morris JC, McLean CA, DeCarli C, Ellis WG, Freeman SH, Frosch MP, Growdon JH, Perl DP, Sano M, Bennett DA, Schneider JA, Beach TG, Reiman EM, Woodruff BK, Cummings J, Vinters HV, Miller CA, Chui HC, Alafuzoff I, Hartikainen P, Seilhean D, Galasko D, Masliah E, Cotman CW, Tuñón MT, Martínez MC, Munoz DG, Carroll SL, Marson D, Riederer PF, Bogdanovic N, Schellenberg GD, Hakonarson H, Trojanowski JQ, Lee VM. Common variants at 7p21 are associated with frontotemporal lobar degeneration with TDP-43 inclusions. Nat Genet. 2010 Mar;42(3):234-9. doi: 10.1038/ng.536. Epub 2010 Feb 14. PMID: 20154673; PMCI D: PMC2828525.
- Tropea TF, Mak J, Guo MH, Xie SX, Suh E, Rick J, Siderowf A, Weintraub D, Grossman M, Irwin D, Wolk DA, Trojanowski JQ, Van Deerlin V, Chen-Plotkin AS. TMEM106B Effect on cognition in Parkinson disease and frontotemporal dementia. Ann Neurol. 2019 Jun;85(6):801-811. doi: 10.1002/ana.25486. PMID: 30973966; PMCID: PMC6953172.
- Zhou X, Brooks M, Jiang P, Koga S, Zuberi AR, Baker MC, Parsons TM, Castanedes-Casey M, Phillips V, Librero AL, Kurti A, Fryer JD, Bu G, Lutz C, Dickson DW, Rademakers R. Loss of Tmem106b exacerbates FTLD pathologies and causes motor deficits in progranulin-deficient mice. EMBO Rep. 2020 Oct 5;21(10):e50197. doi: 10.15252/embr.202050197. Epub 2020 Aug 5. PMID: 32761777; PMCID: PMC7534638.
- Feng T, Mai S, Roscoe JM, Sheng RR, Ullah M, Zhang J, Katz II, Yu H, Xiong W, Hu F. Loss of TMEM106B and PGRN leads to severe lysosomal abnormalities and neurodegeneration in mice. EMBO Rep. 2020 Oct 5;21(10):e50219. doi: 10.15252/embr.202050219. Epub 2020 Aug 10. PMID: 32852886; PMCID: PMC7534636.
- Werner G, Damme M, Schludi M, Gnörich J, Wind K, Fellerer K, Wefers B, Wurst W, Edbauer D, Brendel M, Haass C, Capell A. Loss of TMEM106B potentiates lysosomal and FTLD-like pathology in progranulin-deficient mice. EMBO Rep. 2020 Oct 5;21(10):e50241. doi: 10.15252/embr.202050241. Epub 2020 Sep 14. PMID: 32929860; PMCID: PMC7534633.
- Jiang YX, Cao Q, Sawaya MR, Abskharon R, Ge P, DeTure M, Dickson DW, Fu JY, Ogorzalek Loo RR, Loo JA, Eisenberg DS. Amyloid fibrils in FTLD-TDP are composed of TMEM106B and not TDP-43. Nature. 2022 May;605(7909):304-309. doi: 10.1038/s41586-022-04670-9. Epub 2022 Mar 28. PMID: 35344984; PMCID: PMC9844993.
- Neumann M, Perneel J, Cheung S, Van den Broeck M, Nygaard H, Hsiung GR, Wynants S, Heeman B, Rademakers R, Mackenzie IRA. Limbic-predominant age-related TDP-43 proteinopathy (LATE-NC) is associated with abundant TMEM106B pathology. Acta Neuropathol. 2023 Jul;146(1):163-166. doi: 10.1007/s00401-023-02580-2. Epub 2023 May 12. PMID: 37171635.
- Marks JD, Ayuso VE, Carlomagno Y, Yue M, Todd TW, Hao Y, Li Z, McEachin ZT, Shantaraman A, Duong DM, Daughrity LM, Jansen-West K, Shao W, Calliari A, Bejarano JG, DeTure M, Rawlinson B, Casey MC, Lilley MT, Donahue MH, Jawahar VM, Boeve BF, Petersen RC, Knopman DS, Oskarsson B, Graff-Radford NR, Wszolek ZK, Dickson DW, Josephs KA, Qi YA, Seyfried NT, Ward ME, Zhang YJ, Prudencio M, Petrucelli L, Cook CN. TMEM106B core deposition associates with TDP-43 pathology and is increased in risk SNP carriers for frontotemporal dementia. Sci Transl Med. 2024 Jan 17;16(730):eadf9735. doi: 10.1126/scitranslmed.adf9735. Epub 2024 Jan 17. PMID: 38232138; PMCID: PMC10841341.
- Chang A, Xiang X, Wang J, Lee C, Arakhamia T, Simjanoska M, Wang C, Carlomagno Y, Zhang G, Dhingra S, Thierry M, Perneel J, Heeman B, Forgrave LM, DeTure M, DeMarco ML, Cook CN, Rademakers R, Dickson DW, Petrucelli L, Stowell MHB, Mackenzie IRA, Fitzpatrick AWP. Homotypic fibrillization of TMEM106B across diverse neurodegenerative diseases. Cell. 2022 Apr 14;185(8):1346-1355.e15. doi: 10.1016/j.cell.2022.02.026. Epub 2022 Mar 4. PMID: 35247328; PMCID: PMC9018563.
- Schweighauser M, Arseni D, Bacioglu M, Huang M, Lövestam S, Shi Y, Yang Y, Zhang W, Kotecha A, Garringer HJ, Vidal R, Hallinan GI, Newell KL, Tarutani A, Murayama S, Miyazaki M, Saito Y, Yoshida M, Hasegawa K, Lashley T, Revesz T, Kovacs GG, van Swieten J, Takao M, Hasegawa M, Ghetti B, Spillantini MG, Ryskeldi-Falcon B, Murzin AG, Goedert M, Scheres SHW. Age-dependent formation of TMEM106B amyloid filaments in human brains. Nature. 2022 May;605(7909):310-314. doi: 10.1038/s41586-022-04650-z. Epub 2022 Mar 28. PMID: 35344985; PMCID: PMC9095482.