TMEM106B凝集体のcryo-EM解析第3段。
前回までのおさらいですが、最近、TMEM106B凝集体に関する論文がCellに1報、Natureに2報掲載されました。
Cellの論文は、アメリカ・コロンビア大学のDr.Fitzpatric、カナダ・英コロンビア大学のDr.Mackenzieらの研究グループからで、FTLD-TDP, PSP, DLBの患者さんの脳内でTMEM106Bの凝集体があることをcryo-EMとMSの解析から明らかになった、というもの [1]。
先日、TMEM106Bに関する驚きの論文がCellに1報、Natureに2報掲載されました。 Cellの論文は、アメリカ・コロンビア大学のDr.Fitzpatric、カナダ・英コロンビア大学のDr.Mackenzieらの …
Natureの1報は、イギリス・MRC研究所のDr. Goedert、Dr. Scheresらの研究グループからで、色々な神経変性疾患の他、健常高齢者の脳内でもTMEM106Bの凝集体が観察された、というcryo-EMでの解析 [2]。
前回 [1] に引き続き、 TMEM106Bに関する論文。 今回は、Nature誌に掲載された、イギリス・MRC研究所のDr. Goedert、Dr. Scheresらの研究グループからで、色々な神経変性疾患の他、健常高 …
そして今回の論文は、アメリカ・UCLAのDr. Eisenbergらの研究グループからで、
同じくcryo-EMでFTLD-TDPの脳内にTMEM106Bの凝集体が観察され、FTLD-TDPのアミロイドフィブリルの構成タンパクはなんとTDP-43じゃないくてほとんどTMEM106Bだった、という内容 [3] 。
Frontotemporal lobar degeneration (FTLD) is the third most common neurodegenerative condition, following only Alzheimer’s and Parkinson’s diseases1. FTLD typically presents in 45-64-year-olds with behavioral changes or progressive decline of language skills2. The subtype FTLD-TDP is characterized by certain clinical symptoms and pathological neuronal inclusions detected by TAR DNA-binding protein (TDP-43) immunoreactivity3. Here, we extracted amyloid fibrils from brains of four patients, representing four out of five FTLD-TDP subclasses and determined their near-atomic resolution structures by cryogenic electron-microscopy (cryo-EM). Unexpectedly, all amyloid fibrils examined are composed of a 135-residue C-terminal fragment of transmembrane protein 106B (TMEM106B), a lysosomal membrane protein previously implicated as a genetic risk factor for FTLD-TDP4. In addition to TMEM106B fibrils, abundant non-fibrillar aggregated TDP-43 is present, as revealed by immunogold labeling. Our observations confirm that FTLD-TDP is an amyloid-involved disease and suggest that amyloid involvement in FTLD-TDP is of protein TMEM106B, rather than of TDP-43.
これはタイトルを見た瞬間に「え!?どーゆーこと!?」と思わず口走ってしまいました。
研究背景
TMEM106Bは274aaのII型膜貫通型蛋白で、脳・心臓・甲状腺・副腎・精巣などに多く [4] 、脳内では神経・グリア・内皮細胞・ペリサイトなどのリソソームとエンドソームの膜に存在しています [5] 。
APPと同じように細胞膜の外側と膜内で2段階切断を受け、内腔側ドメインのC末側はリソソーム内に放出されます。
何らかのリソソームタンパク分解酵素として機能していると推測されていますが、どんな酵素なのかはまだはっきりとはわかっていません。
変性疾患との関係については私も何度かこのブログで取り上げましたが、
以前は全く別の疾患と考えられていたものが、共通のリスク因子や病理を持つことが多いという認識が広まり、神経変性疾患の枠組みも大きく変わってきていると感じます。 今回の論文は、frontotemporal lobar deg …
今回は、前頭側頭葉変性症(Frontotemporal lobar degeneration, FTLD)の約半数を占める 「TDP43凝集体を伴うFTLD(FTLD-TDP)」 …に深く関与する、 Progranuli …
TMEM106Bの多型は、FTD/ALS、LATE、Hippocampal sclerosisなど、TDP-43プロテイノパチーのリスク遺伝子として知られており、特にgranulin遺伝子 (GRN) 変異との関連が強く、
これまでは疾患のモジュレーターとして考えられていたと思います。
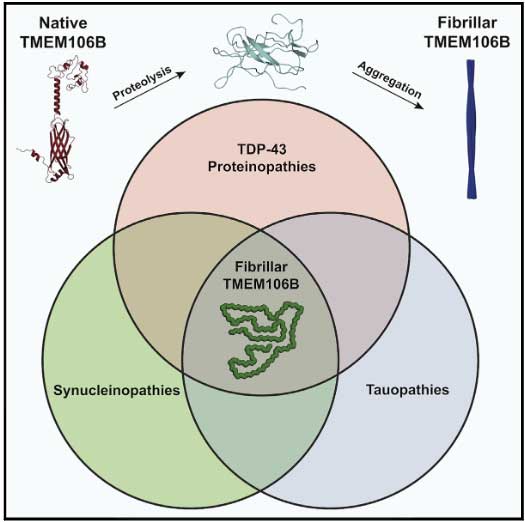
それが今回の3報では、TEME106B自身が人の脳内で凝集体を形成して沈着していることがわかり [1, 2, 3] 、
もしこれが他の蛋白のように変性疾患の病態に大きく関わっているようであれば、タウオパチー・シヌクレイノパチー・TDP-43プロテイノパチーに引き続き、「TMEM106Bプロテイノパチー」のような概念が出てくるかもしれません。
そして今回彼らが主張するように、「FTLD-TDPの主要凝集体はTDP-43じゃなくてTMEM106Bだ」という事になれば、これからのFTLD-TDPの方向性も変わってくるかもしれません。
と、前置きが長くなったところで、問題の論文を読んでいきたいと思います。

FTLD-TDPのアミロイドフィブリルはTDP-43じゃなくてTMEM106B!?
FTLD-TDPの脳内フィブリルを抽出
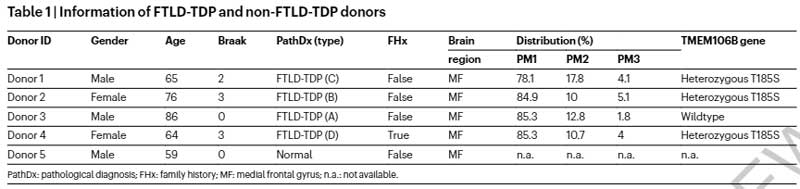
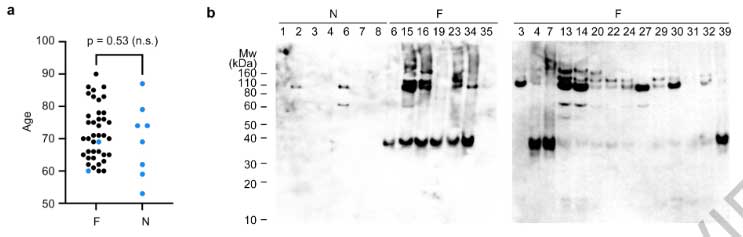
彼らは、メイヨー・クリニックブレインバンクに保管されている凍結脳のうち、FTLD-TDP (40症例) とnon-FTLD-TDP (8例) からdetergent不溶性分画 (glossary参照) し、ネガティブ染色透過型電子顕微鏡 (negative stain transmission electron microscopy, NSTEM) で観察しました。
- FTLD-TDP (n=40)
- Type A: (n=20)
- Type B: (n=5)
- Type C: (n=14)
- Type D: (n=1)
- non-FTLD-TDP (n=8)
- Normal: (n=2)
- VaD: (n=3)
- PART: (n=3)
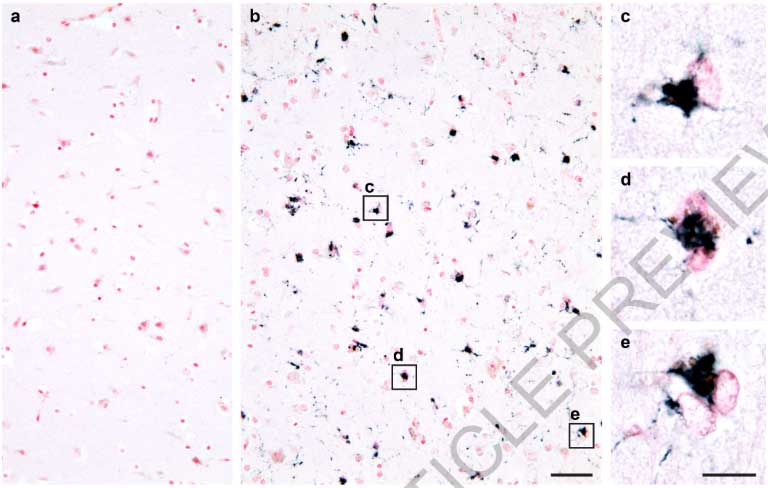
すると、FTLD-TDPの40症例中38症例にアミロイドフィブリルおよびnon-fibrillar aggregatesを認め (下図のDonor 1-4) 、コントロール群には1例もアミロイドフィブリル認めませんでした (下図のDonor 5)
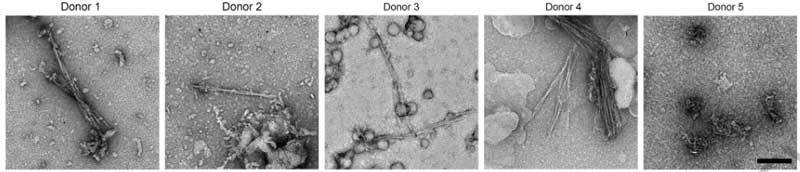
彼らはFTLD-TDPのうち異なる病理型
- Donor 1: FTLD-Type A
- Donor 2: FTLD-Type B
- Donor 3: FTLD-Type C
- Donor 4: FTLD-Type D
を選んで
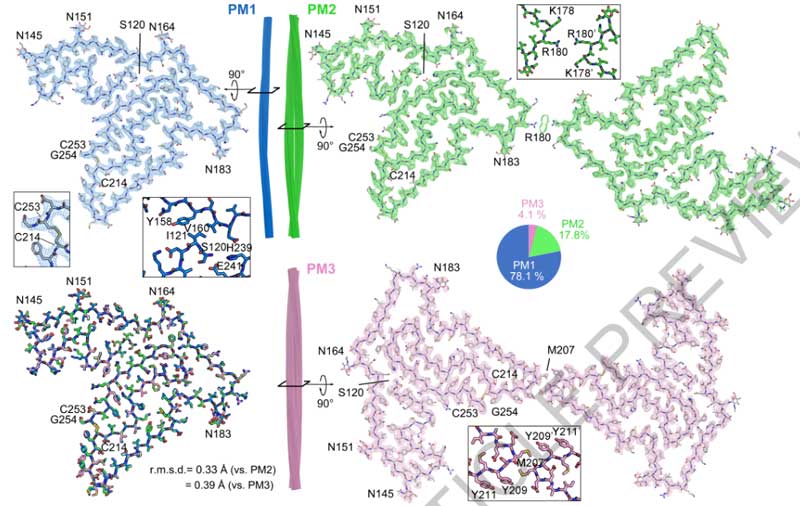
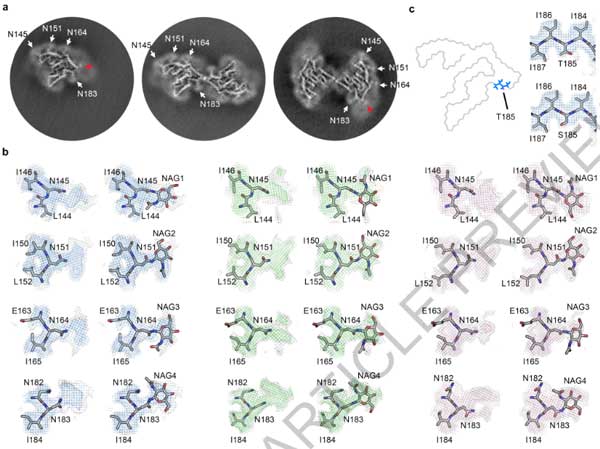
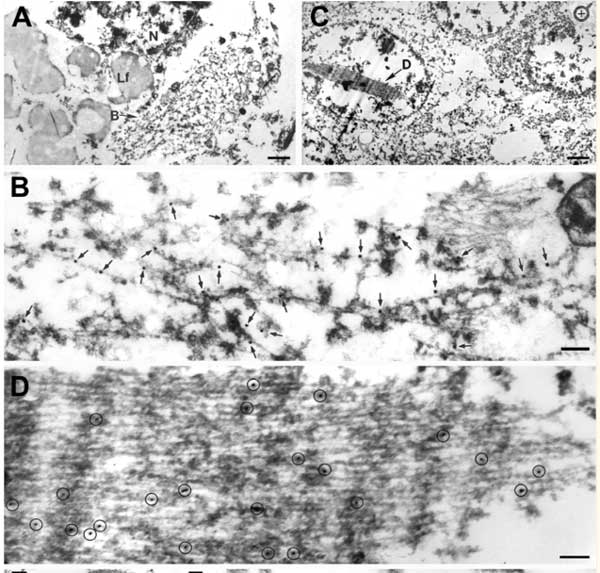
cryo-EMで確認したところ、いずれの症例にも3種類の異なるタイプのフィブリルを認め、それぞれPM1, PM2, PM3と命名しました。

最初著者らは、これらのフィブリルはTDP-43だと思っていました。
ところが、側鎖の電子密度とTTDP-43のシークエンスが合致せず、このフィブリルは違う蛋白で構成されている可能性が出てきました。
彼らは、このフィブリルの構成蛋白の正体を突き止めるため、PM1フィブリルを使って、既知の蛋白シークエンスを検証していきました。
すると、数ある蛋白の中からTMEM106Bが候補として浮上し、
- TMEM106Bのシークエンスが合致し、全ての電子密度の説明がつく
- Asn145, Asn151, Asn164, Asn183の電子密度がTMEM106BのN-linked グリコシル化部位と一致する
- 2つの側鎖を繋ぐ電子密度は、Csy214とCsy253間のジスルフィド結合と考えられる
などが予測されました。
PM2とPM3も、多少の調整は必要なものの、概ねTMEM106Bの上記の推測結果と一致しました。
cryo-EMの結果からは、このフィブリルは全長のTMEM106Bではなく、C末側断片と考えられ、
フィブリルコアのN末にあたるSer120はTyr158, Val160, His239, Glu241で隠れた構造になっていました。
以上の結果から、Arg119とSer120の間で切断されたTMEM106BのC末側がフィブリルを形成すると結論付けました。
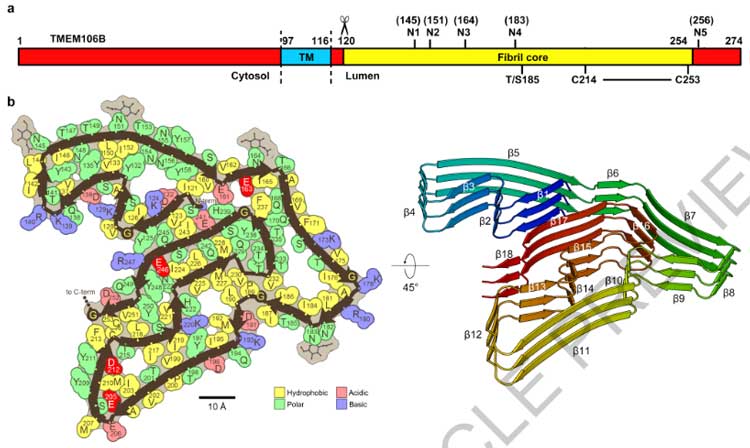
一方で、フィブリルコアのC末側のGly254は外側に露出しており、残りのC末側20塩基はくっついてはいるものの無秩序な状態となっていました。
上記部分を除いた、orderedコア (120aa-254aa) 部位は、TMEM106Bの管腔側ドメインと一致していました。
TMEM106Bフィブリルのcryo-EM解析
プロトフィラメントのうち、
- PM1は1対のプロトフィラメント
- PM2とPM3は2対の左右対称なプロトフィラメント
で構成されておりました。
また、PM2とPM3のインターフェースは下記のように異なっていました。
- PM2はArg180の側鎖がインターフェースの真ん中に突き出ている
- PM3はMet207とTyr209残基の間で疎水性相互作用を有する
構造の違いとしては、
- PM3のGlu206, Met207, Tyr209,Try211の回転異性体がPM1/PM2と違う
という事が挙げられました。
ゴルフコースを連想させる18のβストランド
PM3は18のβストランドで構成されていたので、著者らはこの折りたたみ構造から"ゴルフコース"を連想しました。
18のβストランドはそれぞれ長さが異なっており (3-15aa) 、折れ曲がり方はゴルフコースのフェアウェイのようでした。
さらに、N末とC末のストランドは互いに近づいて存在しており、あたかもゴルフコースの1stと18thホールがクラブハウス近くに建設されているかのようでした。
この18のβストランドは典型的なアミロイドフィブリルを構成しており、複数のジッパー構造で強固に安定していました。
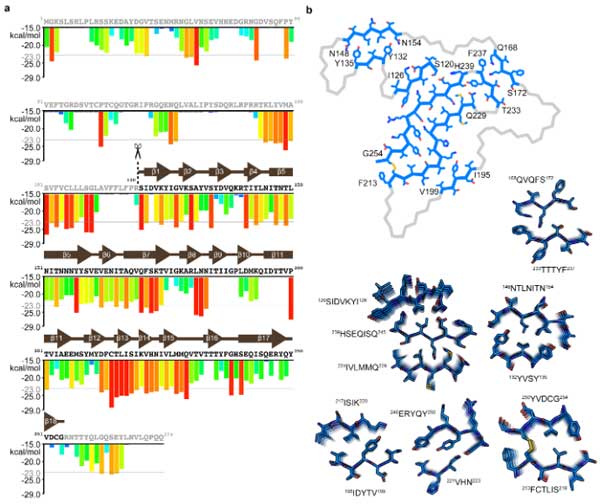
既知の63種類のアミロイドフィブリルと比較して [6] 、このゴルフコース構造はアミロイドフィブリルの平均の3倍程強く安定化した構造をしていました。
この強固に安定した構造のお陰で、2%サルコシルx1%SDSという強力なdetergentでも溶け残る事ができたのでしょう。
TMEM106B凝集体に特徴的な酸性側鎖の構造
TMEM106Bフィブリルに特徴的な構造の1つに、
- Glu163
- Glu205
- Asp212
- Glu246
の4つの非補完的な酸性側鎖が内側を向いている事が挙げられます。
このような非補完的な埋もれた負電荷は病原性アミロイドではまれで、普通、同じ電荷を持つ分子間の静電反発によってフィブリルが弱体化するはずです。
けれども、TMEM106Bがリソソームタンパク質であり、このドメインが内腔側ドメインである事を考えると、リソソーム内のpHが、内向きの酸をプロトン化して中和するのに十分低いのかもしれません。
リソソーム内の低pHがこれらの負電荷を中和することで、フィブリル形成の障害を克服できた可能性が考えられそうです。
4人のドナーで維持されている構造とちょっとした違い
著者らは4人のFTLD-TDP患者を主に解析しましたが、全てのドナーで同じゴルフコース様の18βストランド構造が観察されました。
全ての患者で3つの多型 (PM1, PM2, PM3) を有していましたが、
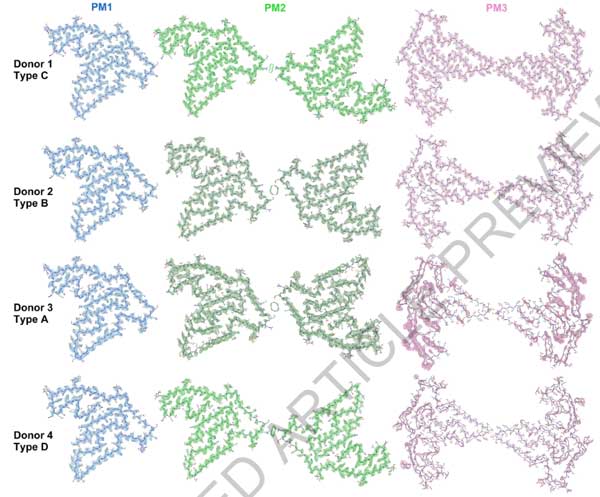
PM2のプロトフィラメント-プロトフィラメント界面には、ドナー間でちょっとした違いがありました。
- ドナー1と4: 界面はLys178を中心
- ドナー2と3: 界面はArg180を中心
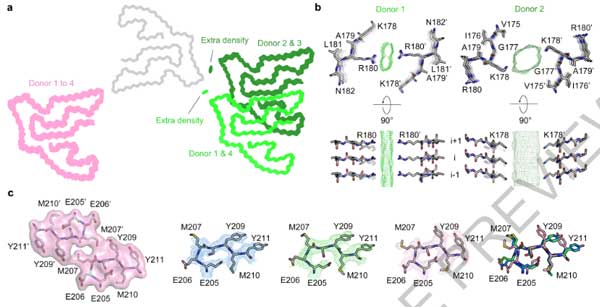
これらの構造の違いと、FLLD-TDPのサブタイプの違いや年齢などと関連しているかどうかは、現時点ではよくわかりません。
4人のうちDonor 3はWTのTMEM106Bで、残り3人 (Donor 1, 2, and 4) はThr185Ser多型 (Glossary参照) を持っていました。
ただ、ヘテロ接合体のドナーのフィブリルが野生型だけなのか、変異体だけなのか、あるいはその両方が混在しているのかの確認は不可能でした。
185残基はフィブリルコア内に存在していますが、Thr/Ser185側鎖は溶媒部に面しており、フィブリル構造生成において寄与する相互作用はないため、今回観察されたフィブリルは野生型とThr185Serのどちらも収容することが可能と考えられます。
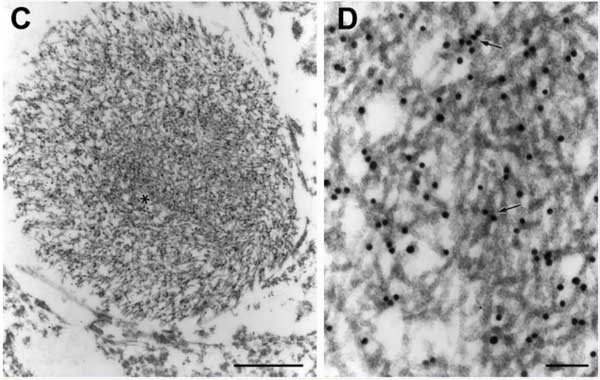
ウェスタンブロット・質量分析・免疫電顕でも確認
cryo-EMで明らかとなった凝集体が本当にTMEM106Bなのか確認するため、彼らはウェスタンブロッティング (western blotting, WB) 、質量分析 (mass spectrometry, MS) 、免疫電顕などでも調べてみました。
WB
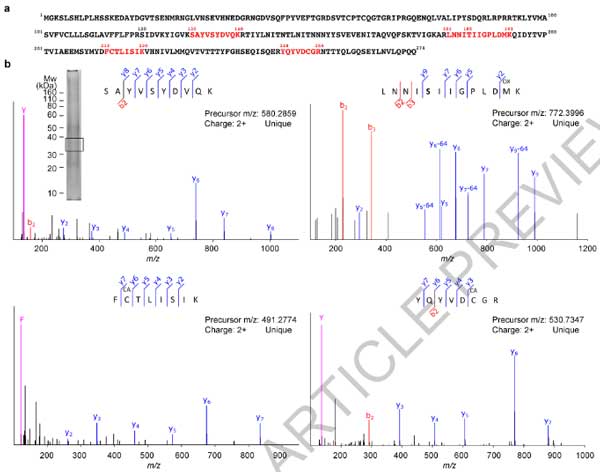
TMEM106BのC末抗体を使ってWBを行うと、サルコシル不溶画分の~35kDaの高さに陽性バンドを認め、TMEM106BのC末切断 (120-175) +5箇所の糖鎖と予測されました。
これらのバンドは、FTPD-TDP患者の脳内でのみ認められ、それ以外の人達の脳内ではありませんでした。
MS
さらに彼らは、このゲルの~35KDa部分を切り取ってMSで解析し、これらがTMEM106Bの内腔側ドメインであることを確認しました。
免疫電顕
彼らは下記TMEM106B抗体を使って免疫電顕も試みましたが、
- TMEM106B 2-53
- TMEM106B 204-253
- TMEM106B 218-252
これらの抗体でフィブリルはラベリングされませんでした。
これは予測されていたことで、これらの抗体はフィブリルコアを形成する部分より前を認識したり (2-53) 、フィブリルコアの内側で隠れている部分 (204-253, 218-252) を認識していると考えられます。
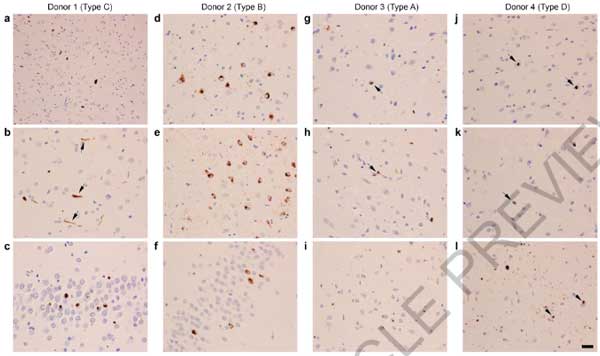
FTLD-TDP患者さんの脳内を普通の組織免染でみても凝集体は確認されず、これも上記のように抗体達がTMEM106Bフィブリルコアに結合できないためと考えられました。
この問題を解決するためには、TMEM106Bのコアから外れたfuzzy-coatの部分 (255-274) を認識する抗体の作成が必要、と彼らはコメントしています。
サルコシル不溶画分だとTDP-43凝集体が観察できる
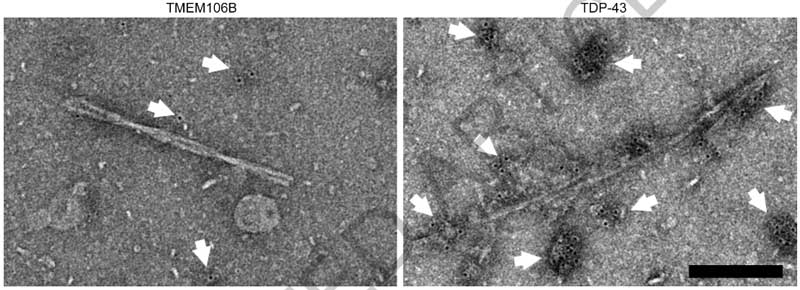
一方、気になるTDP-43凝集体についてですが、彼らはリン酸化TDP-43抗体 (p409/410) [7] を使ってサルコシル不溶画分をWBや免疫電顕で確認してみました。
すると既報通り [8]、WBではサルコシル不溶画分にTDP-43のバンドを認め、
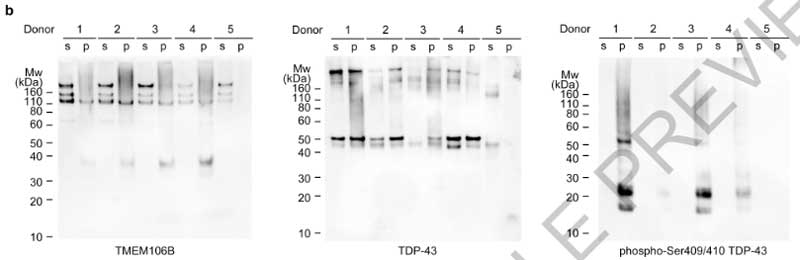
免疫電顕でも、サルコシル不溶画分の凝集体はTDP-43抗体でラベリングされており、FTLD-TDPの脳内では確かにTDP-43が凝集しているようでした。
ただし、それらのラベリングはフィブリル化されていない凝集体 (non-fibrillar aggregates) で、電験上で確認されているフィブリルはTDP-43抗体ではラベリングされませんでした。
このTDP-43抗体でラベリングされていないフィブリルが、TMEM106Bのフィブリルと推測されました。
Frontotemporal lobar degeneration (FTLD) is the third most common neurodegenerative condition, following only Alzheimer’s and Parkinson’s diseases1. FTLD typically presents in 45-64-year-olds with behavioral changes or progressive decline of language skills2. The subtype FTLD-TDP is characterized by certain clinical symptoms and pathological neuronal inclusions detected by TAR DNA-binding protein (TDP-43) immunoreactivity3. Here, we extracted amyloid fibrils from brains of four patients, representing four out of five FTLD-TDP subclasses and determined their near-atomic resolution structures by cryogenic electron-microscopy (cryo-EM). Unexpectedly, all amyloid fibrils examined are composed of a 135-residue C-terminal fragment of transmembrane protein 106B (TMEM106B), a lysosomal membrane protein previously implicated as a genetic risk factor for FTLD-TDP4. In addition to TMEM106B fibrils, abundant non-fibrillar aggregated TDP-43 is present, as revealed by immunogold labeling. Our observations confirm that FTLD-TDP is an amyloid-involved disease and suggest that amyloid involvement in FTLD-TDP is of protein TMEM106B, rather than of TDP-43.
My View
今回、「FTLD-TDPのアミロイドフィブリルはTDP-43じゃなくてTMEM106Bで構成されている」という衝撃的なタイトルでしたが、そんな事を主張するだけあって、かなりしっかりとした解析内容だと思いました。
ラストオーサーのDr. Eisenbergは、様々なタンパクのアミロイド構造について20年以上研究してきた人なのですが、これくらいの人じゃないとよっぽどの事は言えないような気がします。
彼の論文で私が一番強く記憶に残っているのは、2007年にNatureにpublishされたアミロイド構造に関する研究 [9] で、Aβ、タウ、α-Syn、PrPを含む色々な凝集化タンパクに共通のジッパー様の構造がありこれが強固なフィブリルを形成している、という報告です。
Degenerative diseases such as Alzheimer's or Parkinson's are associated with the misfolding of many diverse proteins, yet the amyloid fibrils formed by all these proteins are similar. David Eisenberg and colleagues have now identified 30 short fibril-forming peptides implicated in a range of amyloid diseases and have solved 13 of their atomic structures, revealing variations in one common feature — the 'steric zipper'.
で、今回の論文について。
強いアミロイドフィブリルを形成しているのは、今まで主要病理と思われていたTDP-43ではなくTMEM106Bだった、という内容ですが、
既報との違いは、フィブリルの抽出法にありそうな気がしました。
今までは2%サルコシルの不溶画分を解析しているものが多かったですが、本論文では2%サルコシルの後にさらに1%SDSを使用しており、より強力な界面活性剤を使用した事になります。
これくらい強力な界面活性作用に耐えられた構造物のみを解析したら、そのフィブリルはTMEM106Bだった、という事のようです。
in silicoの解析で、このフィブリルは通常の3倍くらい強い構造をしているそうなので、それがこの抽出法で溶けずに残った理由なのでしょう。
一応、本論文でもTDP-43凝集体は確認できていて、
でも電験でみると、TDP-43抗体は、2%サルコシル+1%SDSで抽出したTMEM106Bフィブリルと同様の構造物には結合せず、その周りにある凝集体に結合した、という事でした。
TDP-43凝集体の電験画像は既に報告があり [10]、この時は、組織切片を免疫電顕していて、フィラメント状の構造物にTDP-43抗体でラベリングされているように見えます。
ただ、解像度が粗くフィラメントの形までははっきりと見えていないので、本論文で抽出したようなフィラメント状の構造物と共存しているもう少しルースなTDP-43凝集体がラベリングされていた、と考える事もできるかもしれません。
ただ、このTMEM106Bアミロイドフィブリルが病態に影響を与えているかどうかはまだわかりません。
TDP-43凝集体の病態生理については数多く報告されていますし、脳内を伝播することも確認されています [11]。
TMEM106Bアミロイドフィブリルの病理機能については、これから続々と報告が上がってくるのだと思います。
TMEM106Bフィブリルの3論文の比較と感想
今回3つの論文をまとめてみて、「やっぱり説明が難しいなー」と思ったのは、
Schweighauser et al. の論文との違いについて。
個人的に疑問に思ったことなどを、いくつかまとめてみます。
疑問1:コントロール脳にもTMEM106Bフィブリルが存在するかどうか
Schweighauser et al.では、「Normal control でも年齢が高いとTMEM106Bフィブリルが観察される」となっているのに対し、
本論文では「ControlではTMEM106Bアミロイドフィブリルは検出されない」となっています。
先に挙げたように、2つの研究は抽出法が違うので、「コントロール脳のTMEM106Bフィブリルは、FTLD-TDP脳のTMEM106Bフィブリルよりもちょっとルースになっていて、1%SDSで溶解される」という可能性は残ります。
が、cryo-EMの結果を見る限り、ほぼほぼ同じ構造のTMEM106Bフィブリルを観察しているようなので、その可能性は低そうに思います。
疑問2:免染で検出できるかできないか
本論文では「この抗体ではフィブリルの内部にエピトープが隠れるから免染ではみられない」となっていますが、
Schweighauser et al. の論文では同じようなエピトープのC末抗体を使って免染で検出できています。
Schweighauser et al. は 1mM EDTA/0.05% Tween 20 (pH9) + 熱 で賦活していますが、これは結構強力な賦活法だと思います(そして、私の印象だとノンスペも多くなる……)。
この賦活法だと、隠れたエピトープが出てくるのでしょうか?
ただ、1% SDSでも構造が保たれるようなTMEM106Bアミロイドフィブリルが、この賦活法で壊れるかと問われると、私にはちょっとわからないのですが……(これに関して詳しい人がいたら教えてもらいたいです)。
疑問3:TMEM106B凝集体とTDP-43凝集体は同じ細胞に存在するのかどうか
いずれの論文でも組織でTMEM106BとTDP-43の二重染色の写真がないので、TMEM106BとTDP-43が同じ細胞で共局在するかどうかはわかりません。
ただ、Schweighauser et al. の論文では、免染のTMEM106B凝集体の形がTDP-43凝集体の形とだいぶ違うので、私のイメージとしては、お互い違う細胞でそれぞれ凝集体を形成するんじゃないかと推測しています。
TMEM106BとTDP-43がどのように関わっていくのか、それともそこまで関係ないのか、これからも気がけて追っていきたいです。
3報の共通点と相違点
3報の内容を比較するとこんな感じ▼
| Chang et al. (Cell, 2022) | Schwelghauser et al. (Nature, 2022) | Jiang et al. (Nature, 2022) | |
| 解析方法 |
|
|
|
| 趣旨 |
TMEM106Bで構成されるフィブリルが、FTLD-TDP/PSP/DLBなど色々な変性疾患の脳内に存在。 |
TMEM106Bで構成されるアミロイドフィラメントが、色々な変性疾患だけでなく正常加齢脳でも存在。 | FTLD-TDPの脳内に存在するアミロイドフィブリルは、TDP-43ではなくTMEM106Bで構成。non-FTLD-TDPではこのフィブリルを認めない。 |
| 症例 |
|
|
|
| 抽出法 |
|
|
|
| フィブリルコア | TMEM106B 120-254aa | TMEM106B 120-254aa | TMEM106B 120-254aa |
| フィブリル/フィラメントの種類 |
2種類
|
3種類
|
3種類
|
| 対の接合部 |
|
|
|
| βストランドの数 | 19 | 17 | 18 ("golf course") |
| 確認できたグリコシル化部位 |
|
|
|
| WBで使用したTMEM106B抗体のエピトープ |
204-253 (pAb, Novus Biologicals) |
239-250 (pAb) |
204-253 (pAb, Novus Biologicals) |
| WBで検出できたバンドの高さ |
|
|
|
| エピトープはフィブリルコア内にあるので、凝集体のバンドは確認できず。 | |||
| 免疫染色で使用した抗体 | なし |
抗体
賦活法
|
"免染では検出できない" という記述があるが、具体的なプロトコルの記載はなし。 |
| 免疫電顕で使用した抗体 | なし | なし |
|
Glossary
今回、どうやって凝集体を抽出したのかが、個人的に大いに気になるところだったので (抽出法の違いが結果の違いを生んでいる可能性があるので) 、その部分をメモメモ。
フィブリル抽出法①: 免疫電顕用(氷温サルコシル+SDS抽出法)
氷温サルコシル(+SDS)抽出法
凍結脳を
- homogenization-solubilization (HS) バッファー : 10 mL/gram
- (20mM Tris-HCl, pH7.5, 150mM NaCl, 0.1mM EDTA, 1mM dithiothreitol)
- プロテイナーゼ阻害剤 : 1:100 (v/v)
でホモジナイズする。
↓
さらにPolytron homogenizerで45秒間ホモジナイズし、
- 4% (w/v) サルコシル (N-lauroyl-sarcosine) : 10mL/gram
- 核酸分解酵素 (Benzonase) : 2 U/μl
- MgCl2 : 4mM
を加える。
↓
その後、300 rpmで振盪しながら37℃で45分間インキュベーションし、
↓
- ice-cold HSバッファー: 10 mL/gram
- サルコシル : 0.5% (w/v)
を混ぜて 3,000 x g, 4℃ で5分間遠心する。
↓
上清をとり、さらに 21,000 x g で30分間遠心する。
↓
上清を捨て、ペレットを
- Trisバッファー (20 mM Tris-HCl, pH 7.5, 150 mM NaCl) : 1.5 mL/gram
で懸濁し、4℃ overnight。
↓
翌日、6,000 x g で5分間遠心し、
↓
上清を新しいチューブに移して
- sodium dodecyl sulfate (SDS): 1% (w/v)
を加え、室温で15分間ローテートする。
↓
3分間ソニケーションをかけ、 6,000 x g で10分間遠心する。
↓
上清をとり、21,000 x gで30分間遠心し、
↓
ペレットを
- Trisバッファー (10 μL/gram)
で懸濁し、3分間ソニケーションをかけて電顕用に使用する。
フィブリル抽出報②:cryo-EM用(氷温サルコシル+SDS抽出と氷温水抽出法)
著者らは、氷温水抽出法でフィブリルを抽出し、氷温サルコシル(+SDS)抽出法と比較した。
氷温水(ice-cold water)抽出法
まず脳を粗切りして、
- Tris-calcium バッファー
- (20mM Tris, pH 8.0, 138 mM NaCl, 2mM CaCl2, 0.1% NaN3)
で懸濁し、3,100 x g, 4℃で5分間遠心する。
↓
上清をとり、Tris-calciumバッファーで4回以上洗う。
↓
5回目の洗いの時にペレットをTris-Calciumバッファーで懸濁し、500 rpm, 37℃で振盪しながらovernight。
↓
翌朝、3,100 x g, 4℃で30分間遠心し、
↓
ペレットを
- Tris-EDTAバッファー (4mL/gram)
- (20 mM Tris, pH 8.0m 140 mM NaCl, 10 mM EDTA, 0.1% NaN3)
で懸濁し、3,100 x g, 4℃で5分間遠心する。
↓
上清をとり、
- Tris-EDTAバッファー
で9回以上洗う。
↓
10回目の洗いの後、ペレットを
- 2 mL/gram ice-cold water
で懸濁し、
↓
3,100 x g, 4℃で5分間遠心する。
↓
フォブリルの入った上清をとり、このice-cold water抽出の工程を9回以上繰り返す。
この方法で抽出したフィブリルを電験でみて、氷温サルコシル(+SDS)法で抽出したフィブリルとほとんど同じ形態を示す事を確認した。

これにより、サルコシルは抽出過程でフィブリルフォーメーションに影響しない事がわかり、サルコシル(+SDS)法で抽出したほうがより多くて純度の高いフィブリルがとれたので、著者らはcryo-EMにもサルコシル(+SDS)抽出法で抽出したフィブリルをcryo-EMにも使用した。
TMEM106B Ser185Ser多型
Thr185Ser多型はFTLD-TDP患者のGWAS解析で検出され [12]、FTLD-TDPに対して保護的である事が示されている [13]。
野生型のThr185アイソフォームに比べ、タンパク発現が低く、分解も早いことから、その保護機構に寄与している可能性がある [14]
フィブリル (fibril) とフィラメント (filament) とファイバー (fiber) の違い
いずれも同じ意味で使われることもあるけれども、イメージとしては下記のような感じ。
- フィラメント: < Φ50 nm
- フィブリル: < Φ100 nm
- ファイバー: Φμm-mmの範囲
フィラメントは細長い撚り糸状の構造 (long, slender, thread-like object) 。
フィブリルは、フィラメントの側面にも色々とくっついたりして、さらに大きく成長したもの。
AβフィラメントとAβフィブリルに関しては、
- フィラメント: Φ3-4 nm
- フィブリル: Φ8-10 nm
- ファイバー: 3-5本のフィラメントが撚り糸状に重なる
などと報告されている [15]。
Answer (1 of 2): Fiber, fibril, filament. "Fiber" (or fibre) has two meanings: 1. long, slender, thread-like structures, such as nerve fibers (1-20 microns thick); and 2. the small usually stringy material in fruits and vegetables that cannot be digested. "Fibril" can mean fiber also, but general...
Pallitto MM, Murphy RM. A mathematical model of the kinetics of beta-amyloid fibril growth from the denatured state. Biophys J. 2001 Sep;81(3):1805-22. doi: 10.1016/S0006-3495(01)75831-6. Erratum in: Biophys J 2002 May;82(5):2826. PMID: 11509390; PMCID: PMC1301655.
References
- Chang A, Xiang X, Wang J, Lee C, Arakhamia T, Simjanoska M, Wang C, Carlomagno Y, Zhang G, Dhingra S, Thierry M, Perneel J, Heeman B, Forgrave LM, DeTure M, DeMarco ML, Cook CN, Rademakers R, Dickson DW, Petrucelli L, Stowell MHB, Mackenzie IRA, Fitzpatrick AWP. Homotypic fibrillization of TMEM106B across diverse neurodegenerative diseases. Cell. 2022 Mar 1:S0092-8674(22)00259-8. doi: 10.1016/j.cell.2022.02.026. Epub ahead of print. PMID: 35247328.
- Schweighauser M, Arseni D, Bacioglu M, Huang M, Lövestam S, Shi Y, Yang Y, Zhang W, Kotecha A, Garringer HJ, Vidal R, Hallinan GI, Newell KL, Tarutani A, Murayama S, Miyazaki M, Saito Y, Yoshida M, Hasegawa K, Lashley T, Revesz T, Kovacs GG, van Swieten J, Takao M, Hasegawa M, Ghetti B, Spillantini MG, Ryskeldi-Falcon B, Murzin AG, Goedert M, Scheres SHW. Age-dependent formation of TMEM106B amyloid filaments in human brains. Nature. 2022 Mar 28. doi: 10.1038/s41586-022-04650-z. Epub ahead of print. PMID: 35344985.
- Jiang YX, Cao Q, Sawaya MR, Abskharon R, Ge P, DeTure M, Dickson DW, Fu JY, Ogorzalek Loo RR, Loo JA, Eisenberg DS. Amyloid fibrils in disease FTLD-TDP are composed of TMEM106B not TDP-43. Nature. 2022 Mar 28. doi: 10.1038/s41586-022-04670-9. Epub ahead of print. PMID: 35344984.
- http://www.proteinatlas.org/
- Nicholson AM, Rademakers R. What we know about TMEM106B in neurodegeneration. Acta Neuropathol. 2016 Nov;132(5):639-651. doi: 10.1007/s00401-016-1610-9. Epub 2016 Aug 20. PMID: 27543298; PMCID: PMC5074873.
- Inukai Y, Nonaka T, Arai T, Yoshida M, Hashizume Y, Beach TG, Buratti E, Baralle FE, Akiyama H, Hisanaga S, Hasegawa M. Abnormal phosphorylation of Ser409/410 of TDP-43 in FTLD-U and ALS. FEBS Lett. 2008 Aug 20;582(19):2899-904. doi: 10.1016/j.febslet.2008.07.027. Epub 2008 Jul 24. PMID: 18656473.
- Laferrière F, Maniecka Z, Pérez-Berlanga M, Hruska-Plochan M, Gilhespy L, Hock EM, Wagner U, Afroz T, Boersema PJ, Barmettler G, Foti SC, Asi YT, Isaacs AM, Al-Amoudi A, Lewis A, Stahlberg H, Ravits J, De Giorgi F, Ichas F, Bezard E, Picotti P, Lashley T, Polymenidou M. TDP-43 extracted from frontotemporal lobar degeneration subject brains displays distinct aggregate assemblies and neurotoxic effects reflecting disease progression rates. Nat Neurosci. 2019 Jan;22(1):65-77. doi: 10.1038/s41593-018-0294-y. Epub 2018 Dec 17. PMID: 30559480.
- Sawaya MR, Hughes MP, Rodriguez JA, Riek R, Eisenberg DS. The expanding amyloid family: Structure, stability, function, and pathogenesis. Cell. 2021 Sep 16;184(19):4857-4873. doi: 10.1016/j.cell.2021.08.013. PMID: 34534463; PMCID: PMC8772536.
- Sawaya MR, Sambashivan S, Nelson R, Ivanova MI, Sievers SA, Apostol MI, Thompson MJ, Balbirnie M, Wiltzius JJ, McFarlane HT, Madsen AØ, Riekel C, Eisenberg D. Atomic structures of amyloid cross-beta spines reveal varied steric zippers. Nature. 2007 May 24;447(7143):453-7. doi: 10.1038/nature05695. Epub 2007 Apr 29. PMID: 17468747.
- Lin WL, Dickson DW. Ultrastructural localization of TDP-43 in filamentous neuronal inclusions in various neurodegenerative diseases. Acta Neuropathol. 2008;116(2):205-213. doi: 10.1007/s00401-008-0408-9</li< /a>>
- Porta S, Xu Y, Restrepo CR, Kwong LK, Zhang B, Brown HJ, Lee EB, Trojanowski JQ, Lee VM. Patient-derived frontotemporal lobar degeneration brain extracts induce formation and spreading of TDP-43 pathology in vivo. Nat Commun. 2018 Oct 11;9(1):4220. doi: 10.1038/s41467-018-06548-9. PMID: 30310141; PMCID: PMC6181940.
- Van Deerlin VM, Sleiman PM, Martinez-Lage M, Chen-Plotkin A, Wang LS, Graff-Radford NR, Dickson DW, Rademakers R, Boeve BF, Grossman M, Arnold SE, Mann DM, Pickering-Brown SM, Seelaar H, Heutink P, van Swieten JC, Murrell JR, Ghetti B, Spina S, Grafman J, Hodges J, Spillantini MG, Gilman S, Lieberman AP, Kaye JA, Woltjer RL, Bigio EH, Mesulam M, Al-Sarraj S, Troakes C, Rosenberg RN, White CL 3rd, Ferrer I, Lladó A, Neumann M, Kretzschmar HA, Hulette CM, Welsh-Bohmer KA, Miller BL, Alzualde A, Lopez de Munain A, McKee AC, Gearing M, Levey AI, Lah JJ, Hardy J, Rohrer JD, Lashley T, Mackenzie IR, Feldman HH, Hamilton RL, Dekosky ST, van der Zee J, Kumar-Singh S, Van Broeckhoven C, Mayeux R, Vonsattel JP, Troncoso JC, Kril JJ, Kwok JB, Halliday GM, Bird TD, Ince PG, Shaw PJ, Cairns NJ, Morris JC, McLean CA, DeCarli C, Ellis WG, Freeman SH, Frosch MP, Growdon JH, Perl DP, Sano M, Bennett DA, Schneider JA, Beach TG, Reiman EM, Woodruff BK, Cummings J, Vinters HV, Miller CA, Chui HC, Alafuzoff I, Hartikainen P, Seilhean D, Galasko D, Masliah E, Cotman CW, Tuñón MT, Martínez MC, Munoz DG, Carroll SL, Marson D, Riederer PF, Bogdanovic N, Schellenberg GD, Hakonarson H, Trojanowski JQ, Lee VM. Common variants at 7p21 are associated with frontotemporal lobar degeneration with TDP-43 inclusions. Nat Genet. 2010 Mar;42(3):234-9. doi: 10.1038/ng.536. Epub 2010 Feb 14. PMID: 20154673; PMCID: PMC2828525.
- Cruchaga C, Graff C, Chiang HH, Wang J, Hinrichs AL, Spiegel N, Bertelsen S, Mayo K, Norton JB, Morris JC, Goate A. Association of TMEM106B gene polymorphism with age at onset in granulin mutation carriers and plasma granulin protein levels. Arch Neurol. 2011 May;68(5):581-6. doi: 10.1001/archneurol.2010.350. Epub 2011 Jan 10. PMID: 21220649; PMCID: PMC3090529.
- Nicholson AM, Finch NA, Wojtas A, Baker MC, Perkerson RB 3rd, Castanedes-Casey M, Rousseau L, Benussi L, Binetti G, Ghidoni R, Hsiung GY, Mackenzie IR, Finger E, Boeve BF, Ertekin-Taner N, Graff-Radford NR, Dickson DW, Rademakers R. TMEM106B p.T185S regulates TMEM106B protein levels: implications for frontotemporal dementia. J Neurochem. 2013 Sep;126(6):781-91. doi: 10.1111/jnc.12329. Epub 2013 Jul 1. PMID: 23742080; PMCID: PMC3766501.
- Pallitto MM, Murphy RM. A mathematical model of the kinetics of beta-amyloid fibril growth from the denatured state. Biophys J. 2001 Sep;81(3):1805-22. doi: 10.1016/S0006-3495(01)75831-6. Erratum in: Biophys J 2002 May;82(5):2826. PMID: 11509390; PMCID: PMC1301655.




とてもexcitingな話題について、わかりやすい解説ありがとうございました。
しばらくTREM106B祭りになりそうですね。サルコシル不溶性画分のWBなら多くの研究者がこれまで剖検脳を用いて見てきたと思うのですが、気がつかなかったのでしょうか?マウスモデルではTREM106Bは見れるのか?タウ病理も含めて疾患特異性はどのくらいあるのか?変異やKOで神経変性起こすのか?などなど知りたいことがいくつも出てきますね。
そうですね!
サルコシル不溶画分のWBのメンブレンが残っていたら、TMEM106B抗体であててみたいですね。
今のところはloss-of-function説が優位で、TMEM106Bノックアウトマウスは運動障害をきたすみたいですが、凝集体自体が何らかの悪さをしている可能性も十分にありそうですよね。
疾患特異性は私も大変気になります。それによって位置付けもだいぶ違ってきそうですし、これからも目が離せません。