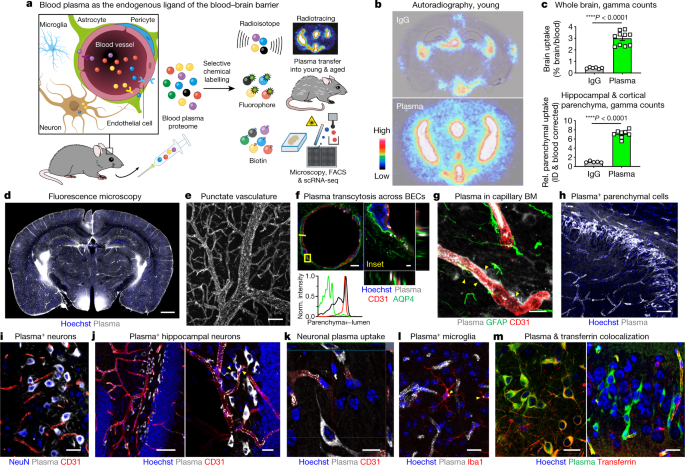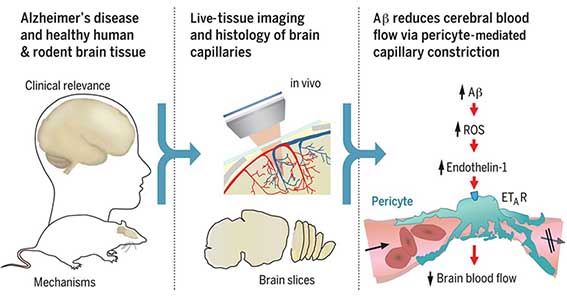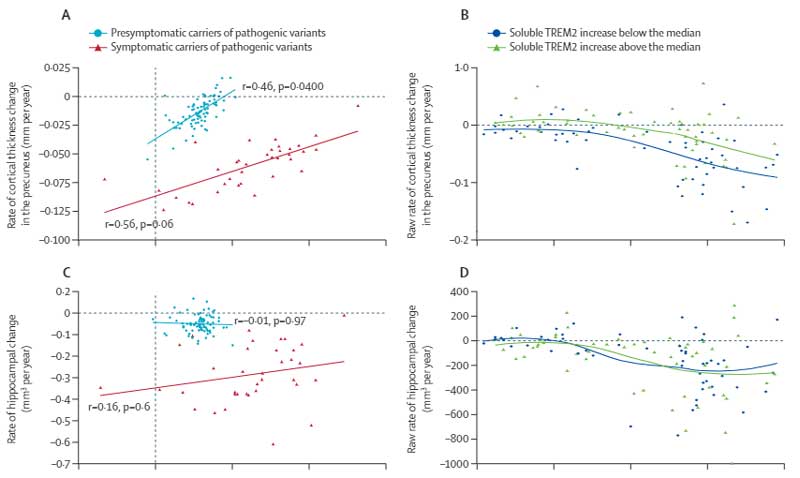
”血液脳関門(blood-brain barrier, BBB)”。
高い選択性を持ち、
このバリア機能の為、
血中の多くのタンパクは脳内に移行しない、
と考えられています。
年をとると、このBBBが破綻し、
認知機能障害と相関する、という研究結果が今まで報告されていました1, 2。
今回、アメリカ・スタンフォード大学のWyss-Corayらの研究グループは、
若齢/老齢マウスを使って、
若齢マウスでも血中の多くのタンパクが、脳内に移行する事を報告しました。
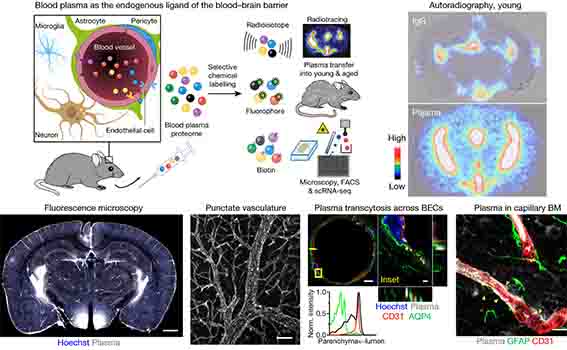
Tagging and tracking the blood plasma proteome as a discovery tool reveals widespread endogenous transport of proteins into the healthy brain and the pharmacologically modifiable mechanisms by which the brain endothelium regulates this process with age.
脳の酸素消費量は本当に神経活動量と相関していた
彼らは、まず若齢マウスの血中から、
アルブミンや抗体などの主要タンパクを取り除き、
それ以外のタンパクを放射標識した。
そして、その血液を若齢マウス(3mo)血管内に戻した所、
24時間後に放射標識タンパクが脳内に移行する様子が観察された。
一方、コントロールの放射標識IgGは、脳血管内にとどまったままだった。
他の標識法(蛍光標識やビオチン標識)でも同様の結果が得られた。
蛍光標識した血漿蛋白は、内皮細胞、ペリサイト、ニューロン、ミクログリアなどに取り込まれていた。
また、脈絡叢の上衣細胞にも取り込まれており、これらのタンパクは血液脳脊髄液関門も通過することがわかった。
単一細胞のトランスクリプトーム解析を行うと、
タンパク通過をサポートする遺伝子の発現が内皮細胞で上がっており、
これら血漿蛋白の通過には内皮細胞が大きな役割を担っていると考えられた。
この機能は、年をとるとどうなるのか?
彼らは老齢マウス(22mo)で同様の実験を行った所、
これらのタンパク通過は半分まで減少した。
代わりに、
非特異的タンパク通過に関係する遺伝子(eg. CAV1)の発現が上がっていた。
また、受容体の輸送に関与するクラスリン小胞の数が半減し、
非特異的カベオラ小胞が6倍に上がっていた。
これらの結果から、
加齢によって、タンパク通過の選択性が著しく損なわれていると考えられた。
内皮細胞の遺伝子発現変化は、どうやらペリサイトの減少が関係しているらしい。
ペリサイトは加齢により脱落するが、
内皮細胞内での、ペリサイト依存性の遺伝子発現も加齢により減少していた。
ペリサイト脱落モデルマウスでは、BBB障害とともに血管の石灰化がみられるが、
これと同じ現象が老齢マウスでもみられ、
加齢
↓
ペリサイト減少
↓
アルカリホスファターゼの上昇
↓
血管の石灰化
というメカニズムが考えられた。
そこで、老齢マウスにアルカリフォスファターゼ阻害薬を静注して同様の実験を行った所、
血管内のトランスフェリン取り込みや血管の石灰化が減少し、
さらには標識タンパクの脳内移行が若年マウスと同程度まで改善した。
このような薬剤は、加齢による血管の選択能力を取り戻し、認知機能低下防止に一役買う事ができるかもしれない。
My View
BBBが高い選択性を持つことは周知の事実だと思いますが、
BBBを通過するタンパクは、今まで私達が思っていた以上に多いのかもしれません。
そして、加齢によりその選択性が落ちてきて、
色々困ったことになる、という事のようです。
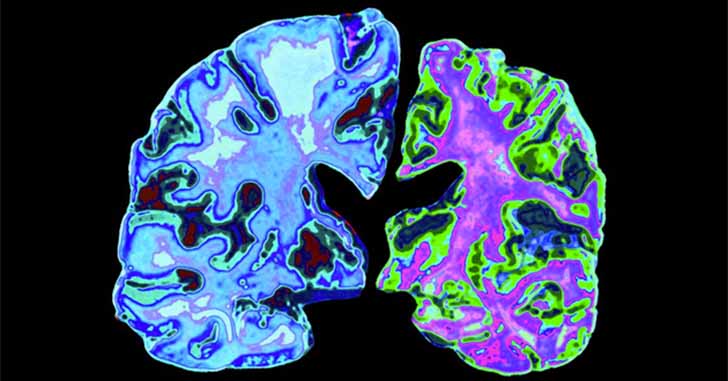
ちょっと気になったのは、その放射標識や蛍光標識したタンパクが脳実質に到達していると示すFigureについて。
弱拡でマウスの冠状断を表示していますが、
最も強く光っている部分は、何れも脳室周囲か視床下部あたり。
このあたりって、BBBないじゃん……
勿論、強拡で、標識した血漿蛋白が内皮細胞の外側に移動し、
ニューロンやグリアに取り込まれている様子が示されているので、
BBBを通過して、というのも本当だとは思うのですが、
BBBを通過して脳内に到達したタンパクというのは、
BBBを通過しないで脳内に到達したタンパクの何%くらいなのでしょう?
定量は難しいように思いますが、
Figureを見る限りはだいぶ少なさそうに感じました。
まあ、いずれにしても、IgGより脳内移行性が高いタンパクがたくさんあることは事実なのでしょう。
そして、そこでは終わらず、
加齢によって内皮細胞の選択性が落ちるメカニズム
↓
その治療法の可能性
まで追求するところは流石だなーと思います。
血管……
学生の頃は、ただの血液を運ぶ管のイメージでしたが、
学ぶほど奥の深い臓器に感じてきます。
References
- Montagne A, Barnes SR, Sweeney MD, et al. Blood-brain barrier breakdown in the aging human hippocampus. Neuron. 2015;85(2):296-302. doi: 10.1016/j.neuron.2014.12.032
- Nation, D.A., Sweeney, M.D., Montagne, A. et al. Blood–brain barrier breakdown is an early biomarker of human cognitive dysfunction. Nat Med 25, 270–276 (2019). https://doi.org/10.1038/s41591-018-0297-y
- Yang, A.C., Stevens, M.Y., Chen, M.B. et al. Physiological blood–brain transport is impaired with age by a shift in transcytosis. Nature 583, 425–430 (2020). https://doi.org/10.1038/s41586-020-2453-z