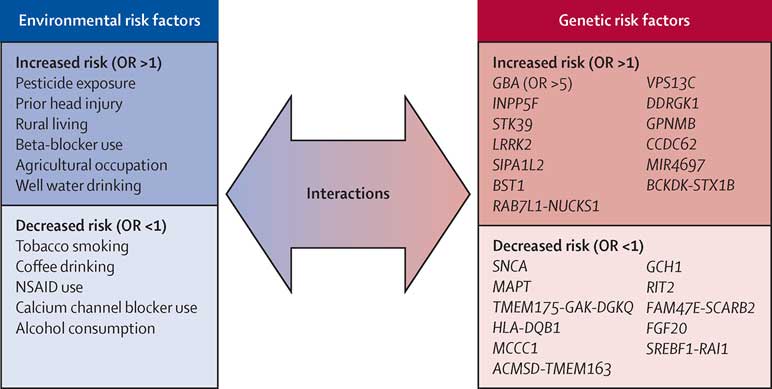
パーキンソン病(Parkinson's disease, PD)の原因には、遺伝要因の他に環境要因も示唆されています [1, 2]。
有名なのは、農薬の一種であるロテノン(rotenone)や、合成麻薬の成分の一つである MPTP(1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine)が典型的なパーキンソニズムをきたす、というもので、
これらはミトコンドリアの complex I (MCI) を阻害し、エネルギー産生脳の低下によってドパミン神経細胞が変性すると考えられています [3, 4, 5]。
また遺伝性家族性PD(全体のPDの5-10%)の中でも、PARK2の原因遺伝子ParkinとPARK6の原因遺伝子PINK1はお互いが関連してミトコンドリア機能維持の役割を担っており、この機能障害で黒質のドパミン神経細胞変性およびパーキンソニズムをきたします [6]。
これらの原因でPDになる人達の脳内には、PD典型病理であるレヴィ小体がみられないことが多く(一部例外の症例報告あり)、PDの病態機序を探る上でよくトピックになっています(α-Syn病理(+)のPDとα-Syn病理(-)のPDは機序が違うのではないか etc.)。
今回、アメリカ・ノースウェスタン大学の Dr. Surmeier らの研究グループは、
「ドパミン神経細胞特異的にミトコンドリアMCI機能を阻害したら、PDの症状が順を追って現れる」
という内容の研究成果を報告しました [7]。
ミトコンドリア機能を阻害したらパーキンソン病になる
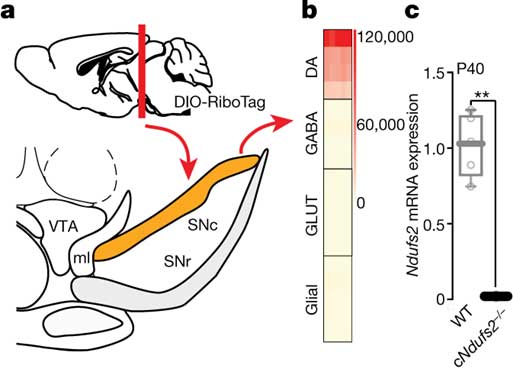
ドパミン神経細胞特異的にMCI機能を欠失するマウスの作製
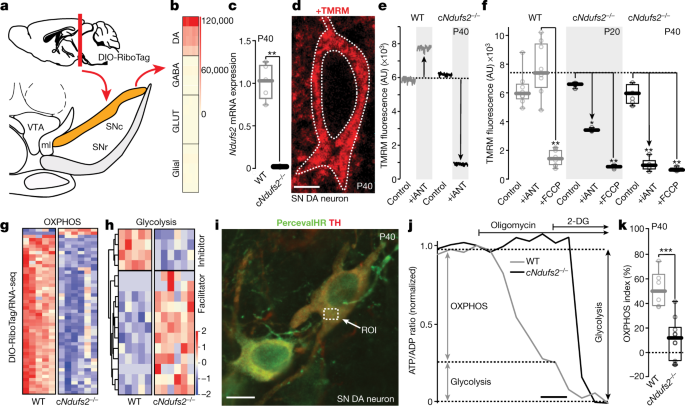
彼らはまず、MCIのコアサブユニットである Ndufs2 ドパミン神経細胞特異的にノックアウトするため、
- flox-Ndufs2 マウス (Ndufs2
fl/fl ) - DATプロモーター下に Cre を発現したマウス (Dat-cre+/-)
を交配させて、Ndufs2 コンディショナルノックアウトマウス (cNdufs2-/-) を作製しました。
RiboTag method(Glossary参照)という方法で調べると、Ndurs2 は黒質(substantia nigra, SN)のドパミン(Dopamine, DA)神経特異的にノックアウトされていました。
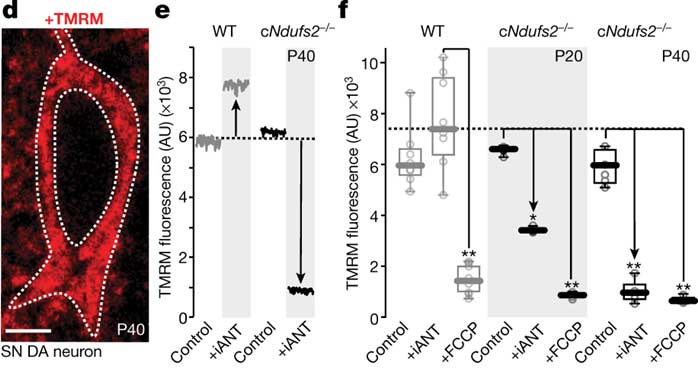
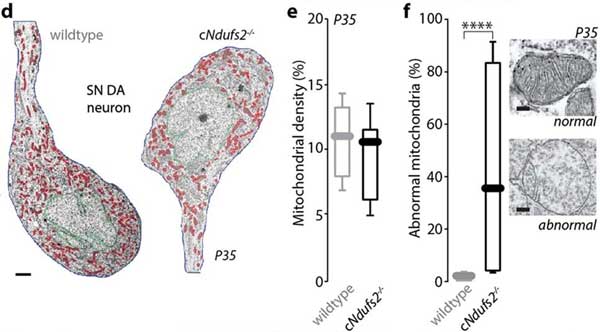
DA細胞のミトコンドリア機能や呼吸鎖の機能などが落ちていました。
また、ミトコンドリアの形態異常も認めました。
Ndufs2機能を欠失すると、最初にドパミン神経の軸索障害が起こる
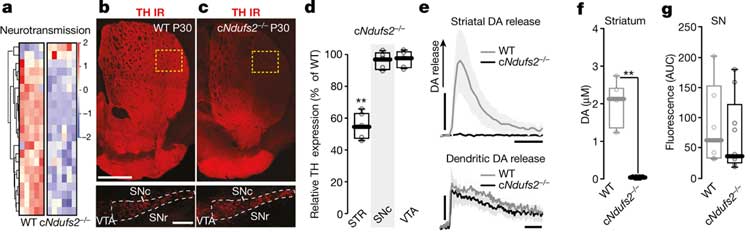
生後30日のcNdufs2-/-マウスを調べると、線条体のチロシン水酸化酵素(TYROSINE HYDROXYLASE, TH)が落ちていましたが、黒質緻密部(substantia nigra pars compacta, SNc)や腹側被蓋野(ventral tegmental area, ventral tegmentum, VTA)のTHには変化がありませんでした。
またスライスカルチャーで線条体とSNのDA分泌量を調べると、線条体のDA分泌量は著減していましたが、SNのDA分泌量はまだ変化が起こっていませんでした。
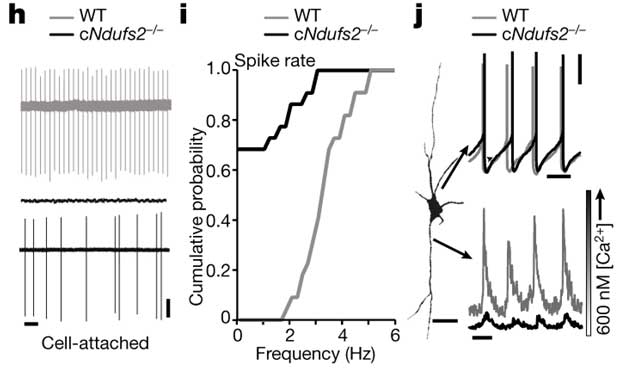
ただ、SNのDA神経のカルシウム流入は落ちていました。
この結果から、
「SNのドパミン神経細胞特異的にMCI機能異常を起こすと、ドパミン神経が弱って軸索異常が最初に起こり、投射先の線条体のTH発現量が減る」
という可能性が示唆されました。
次にDA細胞の樹状突起の障害が起こる
次に彼は、生後60日のcNdufs2-/-マウスを調べました。
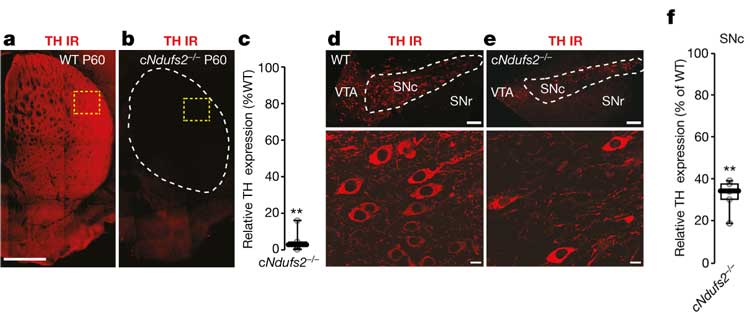
生後60日では、線条体のTH量は更に著減し、SNcのTH細胞も減少するようになっていました。
さらに、線条体のDA分泌だけでなく、SNのDA分泌量も落ちていました。
FluoroGoldを線状体に注入して投射元のSNのDA細胞を可視化すると、線条体に投射しているDA細胞のTH量が減少していました。
cNdufs2-/-マウスはPD患者さんと同じ様な経過で障害が進行していく
著者らは、
- 生後30日
- 生後40日
- 生後60日
- 生後120日
で、cNdufs2-/-マウス(とWT)の行動解析を行いました。
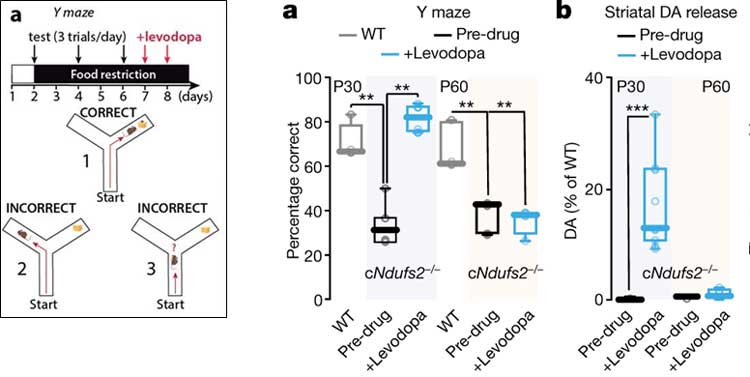
するとcNdufs2-/-マウスでは、生後30日からY mazeで認知機能障害が落ちていましたが、レボドパ投与群(6mg/kg)ではWTと同じレベルまで症状が改善しました。
生後60日では同様の症状がみられましたが、レボドパで改善しませんでした。
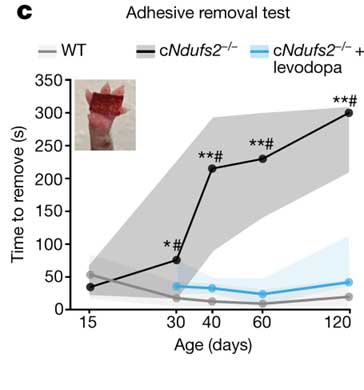
Adhesive removal testでは巧緻運動機能障害が生後30日からみられ、こちらは生後120日たってもレボドパで改善がみられました。
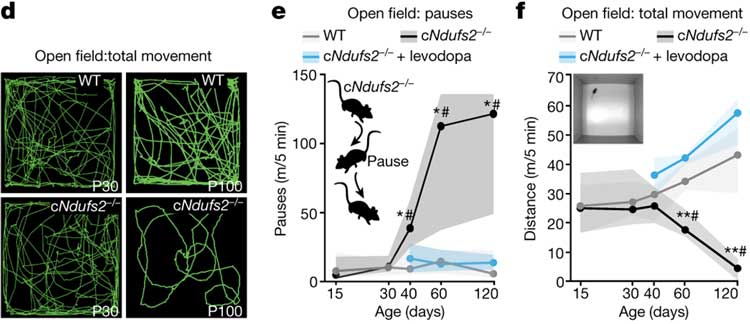
Open fieldテストで全体の運動機能を確認すると、生後40日から異常がみられ、こちらも、生後120日までレボドパで改善しました。
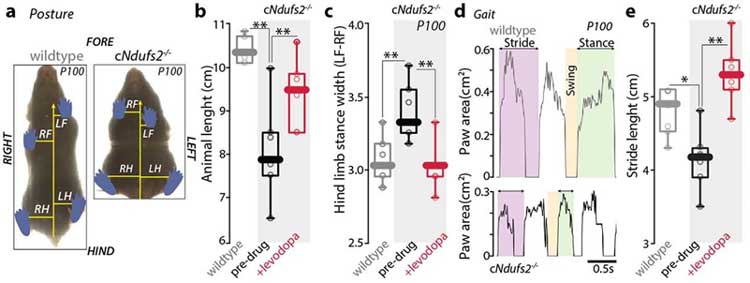
さらに生後90日ではPD患者さんにみられるような歩幅の減少や前かがみ姿勢などをきたし、
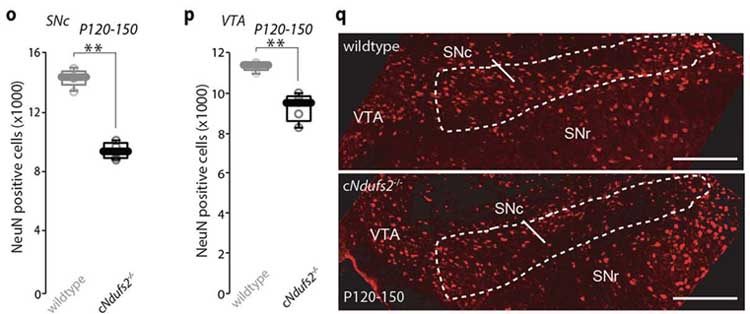
生後120日から150日くらいではSNcの神経細胞が減少していました。
以上の結果は、
SNのDA細胞のMCI機能障害
↓
投射先の軸索障害(線条体のTH↓DA↓) &
線条体関連運動認知機能障害や巧緻運動機能障害
↓
全体的な運動機能障害
↓
SNのDA細胞体および樹状突起の病理(SNでのTH↓DA↓)&
歩行や姿勢の異常
という病態と症状の流れを示唆していると考えられました [8]。
全体の運動機能障害は、線条体だけでなく黒質の変性も影響している
上記の結果、cNdufs2-/-マウスは、最初投射先の線条体でのDA分泌障害が起こっただけでも運動認知機能や巧緻運動機能障害をきたしますが、全体の運動機能障害や歩行・姿勢異常は、SNcの樹状突起からのDA分泌異常が起こってから生じるようだったので、
著者らはPD進行期にみられる症状は、線条体だけでなくSNc局所でのDA分泌異常も関与するのかどうか調べました。
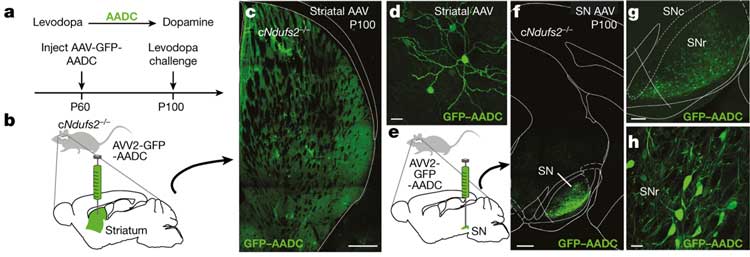
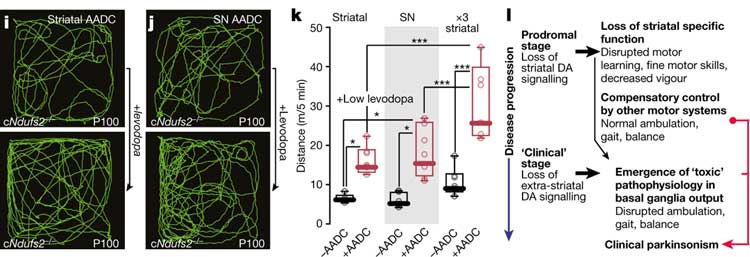
その方法として彼らは、レボドパをドパミンに変換する aromatic-l-amino acid decarboxylase (AADC) とGFPタグAAVベクターに組み込み、生後60日で線条体かSNのどちらかに注入しました。
そして生後100日後にレボドパチャレンジを行って、レボドパの反応性を調べました。
結果、線条体のみ注入群、SN注入群ともにレボドパ投与でOpen fieldの移動距離が改善しており、
「PDの運動機能障害は線条体のDA細胞軸索からのDA分泌異常だけでなく、SNのDA細胞樹状突起からのDA分泌異常も関係している」
という可能性が示唆されました。
Dysfunction of mitochondrial complex I in mice is sufficient to cause progressive parkinsonism in which the loss of nigral dopamine release critically contributes to motor dysfunction.
My View
ここのラボの研究ではいつもα-Synが全然出てこないのですが、今回も出てきませんでしたw
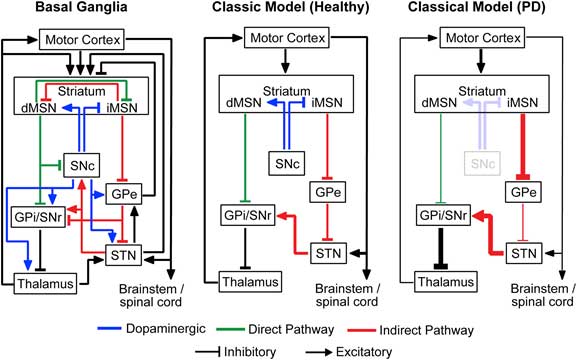
PDの病態を語る上で欠かせない大脳基底核の神経回路って複雑で、正直いつも図をみないと話についていけなくなるんですが、
今回は、(私の理解が正しければ)SNのDA細胞は投射先の線条体だけでなく自分の周りにも樹状突起からDAを分泌していて、
それが障害されるとより進行期のPDの症状が現れる、というお話でした。
実験的には、
「MPTPもかなりDA細胞特異的にMCI異常をきたすけど、cNdufs2 マウスを作らないといけなかった理由って何かな?」
とゆーあたりがもやっとしたので、本人達にきいてみたいです。
MPTPだと一気にミトコンドリアがやられてしまうから、今回みたいに時間経過を追うのが難しいのかな?
MCIタンパクは半減期20-40日らしく、CreはDATプロモーター下に入れているので、
このcNdufs2-/-マウスは、
「胎生期では最初にMCIが発現して、その後DATが発現しだしてから新しいMCIが作られなくなって……数十日かけて徐々にMCIが低下していって最後にはゼロになる」
というモデルみたいです。
あと、著者らは Y-maze を改良していて、1日絶食にしたあとY-mazeの方碗に餌を置き、そちらに向かえばOK、反対側ならNG、という方法をとっており、この結果を "motor learning" として評価しているのですが、この意味がちょっとわかりませんでした。
餌を置いているから報酬系?かとも思ったのですが、今まで Y-maze(餌を置かないでSpontaneous Alternation etc.を見るヤツ)は作業記憶などをみる系だと思っていたので、
「motor learning ??」
って感じになりました。
ちょっと検索すると、"motror learning" というのは以前からPDの初期症状として報告されていて、線条体の機能(D1受容体とか)が関与しているみたいです [9, 10]。
PD患者さんでゆーと、初期からみられる薬物乱用とかの非運動障害が関係しているのかなーと思います。
これは全然知らなかったので、時間があったらもう少しちゃんと調べないとなー(でも後回しにしちゃいそうなので、誰か詳しい人がいたら教えて下さい。)
Glossary
RiboTaq method
組織から、各細胞毎にリボソーム関連mRNAを抽出し、解析する方法 [11]。
今回著者らは、AAV-Myc-DDK でタグ付けしたマウスのリボソーマルタンパクをマウスの SNc に注入し、4週間後に SNc 部分を取り出して RiboTaq で IP し、mRNA を抽出。
抽出した mRNA を RNA-Seq し、遺伝子の発現を調べた。
References
- Kalia LV, Lang AE. Parkinson's disease. Lancet. 2015 Aug 29;386(9996):896-912. doi: 10.1016/S0140-6736(14)61393-3. Epub 2015 Apr 19. PMID:25904081.
- Gorell JM, Johnson CC, Rybicki BA, Peterson EL, Richardson RJ. The risk of Parkinson's disease with exposure to pesticides, farming, well water, and rural living. Neurology. 1998 May;50(5):1346-50. doi: 10.1212/wnl.50.5.1346. PMID:9595985.
- Schapira AH. Mitochondrial complex I deficiency in Parkinson's disease. Adv Neurol. 1993;60:288-91. PMID:8420145.
- Devi L, Raghavendran V, Prabhu BM, Avadhani NG, Anandatheerthavarada HK. Mitochondrial import and accumulation of alpha-synuclein impair complex I in human dopaminergic neuronal cultures and Parkinson disease brain. J Biol Chem. 2008 Apr 4;283(14):9089-100. doi: 10.1074/jbc.M710012200. Epub 2008 Feb 1. PMID:18245082; PMCID: PMC2431021.
- Musgrove RE, Helwig M, Bae EJ, Aboutalebi H, Lee SJ, Ulusoy A, Di Monte DA. Oxidative stress in vagal neurons promotes parkinsonian pathology and intercellular α-synuclein transfer. J Clin Invest. 2019 Jun 13;129(9):3738-3753. doi:10.1172/JCI127330. PMID:31194700; PMCID: PMC6715407.
- Eiyama A, Okamoto K. PINK1/Parkin-mediated mitophagy in mammalian cells. Curr Opin Cell Biol. 2015 Apr;33:95-101. doi:10.1016/j.ceb.2015.01.002. Epub 2015 Feb 17. PMID:25697963.
- González-Rodríguez P, Zampese E, Stout KA, Guzman JN, Ilijic E, Yang B, Tkatch T, Stavarache MA, Wokosin DL, Gao L, Kaplitt MG, López-Barneo J, Schumacker PT, Surmeier DJ. Disruption of mitochondrial complex I induces progressive parkinsonism. Nature. 2021 Nov 3. doi: 10.1038/s41586-021-04059-0. Epub ahead of print. PMID:34732887.
- McGregor MM, Nelson AB. Circuit Mechanisms of Parkinson's Disease. Neuron. 2019 Mar 20;101(6):1042-1056. doi:10.1016/j.neuron.2019.03.004. PMID:30897356.
- Jordan N, Sagar HJ. The role of the striatum in motor learning: dissociations between isometric motor control processes in Parkinson's disease. Int J Neurosci. 1994 Aug;77(3-4):153-65. doi: 10.3109/00207459408986027. PMID:7814209.
- Giordano N, Iemolo A, Mancini M, Cacace F, De Risi M, Latagliata EC, Ghiglieri V, Bellenchi GC, Puglisi-Allegra S, Calabresi P, Picconi B, De Leonibus E. Motor learning and metaplasticity in striatal neurons: relevance for Parkinson's disease. Brain. 2018 Feb 1;141(2):505-520. doi: 10.1093/brain/awx351. PMID:29281030.
- Sanz E, Yang L, Su T, Morris DR, McKnight GS, Amieux PS. Cell-type-specific isolation of ribosome-associated mRNA from complex tissues. Proc Natl Acad Sci U S A. 2009 Aug 18;106(33):13939-44. doi: 10.1073/pnas.0907143106. Epub 2009 Aug 4. PMID:19666516; PMCID: PMC2728999.