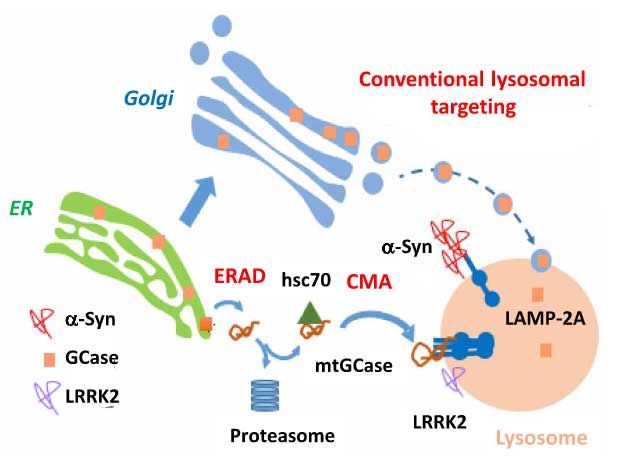
GGA3は、Golgi-localized, gamma adaptin ear-containing, ARF-binding (GGA) ファミリーの一つで、トランス・ゴルジネットワーク–リソソーム間や、エンドソーム–リソソーム間のタンパク輸送等に重要な役割を果たすタンパクとして知られています。
アメリカ・タフツ大学のDr. Tescoらの研究グループは、以前、
- マウスの神経細胞でGga3を欠損させると、BACE1が初期エンドソームに留まり、ライソソームへのトラフィッキングが妨げられる [1, 2]
- Gga3欠損マウスではBACE1のタンパク量が増える [3, 4]
- AD患者さんの側頭葉皮質や家族性ADのマウスモデル脳内で、BACE1↑、GGA3↓ [1, 4]
などを報告していました。
今回は、更に解析を重ね、Gga3欠損ではBACE1の軸索輸送が滞り、軸索腫大内にBACE1が蓄積する事を報告しました [5]。
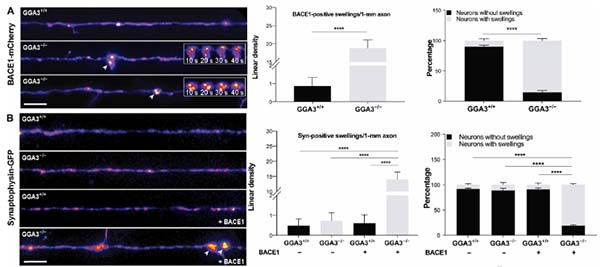
GGA3欠損でBACE1が軸索内に蓄積する
著者らは、野生型マウスの海馬初代培養神経細胞を GFPタグをつけたGGA3を強制発現させ(GFP-GGA3)、GGA3が軸索と樹状突起に存在することを確認した。
また、BACE1をmCherryで蛍光標識(BACE1-mCherry)して共導入し、microfluidic deviceで観察すると、GGA3とBACE1は一緒に軸索輸送されていた。
GGA3欠損(GGA3-/-)マウスの神経細胞では、このBACE1の軸索輸送が滞り(regrograde, anterogradeともに)、腫大した軸索内にBACE1の蓄積が確認された。
また、GGA3-/-マウス(2mo)の小脳でも同様の軸索腫大が確認された。
GGA3-/- マウス神経でみられた、BACE1の軸索輸送の停滞は、
- GGA3の形質導入
- BACE1阻害剤(C3)
- γ-セクレターゼ阻害剤(DAPT)
で改善した。
実際にGGA3がアルツハイマー病(Alzheimer's disease, AD)と関連があるのかどうか調べるため、
彼らは、whole-genome sequencing (WCS) や whole-exome sequencing (WES)のデータを調べ、
遅発型ADと関連が強い、稀なGGA3変異(GGA rs150787028, Ins545T, MAF < 0.01)を同定した。
GGA3-/- マウス神経でみられた、BACE1の軸索輸送の停滞は、
野生型GGA3の形質導入ではレスキューできたが、Ins545T変異GGA3を形質導入してもレスキューできず、
GGA3 Ins545Tは、
GGA3のLoss of function
↓
BACE1の軸索停滞
↓
Aβ産生↑
↓
AD発症
の流れでADに関与している可能性が示唆された。
最後に、GGA3-/-マウスと5xFADマウスを交配し、Aβプラークが蓄積する前の2ヶ月齢の段階で、軸索腫脹、BACE1の腫脹軸索内蓄積を認めた。
My View
ADの初期では、軸索障害とタンパク輸送の障害が起こっているようですが [6]、
この研究では、GGA3の機能不全で同じような現象が起こる事を示しており、
GGA3がADの軸索障害に関与している可能性が示されました。
GGA3を欠損してBACE1の軸索輸送障害をみるだけだったら、「まあそうかもね。」と思うだけで、「BACE1のエンドソーム内蓄積 → Aβ産生↑ 」の報告ほどのインパクトはないように思いますが、
ゲノム解析データからGGA3変異と遅発性ADの関連を探し、
その変異で同様の症状が起こることを示して、GGA3のAD病理への重要性を改めて主張していました。
また、この現象はBACE1阻害剤やγ-セクレターゼ阻害剤でレスキューできるようなので、
相次ぐ中止で落ち込む、BACE1阻害剤の治験に関与する人達には嬉しい結果なんじゃないかと思います。
ただ、この研究では、
GGA3-/-;5xFADマウスの若年齢でBACE1の腫脹軸索内蓄積が起こることを示していますが、
行動解析などは行っていないので、この現象が認知機能に影響するのかどうかはわかりません。
また、軸索腫脹等が in vivo でもBACE1阻害剤等でレスキューできるのかどうかも気になります。
もう少し追求の余地がありそうなので、続報を待っておこうと思います。
References
- Tesco G, Koh YH, Kang EL, Cameron AN, Das S, Sena-Esteves M, Hiltunen M, Yang SH, Zhong Z, Shen Y, Simpkins JW, Tanzi RE. Depletion of GGA3 stabilizes BACE and enhances beta-secretase activity. Neuron. 2007 Jun 7;54(5):721-37. doi: 10.1016/j.neuron.2007.05.012. PMID:17553422; PMCID: PMC1973166.
- Kang EL, Cameron AN, Piazza F, Walker KR, Tesco G. Ubiquitin regulates GGA3-mediated degradation of BACE1. J Biol Chem. 2010 Jul 30;285(31):24108-19. doi: 10.1074/jbc.M109.092742. Epub 2010 May 18. PMID:20484053; PMCID: PMC2911305.
- Walker KR, Kang EL, Whalen MJ, Shen Y, Tesco G. Depletion of GGA1 and GGA3 mediates postinjury elevation of BACE1. J Neurosci. 2012 Jul 25;32(30):10423-37. doi: 10.1523/JNEUROSCI.5491-11.2012. PMID:22836275; PMCID: PMC3490187.
- Kim W, Ma L, Lomoio S, Willen R, Lombardo S, Dong J, Haydon PG, Tesco G. BACE1 elevation engendered by GGA3 deletion increases β-amyloid pathology in association with APP elevation and decreased CHL1 processing in 5XFAD mice. Mol Neurodegener. 2018 Feb 2;13(1):6. doi: 10.1186/s13024-018-0239-7. PMID:29391027; PMCID: PMC5796504.
- Lomoio S, Willen R, Kim W, Ho KZ, Robinson EK, Prokopenko D, Kennedy ME, Tanzi RE, Tesco G. Gga3 deletion and a GGA3 rare variant associated with late onset Alzheimer's disease trigger BACE1 accumulation in axonal swellings. Sci Transl Med. 2020 Nov 18;12(570):eaba1871. doi: 10.1126/scitranslmed.aba1871. PMID:33208500.
- Stokin GB, Lillo C, Falzone TL, Brusch RG, Rockenstein E, Mount SL, Raman R, Davies P, Masliah E, Williams DS, Goldstein LS. Axonopathy and transport deficits early in the pathogenesis of Alzheimer's disease. Science. 2005 Feb 25;307(5713):1282-8. doi: 10.1126/science.1105681. PMID:15731448.