アルツハイマー病(Alzheimer's disease, AD)の2大病理タンパクであるアミロイドβ(Amyloid beta, Aβ)と過リン酸化タウ。
アミロイド仮説の提唱とともに、多くの変異アミロイド前駆体蛋白質(Amyloid precursor protein, APP)やプレセニリン (Presenilin, PSEN) 遺伝子の過剰発現マウスが開発され、AD研究に重要な発見をもたらしてきました。
ただ、過剰発現マウスは、「過剰」に発現させていることや、ランダムインサーションによる影響など、人工的な要因が懸念材料として常に指摘されていました。
この問題を解決すべく、以前、理化学研究所の西道先生らの研究チームが、ヒトの変異APP(KM670/671NL, I716F, E693G) のノックインマウスを作製し [1]、現在も世界中で使用されています。
しかしながら、変異のない野生型のヒトAPP遺伝子をノックインしたマウスはなく、
「通常のヒトAPPをノックインすると、高齢の人々と同じようにアミロイド病理は起こるの?」
というシンプルな疑問が上がります。
このリサーチクエッションに答えるべく、
ベルギーのDr. Strooperらの研究グループが、ヒト野生型APPノックインラットとマウスを作製し、解析しました [2]。
ヒトのヒトの野生型APP遺伝子ノックインマウス
彼らは、まずin silicoで、ヒトのAPPとBACE1との相互作用をシミュレーションしました。
その結果、ヒトのAPPは、マウス/ラットと比べてよりBACE1から切断されやすいという事がわかりました。
ウェスタンブロットでも、マウス/ラットのAPPよりヒトAPPの方がBACE1による切断産物(β-CTF)が多いという結果でした。
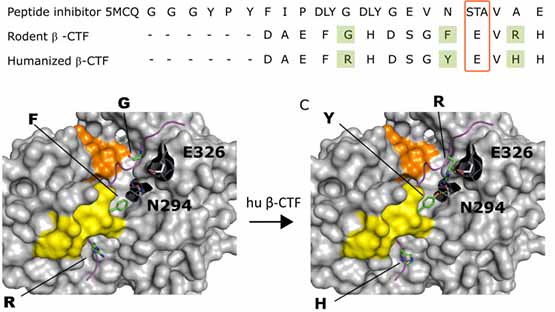
そこで彼らは、CRISPR-Cas9システムを使って、マウス/ラットのAPP遺伝子をヒトのシークエンス(G676R, F681Y, R684H)に置換し(APP hu/hu)、アミロイド病理が増悪するかどうかを調べました。
結果、APP hu/huは、野生型APPマウス/ラット(APP WT)と比較してβ-CTF量が増加し(2.5/4.7倍)、逆にα-CTF量は減少(0.6/0.7倍)しました。
それに呼応して、可溶性のAβ38、Aβ40、Aβ42、Aβ43量も増加しました。
彼らは更に、APP hu/huとM139T変異のPSENノックイン(APP hu/hu/PSEN1)ラットも作製しました。
APP hu/hu/PSEN1ラットでは、β-CTFの増加とともに、家族性のPSEN1M139T変異AD患者さんと同じ、Aβ42/Aβ40比の増加を認めました。
けれども、いずれのマウス/ラットでも、Aβプラークの蓄積は(2年追っても)ありませんでした。
Aβプラークが脳内に蓄積するためには、あと一声、何かのファクターが必要なようです。
でもこの研究では、APP変異がなくてもヒト脳の方がAβの産生が高くなっているということを示す重要な発見だと思います。
また、今後ADモデル動物の一つとして、変異APPノックインマウスのコントロールとしてetc. 色々有用だと思います。
References
- Saito T, Matsuba Y, Mihira N, Takano J, Nilsson P, Itohara S, Iwata N, Saido TC. Single App knock-in mouse models of Alzheimer's disease. Nat Neurosci. 2014 May;17(5):661-3. doi: 10.1038/nn.3697. Epub 2014 Apr 13. PMID:24728269.
- Serneels L, T'Syen D, Perez-Benito L, Theys T, Holt MG, De Strooper B. Modeling the β-secretase cleavage site and humanizing amyloid-beta precursor protein in rat and mouse to study Alzheimer's disease. Mol Neurodegener. 2020 Oct 19;15(1):60. doi: 10.1186/s13024-020-00399-z. PMID:33076948; PMCID: PMC7574558.