脳の神経活動と脳血流は密接に連動しています。
神経活動が高まれば、その分多くの酸素を消費する必要があり [1]、その酸素を供給するため、神経活動の高い部分により多くの血流が流れます。
この現象を Neurovascular Coupling(NVC)と呼びますが [2]、そのメカニズムについて、これまでも色々と調べられてきました。
今回、中国西湖(Westlake)大学のDr. Jie-Min Jia らの研究グループは、
「神経が細動脈の血管平滑筋細胞(smooth muscle cells, SMCs)にシナプス様の突起を伸ばし、神経伝達物質を介して血管収縮・拡張に関与している」
と報告しました [3]。

神経は細動脈の血管平滑筋にシナプス様の突起を伸ばして、Neurovascular Couplingを形成していた
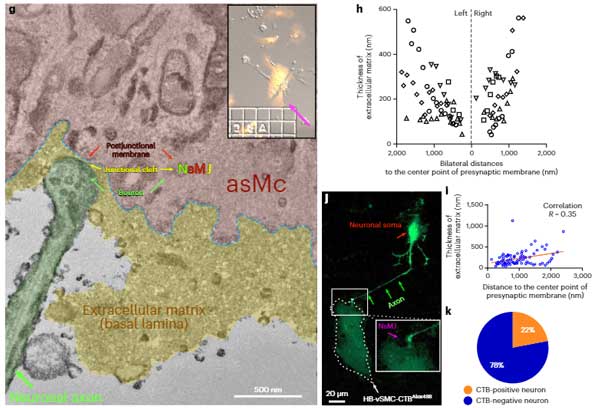
軸索終末が貫通細動脈のSMCsと接している
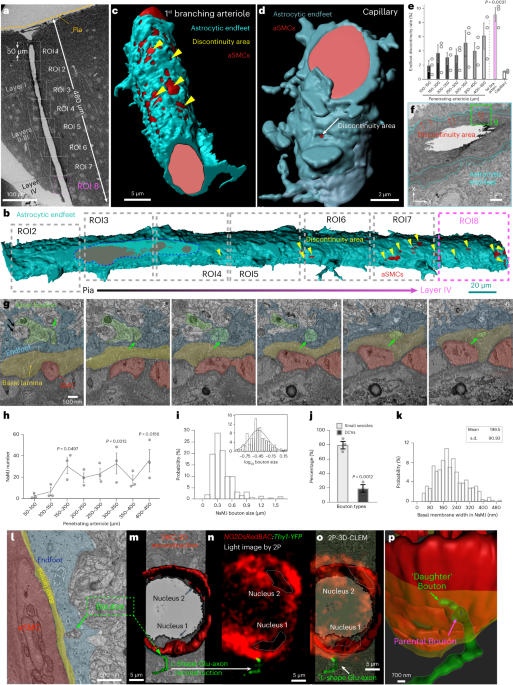
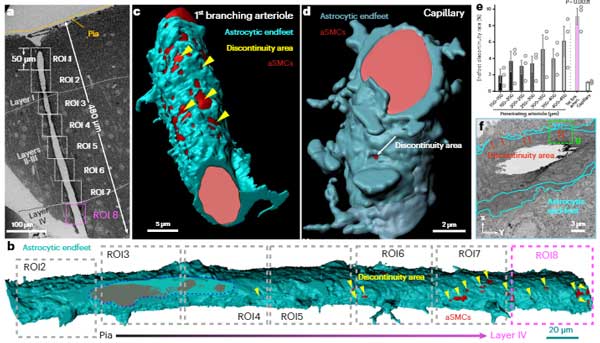
彼らは、マウスの脳貫通細動脈の枝を3D電子顕微鏡で調べていきました。
すると、貫通細動脈の最初の枝にはアストロサイトの足が覆っていない部分がたくさんあり、径を減じて毛細血管に近づく程、その部分は少なくなっていくことがわかりました。

この部分には、神経終末が娘終末を伸ばしており、SMCsに直接接しているようでした(neural-arteriolar smooth muscle cell unctions, NsMJs)。
NsMJsは、大脳皮質のII-III層と、V層に多く認めました。
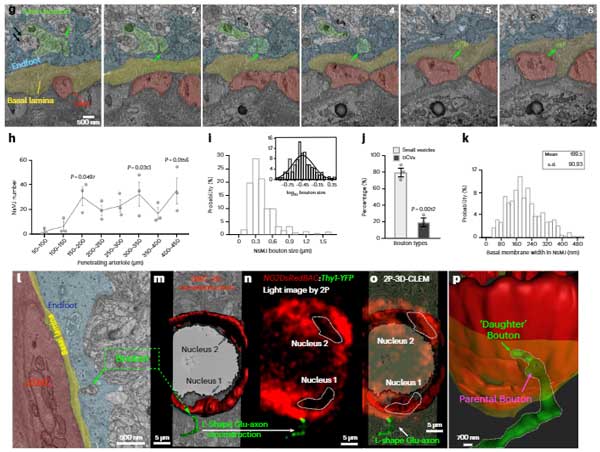
また、脳軟膜動脈‐細動脈と、皮質神経細胞の共培養を行ったところ、神経細胞がSMCsに特記を伸ばして接触する像も確認しました。
aSMCsには、神経伝達物質の受容体がたくさんある
接触する神経終末とaSMCsの間で、神経伝達物質の情報のやりとりはあるでしょうか?
それを調べるため、大脳皮質の細動脈のaSMCsを単離してRNAシーケンス(RNA-seq)を行ったところ、血管反応性受容体の他に、少量ではありますが、グルタミン酸受容体(glutamate receptors, GluRs)のサブユニットが発現している事がわかりました。
- 一番多く発現:Grin1, Grin2d
- 中程度発現:Gria1
- 低く発現:Grm3, Grm7
- 発現なし:Grin2a-Grin2c
彼らはこの中で、Grin1をターゲットとして調べる事としました。
- ※理由
- Grin1はNMDA受容体のマルチサブユニット複合体の主要構成タンパクだから
- NMDA受容体依存性のSMC収縮が確認されているから
- 内皮細胞とaSMCsのGrin1 mRNA量が同じくらいあるから
Grin1をミクロで確認すると、aSMCにはポストシナプスの足場タンパクであるPSD95が発現し、その94.4%がGrin1と共局在していました。
神経細胞-aSMCのユニットは機能的
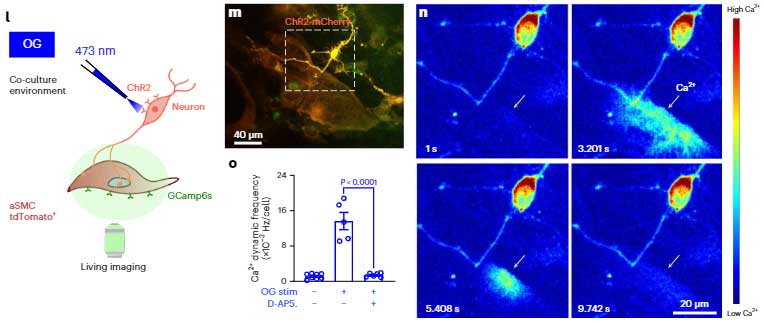
彼らは、この現象が偶然ではなく、神経細胞-aSMC間で情報のやり取りが行われているかどうかを調べました。
まず、培養aSMCをグルタミン酸で刺激すると、Ca2+が流入し、

また共培養の神経細胞をオプトジェネシスで刺激すると、神経突起が接する部分からaSMCにCa2+が流入する様子も観察されました。
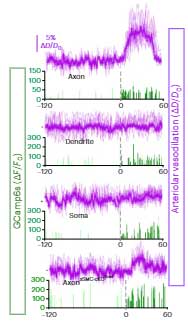
更に、マウスの脳内で、グルタミン酸作動性神経細胞の各部分(軸索、樹状突起、細胞体)をオプトジェネティクスで刺激すると、
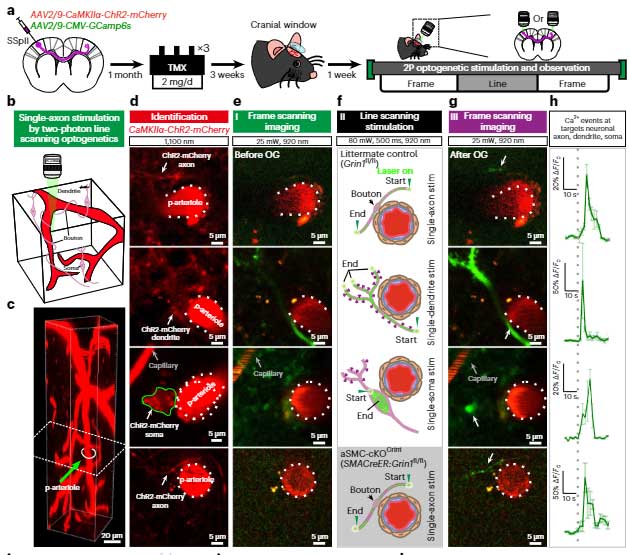
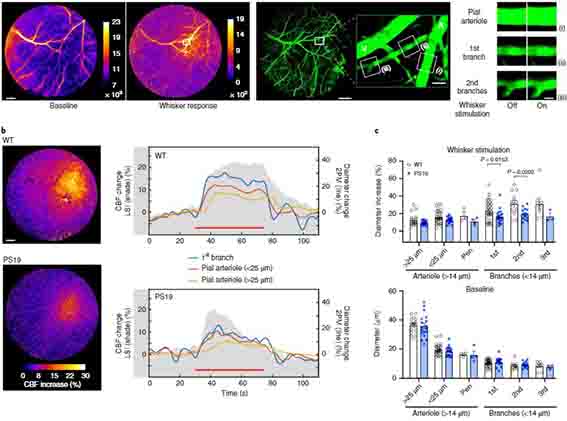
軸索を刺激したときに細動脈の血管径が速やかに拡張する事も確認しました。
またこの現象は、aSMC特異的にGrin1をノックアウトしたマウスでは起こらず、神経活動 → 細動脈は、Grin1を介している事がわかりました。
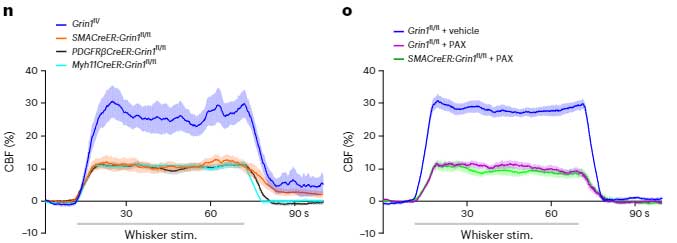
さらに、マウスのひげを刺激して、感覚神経野の血管拡張の様子を観察すると、コントロールマウスは脳血流(cerebral blood flow, CBF)が上がりましたが、
SMCにGrin1をノックアウトしたマウス(αSMC-cKOGrin1)やカルシウム活動性カリウムチャネルブロッカー投与マウス等では、この現象が確認されず、やはり神経活動に伴う血流上昇(NVC)にはNsMJsが重要であるとうことがわかりました。
脳血管障害時には、NsMJsは逆の働きをする
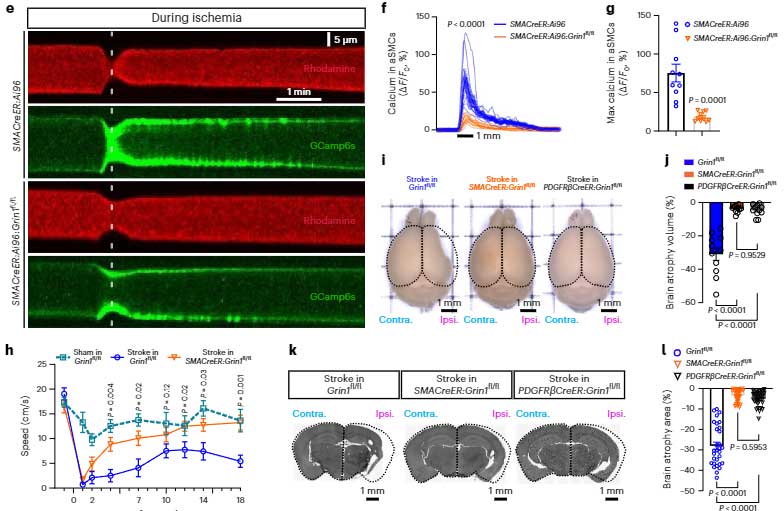
彼らは更に踏み込んで、一過性に中大脳動脈を閉塞して急性期脳梗塞を作り、その影響をコントロールマウスとαSMC-cKOGrin1マウスとで比較しました。
すると、脳梗塞後、コントロールマウスではCa2+の大量流入があり、細動脈は強く収縮して血流が届かないのに対して、αSMC-cKOGrin1マウスではその効果が減弱し、脳梗塞後にも局所に血流を届ける事ができました。
また、αSMC-cKOGrin1マウスは、梗塞後の脳萎縮の程度が軽く、運動機能も保たれました。
以上から、
「脳梗塞時には、SMCに多量のCa2+流入が起こり、通常生理下とは逆に血管は収縮する方向に働き、神経障害を助長する」
ということがわかりました。
- 神経終末と細動脈のSMCは、繋がっている(NsMJs)。
- 生理下では、「神経活動 → SMCのNMDAR(サブユニットのGrin1)→ SMCにCa2+流入 → 血管の拡張」という流れで、NVCに関与する。
- けれども脳梗塞などの状況下では、「SMCに多量のCa2+流入 → 血管の収縮」という逆の作用がおこり、NMDARブロックで脳梗塞による神経損傷を軽減することができる。
In the CNS, glutamatergic neurons directly control functional hyperemia via synaptic-like transmission onto arteriolar smooth muscle cells. Inhibiting this process reduces brain atrophy following cerebral ischemia.
My View
NVCに関与する血管細胞については、これまでも数々報告があり、このブログでも、
「神経活動 → 一酸化窒素 → 血管平滑筋の拡張」の経路 [4]、
脳内には、神経活動の量に合わせて、局所の血流があがる Neurovascular Coupling (NVC) というシステムがあります。 高齢者の方や、アルツハイマー病(Alzheimer's disease, AD) …
ペリサイト間でのナノチューブを介したCa2+流入量の連動 [5]、
細胞間同士のナノチューブの存在は、in vitroやex vivoの実験で以前から指摘されていましたが、 今回、カナダ・モンテリオール大学のAlarcon-Martinezらの研究グループは、 マウスの網膜と脳内でペリサ …
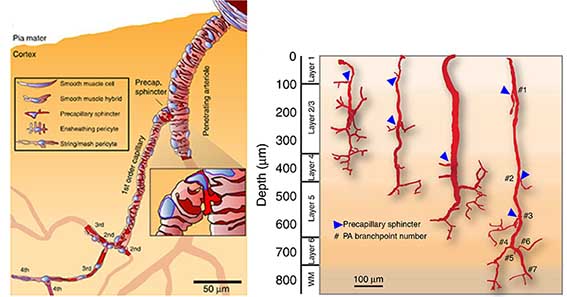
脳貫通細動脈の最初の枝の根本にあるprecapillary sphinctersの関与 [6]
脳血流(Cerebral blood flow: CBF)は神経活動によって巧みに変化し、Neurovascular couplingと呼ばれる。 デンマーク・コペンハーゲン大学のGrubb、Lauritzenらのグルー …
等について紹介してきました。
また、「血流調節のメインが血管平滑筋かペリサイトか」についても、以前ちょっとした論争がありました。
最近、ある総論を書いているのですが、レビューアーとやり取りをしながらちょっと切なくなっていているので、その理由を徒然なるままに書いてみます。 総論の内容 ペリサイトについて 総論は、ペリサイト(pericyte, 周皮細 …
今回の報告は、血管平滑筋細胞に焦点をあてていました。
脳貫通細動脈の最初の枝あたりに、アストロサイトの足が覆っていない部分があり、そこに神経が突起を伸ばして、直接平滑筋細胞に神経伝達物質を送っている、という事を、イメージング技術を駆使して綺麗に示しており、「流石だな」と思います。
これまでの報告から照らし合わせても、他の細胞も関与しているとは思いますが、やはりこの「脳貫通動脈の最初の枝の壁細胞」というのが一番影響力が強いんじゃないでしょうか。
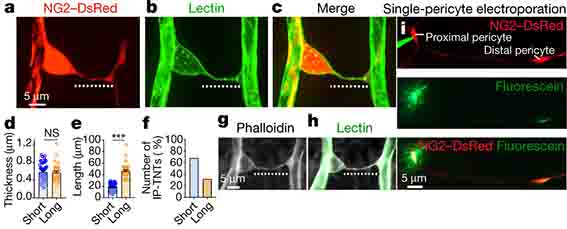
でも、本論文では、「ペリサイトマーカーのPdgfrbをノックアウトしたマウスでも、ひげ刺激による血管拡張が抑制された」というデータがあったので、
「細動脈の平滑筋細胞ほどではなくても、毛細血管のペリサイトにも多少同じようなユニットが存在している可能性があるかもしれないなー。」とも思いました。
そして面白いのは、「通常生理下では、神経活動による適度なCa2+流入でaSMCが弛緩するのに対し、脳梗塞などの病態下では、多量のCa2+流入で逆にaSMCが収縮する」という事。
同じCa2+なのに、aSMC内に流入する量によって逆の現象が起こるわけですね。
・
・
・
全体的にみて、今回のように、電顕による微細構造からのアプローチと機能解析からのアプローチを組み合わせると、かなり説得力があるなーと思いました。
今後の研究の参考にしたいです。
References
- Özugur S, Kunz L, Straka H. Relationship between oxygen consumption and neuronal activity in a defined neural circuit. BMC Biol. 2020 Jul 3;18(1):76. doi: 10.1186/s12915-020-00811-6. PMID: 32615976; PMCID: PMC7333326.
- Huneau C, Benali H, Chabriat H. Investigating Human Neurovascular Coupling Using Functional Neuroimaging: A Critical Review of Dynamic Models. Front Neurosci. 2015 Dec 18;9:467. doi: 10.3389/fnins.2015.00467. PMID: 26733782; PMCID: PMC4683196.
- Zhang D, Ruan J, Peng S, Li J, Hu X, Zhang Y, Zhang T, Ge Y, Zhu Z, Xiao X, Zhu Y, Li X, Li T, Zhou L, Gao Q, Zheng G, Zhao B, Li X, Zhu Y, Wu J, Li W, Zhao J, Ge WP, Xu T, Jia JM. Synaptic-like transmission between neural axons and arteriolar smooth muscle cells drives cerebral neurovascular coupling. Nat Neurosci. 2024 Jan 2. doi: 10.1038/s41593-023-01515-0. Epub ahead of print. PMID: 38168932.
- Park L, Hochrainer K, Hattori Y, Ahn SJ, Anfray A, Wang G, Uekawa K, Seo J, Palfini V, Blanco I, Acosta D, Eliezer D, Zhou P, Anrather J, Iadecola C. Tau induces PSD95-neuronal NOS uncoupling and neurovascular dysfunction independent of neurodegeneration. Nat Neurosci. 2020 Sep;23(9):1079-1089. doi: 10.1038/s41593-020-0686-7. Epub 2020 Aug 10. PMID: 32778793; PMCID: PMC7896353.
- Alarcon-Martinez L, Villafranca-Baughman D, Quintero H, Kacerovsky JB, Dotigny F, Murai KK, Prat A, Drapeau P, Di Polo A. Interpericyte tunnelling nanotubes regulate neurovascular coupling. Nature. 2020 Sep;585(7823):91-95. doi: 10.1038/s41586-020-2589-x. Epub 2020 Aug 12. PMID: 32788726.
- Grubb S, Cai C, Hald BO, Khennouf L, Murmu RP, Jensen AGK, Fordsmann J, Zambach S, Lauritzen M. Precapillary sphincters maintain perfusion in the cerebral cortex. Nat Commun. 2020 Jan 20;11(1):395. doi: 10.1038/s41467-020-14330-z. PMID: 31959752; PMCID: PMC6971292.