Presenilin1 E280A変異(PSEN1 E280A)は家族性アルツハイマー病(Familial Alzheimier's disease: FAD)の原因となる最も多い遺伝子変異である。
ハーバード大学のArboleda-Velasques、Antioquia大学のLoperaらは、コロンビアのPSEN1 E280A変異の家系で、この変異を持ちながら70代まで軽度認知機能障害(mild cognitive impairment: MCI)を発症しなかった女性について報告した。
家族性ADの変異(PSEN1 E280A変異)を持ちながら認知症を発症しなかった症例
この家系では、平均44歳でMCI、49歳で認知症を発症する。
彼女はこの平均年齢から30年以上たってようやくMCIを発症した形になる。
強力なPSEN1 E280A変異に打ち勝ったものは何だろうか?
著者らは、彼女をWhole-exome sequencing, Sanger DNA sequencing, Whole-genome sequencingなどで解析し、彼女がPSEN1 E280Aを持つことを確認したうえ、極めてまれなAPOE3 R136S変異(Chistchurch変異)を2コピー持つ事を突き止めた。
その他の変異は確認されなかった。
さらにpost hocで117人の親族を調べた所、6%に当たる人達がこの変異を1コピー持っていた。その中にはPSEN1 E280A変異を同時に持つ人が4人いたが、彼らは全て45歳くらいでMCIを発症していた。
つまり、APOE3 Chistchurch変異(APOE3ch)のhomozygous変異がAD発症を防いだ因子と考えられる。
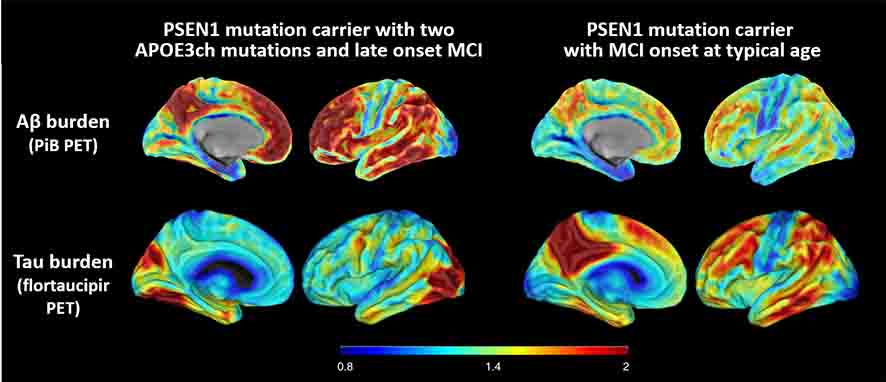
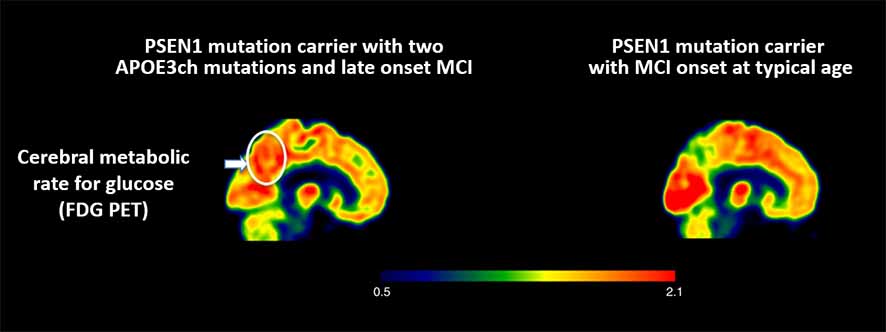
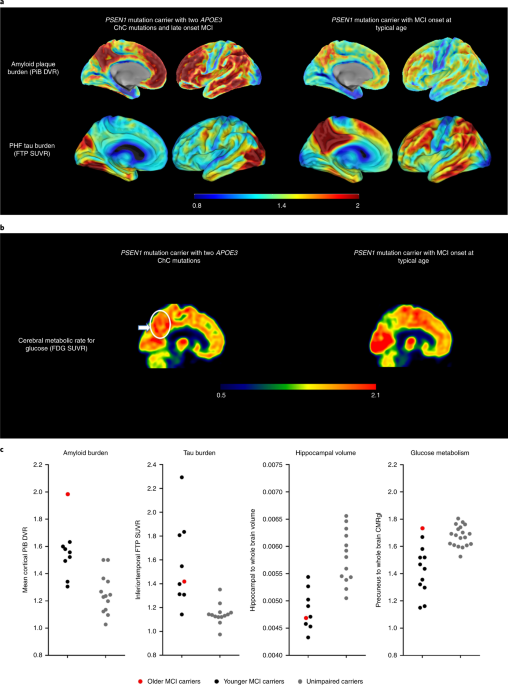
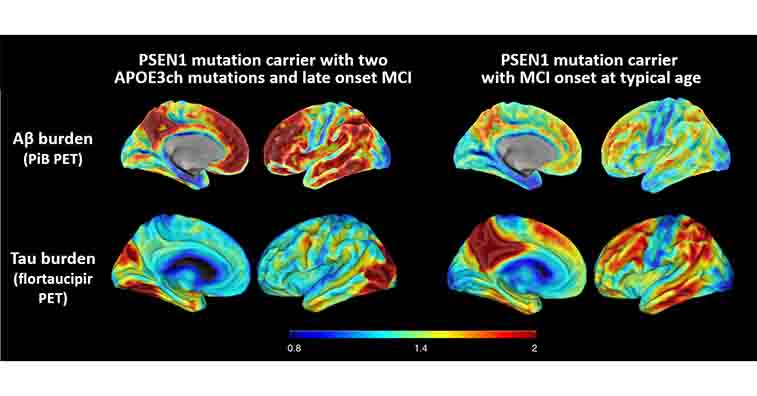
著者らは、彼女の脳内の様子を、アミロイドPET(PiB)、タウPET(flortaucipir)、糖代謝PET(fludeoxyglucose: FDG)で調べた。
驚くべきことに、彼女は同じPSEN1 E280A変異のキャリアがMCIを発症した時期と比べてはるかに多くのアミロイドB(Amyloid β: Aβ)の蓄積を認めた。
にも拘わらず、タウ凝集体の広がりはそこそこだった。
また、FDG PETでは、通常のADで代謝の落ちる楔状前部や後帯状回の代謝が保たれていた。
神経脱落の指標とされる血漿中ニューロフィラメント(neurofilament light chain: NfL)は、キャリアでない同世代の人達とほとんど変わらなかった。
APOE3chはどのようにしてAD発症を防いだのか?
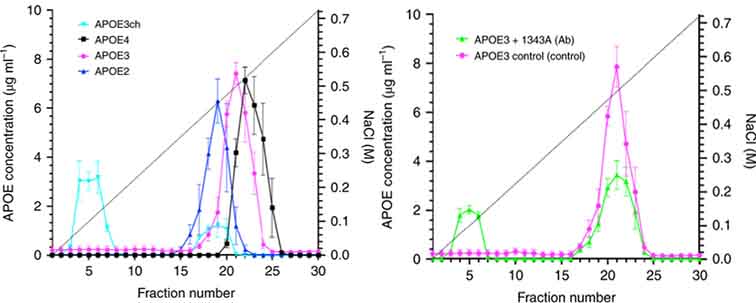
著者らは、APOEchの機能評価として、合成APOE3WT, APOE3chを作製し、それらの存在下でAβ凝集能(Thioflavin T assay)およびオリゴマー形成能(Split-luciferase Assay)の変化を比較した。
Aβの凝集/オリゴマー形成は、APOE存在下で促進されたが、APOE3WTに比べてAPOE3chはその程度が弱かった。
つまり、APOE3chはAPOE3のLoss of functionによりAD防御に働くと予測される。
APOEは、脳内でリポプロテイン受容体やヘパラン硫酸プロテオグリカン(heparan sulfate proteoglicans: HSPGs)に結合し、Aβやタウの細胞内取り込みに関与している事がわかっている。
著者らは、ヘパリンカラムを用いて、APOE4, APOE3, APOE2, APOE3chのヘパリン結合の強さを比較した。
結果は、APOE4>APOE3>APOE2>>APOE3chとなり、APOE3chはAPOE2よりもヘパリン結合能が弱かった。
また、APOE3のaa130-143領域(R136Sを含む)のモノクローナル抗体(1343A)を作製し、APOE3、APOE3+コントロール、APOE3+1343Aを比較したところ、1343A抗体はAPOE3のヘパリン結合能を減弱させた。
このことから、APOE3chは、ヘパリン結合ドメイン内にあるR136S変異のLoss of Functionにより、HSPGとの結合しにくくなることで、AD病理の進展およびAD発症を防いでいると予想される。
A unique case from the Colombian cohort of autosomal dominant Alzheimer’s disease is reported in which disease progression is substantially delayed despite unusually high amyloid plaque pathology, possibly related to a rare mutation in APOE3.
My View
この論文はAβ → タウ →神経脱落のアミロイド仮説の鎖を断ち切ったような内容になっていて、興味深い内容です。
Brief Communicationなので、さらっとvitroの結果を追加してAPOE3chの機能を予想しているわけですが、これから研究が進んできたら、もっと色々わかってくるんじゃないかと思います。
APOEとHSPGの結合阻害が、治療ターゲットとして期待できそうですね。
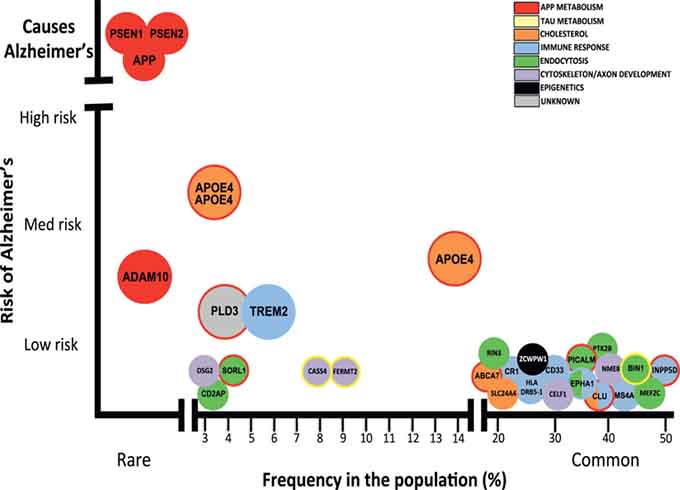
ADと原因遺伝子・リスク多型について
ADは、言わずもがな世界中で最も患者数の多い認知症ですが、そのほとんどは65歳以上に発症します。(Late-onset AD)
AD患者さんのうち、5-10%の人が65歳以前に発症し(Early-onset AD)、そのほとんどの人には家族歴があります。
現在までに、家族性ADの原因遺伝子として、3種類が同定されており(APP、PSEN1、PSEN2)、それらは全てAβの産生に関わっている遺伝子になります。
GWAS解析が進んで、ADのリスク変異、遺伝子多型も数多く同定されるようになりました。
その中で、最もAD発症と関連が深いのがAPOE多型です。
PSEN1変異について
家族性ADの7割程度を占める原因因子が第14染色体長腕上にあることは1991年ごろから知られており、1995年にこの遺伝子(PSEN1)が同定されました(Sherrington et al, Nature, 1995)。
それから現在までにこの遺伝子に200以上の変異がみつかっており、その場所は膜貫通ドメインに多い傾向にあります。E280Aはそれらの中でも最もキャリア数の多い変異です。常染色体優性遺伝の形式をとります。
また浸透率も高く、臨床症状が現れてからの進行が速い症例が多いという特徴があります。
だからこそ、この変異を持ちながら70代まで元気に過ごせていたこの女性の存在は、同じように変異遺伝子を持ち、治療法の開発を待ちわびている人々にとって一条の光となるのではないでしょうか。
Presenilin1と65%のホモロジーを持つPresenilin2にも、家族性ADの変異が見つかっていますが、変異の種類および患者数は断然少なく、発症年齢も40ー70歳くらいと幅広い傾向にあります。
機能的には、PresenilinはAPP pcosessingに関与するγ-secretaseのサブユニットの一つで、この変異によりAβ40とAβ42の産生比が、より凝集性の高いAβ42の方にシフトする事でAD発症に関与すると言われています(Kelleher and Shen, PNAS, 2017)。
コロンビアのPSEN1 E280A変異家系の大規模スタディについて
PSEN1 E280A変異は、家族性ADの中で最も患者数が多い変異ですが、その中でもコロンビアのエルレティーロ(El Retiro)という町に住む一族はキャリアの数が最も多く、また、多くの人達がバイオマーカー探索や新薬の治験に参加登録している事でも有名です。
その地域に住む人々の名称から、この変異はPaisa変異とも呼ばれています。
元々この地域は、スペインの植民地化の後、数百年にわたって外部からほぼ隔離された状態となっていたため、数十家族の同族結婚により、特定の遺伝子が世代から世代へと引き継がれてきたようです。
変異の起源は16世紀のスペイン人の入植者だと言われています。
1984年のある日、今回の論文の2nd AuthorになっているFrancisco Lopera教授がまだSan Vicente de Paul病院の神経内科のレジデントだった頃、47歳の男性が外来を受診してきました。
彼は認知症を患っており、彼と同じような症状の家族歴がありました。
その後数年にわたり、Dr. Loperaは患者の家族を訪ね、このエルレティーロの地域にたくさんの患者がいる事を突き止めました。
この地域は当時、山と峡谷に囲まれ、ゲリラ紛争により町は荒廃し、立ち入るのが難しかったそうです。
彼は週末を利用して何度も足を運び、患者と話し、病歴をとり続けました。この変異のキャリアは平均45歳くらいでMCIを発症し、50歳までに認知症に進行します。
1991年にDr. Loperaらの研究グループがこの地域の人達を対象としたケースレポートを発表すると、ハーバード大学のDr. Kosikからオファーがあり、コラボレーションが始まりました。
2004年には、FogartyやNational Institute on Aging (NIA)らの資金援助を受けて、さらにこの地域の患者さんのデータを調べ、患者さん達も新薬の治験など積極的に参加してきました。他、幾つかの製薬会社とも連携し、新薬の開発、治験を進めてきました(NIH, Fogarty International Center)。
彼らは、25家系5,000人の患者を診断し、そのうち1,800人近くが、大規模スタディに参加しました。遺伝子検査でキャリアと確認されたのは460人近くに上ります(Acosta-Baena et al, Lancet Neurol, 2011)。
面白い事に、この地域の人達の中には、Paisa変異とは違うPSEN1変異(I416T)の家系もいて、250人程度が別の治験に参加しているそうです。なぜ、違う変異がこの狭い地域に集中しているのかは、諸説ありますが、これらの変異は思っていたよりも広く普及していて、同族結婚によりこの地域でそれが顕在化しているんじゃないか、というのがコンセンサスのようです(UNCARK NEWS, 2019/05/17より)。
APOE多型について
Apolipoprotein E (APOE)は、VLDLやHDLなどのリポ蛋白複合体の構成成分です。
全身では主に肝臓で産生され、全身臓器間のコレステロールや脂肪酸の輸送に関与しています。
中枢神経系では、主にアストロサイトやミクログリアで産生され、細胞間のコレステロール輸送や、神経損傷後の修復に関与していると言われています。神経細胞表面には、APOEが結合する受容体がいくつか確認されており、HSPGはその一つです。
以前、テキサスのMarc Diamond教授らがタウの神経取り込みにHSPGが関与すると報告しており(Mirbaha et al, JBC, 2015)、今回の結果と合わせると、Aβ病理に比べてタウ病理が少なかった原因としてこの部分の関与を連想させます。
APOEにはいくつかのアイソフォームがありますが、主にAPOE2, APOE3, APOE4の3つのアイソフォームが注目されています。
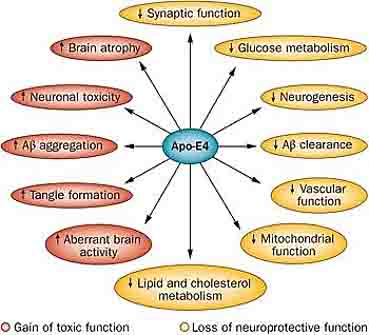
というのも、ほとんどの人はAPOE3(80%弱)ですが、APOE4を1コピーでも持つと、ADのリスクが白人で3倍弱、日本人で4倍程度あがり、2コピーともAPOE4だと、そのオッズ比が12-13倍、日本人では20倍以上に跳ね上がり、発症年齢も若年化します。
逆にAPOE2はADの保護因子として働き、APOE2を持つ人はADになりにくくなります。
APOE2/3/4の違いは何かというと、一次構造的には、112番目と158番目のアミノ酸残基(amino acid: aa)がシステインかアルギニンか、という違いだけです。(APOE2:112Cys,158Cys、APOE3:112Cys,158Arg、APOE4:112Arg,158Arg)
APOE4の場合、61Argが112Argと電気的に反発して225Gluとsalt bridgeを形成し、N末とC末が近接した構造をとります。
APOE3、APOE2はこの112番目がCysなので、構造的に開いた状態となります。
これら構造の違いにより、結合しやすいリポプロテインの種類や、受容体への結合の強さの違いが生じていると考えられています。
以前、APOE4の構造をAPOE3-likeに変化させる薬剤などが報告されていて、ADの治療ターゲットとしておもしろいなと思いました(Chen et al, JBC, 2011)。
APOEとADとの関係については、私が研究を始めた頃にはアミロイド病理との関係や血管障害のメカニズム等が主流でした。
その後、神経障害やタウの伝播抑制なども次々と報告されるようになり、今では様々な機序からADの病態に関与すると考えられています。
APOEのChristchrch変異について
1987年にⅢ型高脂血症の患者さんでAPOE2のR136Sの報告があり(Wardell et al, JCI, 1987)、その後複数例のCase reportが報告されていますが、稀な変異と考えられています。
機能的には、この変異があると、LDL受容体への結合能が落ちて、高脂血症を発症するようです(Lalazar et al, JBC, 1988)。(ただし、ヘテロで持っている場合には発症しない場合もあるようです。)
ちなみに、今回の患者さんもトリグリセリドとコレステロールの値が高く、Ⅲ型高脂血症と診断されたようです。
この変異は一般的にはどれくらいあるのかなーと思って調べてみましたが、あまり大規模なスタディーは見つけられませんでした。
一つ、4,000人の白人のAPOE変異を調べた論文(Hubacke et al, Physiol Res, 2005)があり、それによると、APOE2 R136Sを1コピー(もう一方のalleleは普通のAPOE3)持つ人が2人いたそうなので(二人は母と子)、ざっくりと0.05%くらいという事でしょうか。
Homozygousで持っている人の割合となると、、、0.000025%?レア中のレアという印象です。
他には、300人弱の家族性高脂血症のスクリーニングを行っていて、それでも1.8%にR136S変異が確認されています(Solanas-Barca et al, Atherosclerosis, 2012)。家族性高脂血症に的を絞ると少し上がりますね。
そう考えると、この家系の6%でAPOE3 R136Sの変異が見つかったというのは、驚異的な数と言えます。
PSEN1 E280A変異と同じく、APOE3 R136Sも、同族結婚により受け継いできたという事でしょう。
ただ、今回の論文では、APOE3chをホモで持っていないといけないようなので、自然発生的に期待するのはなかなか難しそうです。あと、高脂血症にはなりたくないので、遺伝子操作もどうかなーと思います。
Feasibility的には、今のところAPOEとHSPGの結合阻害をターゲットとするのが一番いいんじゃないかなーと、個人的には考えますが、どうでしょうか。