α-シヌクレイン (αsynuclein, αsyn)は、パーキンソン病 (Parkinson's disease, PD) やレヴィ小体型認知症 (Dementia with Lewy bodies, DLB) 、多系統萎縮症 (Multiple system atrophy, MSA) などのシヌクレイノパチーの主要病理蛋白になります。
これまで、αsynは、
- 140アミノ酸からなる分子量14.5kDaのタンパク
- αsynをコードするSNCA遺伝子の6つのexonのうち、exon1は非翻訳領域(untranslated region, UTR)で、exon2-5が翻訳されて140アミノ酸のαsynが作られる
という認識だったのですが、実は、exon3、exon5、または両方をスキップしたスプライシングアイソフォームがあるそうです [1] 。
今回、イギリス・ケンブリッジ大学の Dr. Vendruscolo らの研究グループは、それら「αsynのスプライシングアイソフォーム」の凝集化動態について報告しました [2]。

α-シヌクレインのスプライシングアイソフォームの凝集化動態いろいろ
The existence of proteoforms—distinct versions of a protein originating from the same gene via mechanisms such as genetic variation, RNA transcript alternative splicing, and post-translational modifications—considerably enriches the range of possible behaviors of that protein. Here, we investigated the impact of alternative splice isoforms of α-synuclein on its propensity to aggregate, a phenomenon closely associated with Parkinson’s disease and related synucleinopathies. Our observations reveal that even a relatively small amount of an isoform that is more prone to aggregation can hasten the overall aggregation of α-synuclein. These results illustrate the importance to factor in proteoforms when investigating protein behavior and their implications on disease pathology.
exon3の欠失は凝集化を速める
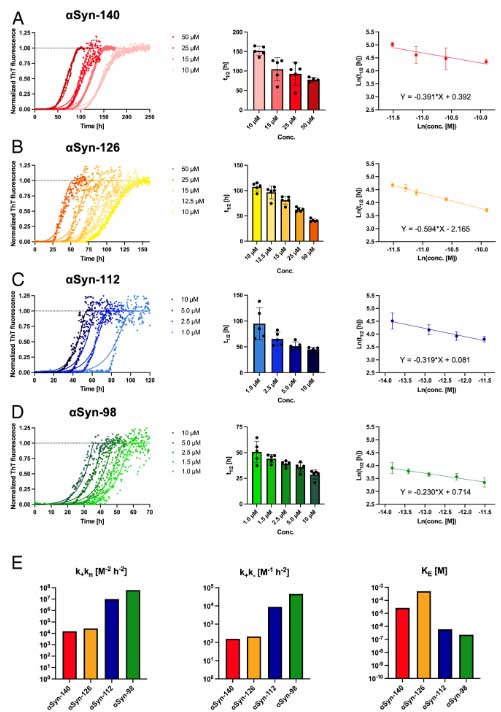
彼らは、
- αsyn-140:一番多いアイソフォーム
- αsyn-126:exon3(41-54アミノ酸)をスキップ
- αsyn-112:exon5(103-130アミノ酸)をスキップ
- αsyn-98:exon3とexon5をスキップ
の4つのタンパクを作製し、その凝集化速度を調べました。
結果、αsyn-112とαsyn-98は、αsyn-140とαsyn-126よりも速く凝集化することがわかりました。
この2つはexon5をスキップしているので、exon5の欠失は凝集加速度を早め、exon3の欠失は凝集化速度の影響しない、という可能性が示唆されました。
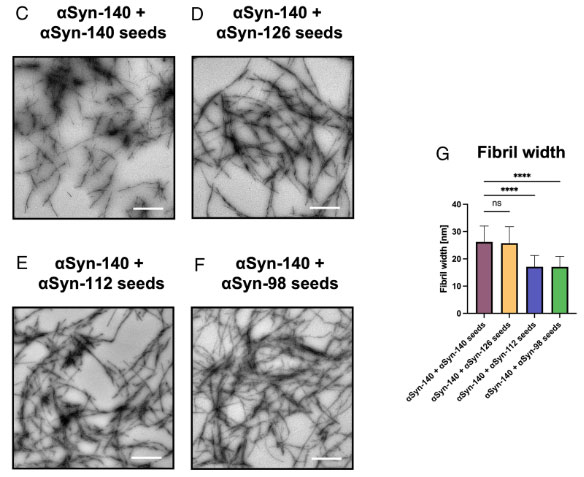
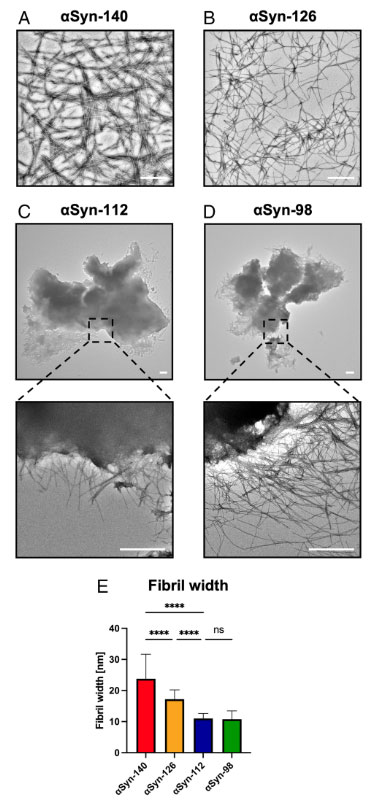
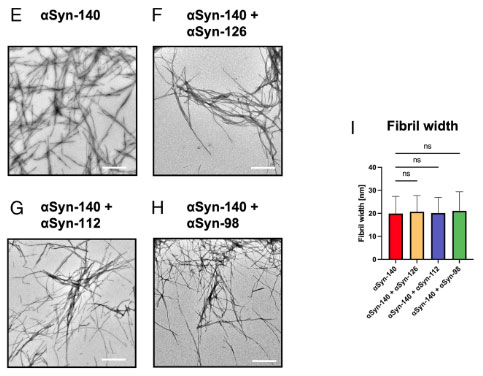
アイソフォームの違いで、形成されるフィブリルの形態が異なる
彼らはそれぞれ凝集化したフィブリルを透過電子顕微鏡(transmission electron microscope, TEM)で観察しました。
結果、αsyn-140とαsyn-126は既報と同じような繊維状のフィブリルを形態しましたが、αsyn-112とαsyn-98は塊のようになっていました。
またフィブリル線維の幅も、αsyn-140 > αsyn‐126 >αsyn-112 > αsyn‐98 の順に、だんだんと細くなっていきました。
αsyn‐112はαsyn140の凝集化を速める
それぞれのアイソフォームαsynとαsyn-140とを混合して凝集化速度を調べると、αsyn‐112と混ぜたαsyn-140は、αsyn単独の時よりも凝集化速度が速くなりました。
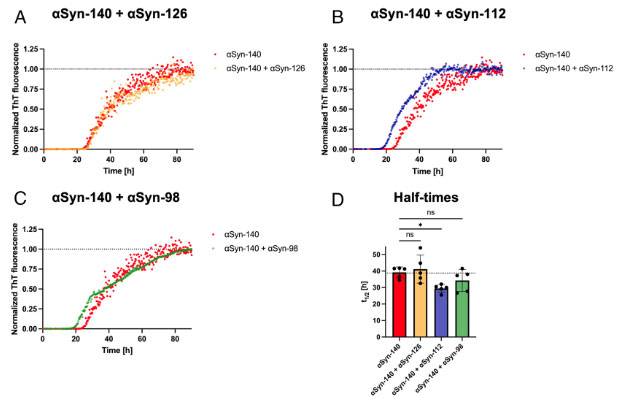
混合したαsynフィブリルの幅は、全てαsyn-140と同じ幅になっていました。
アイソフォームの凝集化シード能の違い
それぞれのαsynフィブリルをシードにして、αsyn-140モノマーの凝集化を調べると、同じαsyn‐140フィブリルをシードにしたほうが凝集化が速く、αsyn-140 > αsyn‐126 ≈ αsyn-112 > αsyn‐98という順になりました。
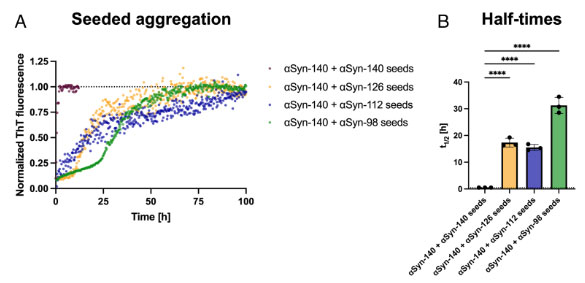
これはもしかしたら、αsyn-112 と αsyn‐98 のフィブリルは塊状になっていて、αsyn-140モノマーがアクセスしにくい、という事もあるかもしれません。
形成されたαsynフィブリルの長さは、αsyn-140/αsyn-140とαsyn-140/αsyn-126は同じくらいで、αsyn-140/αsyn-112とαsyn-140/αsyn-98は径が細く、シードとなったフィブリルの径が影響しているものを思われました。

細胞毒性はαsyn-140フィブリルの方が強い
最後に、それぞれのアイソフォームで作ったフィブリルの細胞毒性を調べたところ、αsyn-140 ≈ αsyn‐126 >αsyn-112 ≈ αsyn‐98 と、exon3の欠失がある方が細胞毒性が弱い可能性が示唆されました。
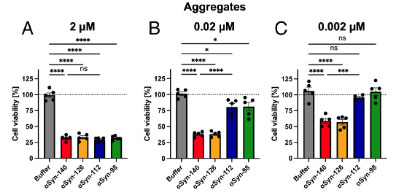
各アイソフォームαsynとαsyn-140の共凝集では細胞毒性に違いはなく、
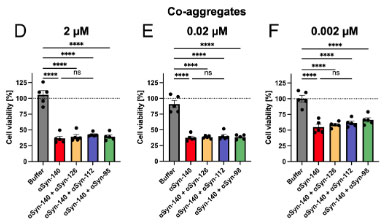
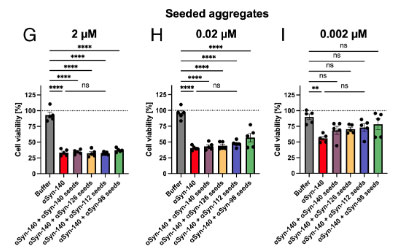
各アイソフォームαsynフィブリルをシードにしてαsyn-140モノマーを凝集化させた場合は、αsyn-140をシードにしたフィブリルが一番細胞毒性が強くなりました。
・
・
・
以上の結果から、
「αsynの各アイソフォームは凝集化動態や形成されるフィブリルの形態が異なり、またαsyn-140の凝集化動態等にも影響する」
という可能性が示唆されました。
My View
ensemblとかでは、αsynのアイソフォーム色々あるなーと思っていましたが、それがどれくらい翻訳されるのかは知りませんでした。
でも実は、αsyn-112はPDの小脳 [3] 、DLBの前頭皮質 [4, 5] 、MSAの黒質、線条体、小脳、前頭前野 [6] などで発現が確認されており、またαsynの3’領域にPDリスク変異を持つヒトでは、前頭葉皮質でαsyn-112の発現が増えているという報告もありました [7]。
それらがシヌクレイノパチーの病態にどれくらい関わるのかはわかりませんが、今回の結果からは、αsyn-114の凝集化に影響する可能性はありそうです。
αsynのC末切断片が全長αsynの凝集化を促進する事を考える [8, 9, 11, 12, 13, 14] と、「これらのαsynアイソフォームがヒトの脳内でもある程度発現していて、αsyn-140の凝集化に影響を与えている可能性は、結構あるのかもしれないなー。」と思いました。
References
- Beyer K, Ariza A. αSynuclein posttranslational modification and alternative splicing as a trigger for neurodegeneration. Mol Neurobiol. 2013 Apr;47(2):509-24. doi: 10.1007/s12035-012-8330-5. Epub 2012 Aug 25. PMID: 22923347.
- Röntgen A, Toprakcioglu Z, Tomkins JE, Vendruscolo M. Modulation of αsynuclein in vitro aggregation kinetics by its alternative splice isoforms. Proc Natl Acad Sci U S A. 2024 Feb 13;121(7):e2313465121. doi: 10.1073/pnas.2313465121. Epub 2024 Feb 7. PMID: 38324572.
- Cardo LF, Coto E, de Mena L, Ribacoba R, Mata IF, Menéndez M, Moris G, Alvarez V. Alpha-synuclein transcript isoforms in three different brain regions from Parkinson's disease and healthy subjects in relation to the SNCA rs356165/rs11931074 polymorphisms. Neurosci Lett. 2014 Mar 6;562:45-9. doi: 10.1016/j.neulet.2014.01.009. Epub 2014 Jan 10. PMID: 24418406.
- Beyer K, Domingo-Sàbat M, Humbert J, Carrato C, Ferrer I, Ariza A. Differential expression of alpha-synuclein, parkin, and synphilin-1 isoforms in Lewy body disease. Neurogenetics. 2008 Jul;9(3):163-72. doi: 10.1007/s10048-008-0124-6. Epub 2008 Mar 12. PMID: 18335262.
- Beyer K, Lao JI, Carrato C, Mate JL, López D, Ferrer I, Ariza A. Differential expression of alpha-synuclein isoforms in dementia with Lewy bodies. Neuropathol Appl Neurobiol. 2004 Dec;30(6):601-7. doi: 10.1111/j.1365-2990.2004.00572.x. PMID: 15541000.
- Brudek T, Winge K, Rasmussen NB, Bahl JM, Tanassi J, Agander TK, Hyde TM, Pakkenberg B. Altered αsynuclein, parkin, and synphilin isoform levels in multiple system atrophy brains. J Neurochem. 2016 Jan;136(1):172-85. doi: 10.1111/jnc.13392. Epub 2015 Nov 11. PMID: 26465922.
- McCarthy JJ, Linnertz C, Saucier L, Burke JR, Hulette CM, Welsh-Bohmer KA, Chiba-Falek O. The effect of SNCA 3' region on the levels of SNCA-112 splicing variant. Neurogenetics. 2011 Feb;12(1):59-64. doi: 10.1007/s10048-010-0263-4. Epub 2010 Nov 3. PMID: 21046180; PMCID: PMC3030669.
- Murray IV, Giasson BI, Quinn SM, Koppaka V, Axelsen PH, Ischiropoulos H, Trojanowski JQ, Lee VM. Role of alpha-synuclein carboxy-terminus on fibril formation in vitro. Biochemistry. 2003 Jul 22;42(28):8530-40. doi: 10.1021/bi027363r. PMID: 12859200.
- Hoyer W, Cherny D, Subramaniam V, Jovin TM. Impact of the acidic C-terminal region comprising amino acids 109-140 on alpha-synuclein aggregation in vitro. Biochemistry. 2004 Dec 28;43(51):16233-42. doi: 10.1021/bi048453u. PMID: 15610017.
- Liu CW, Giasson BI, Lewis KA, Lee VM, Demartino GN, Thomas PJ. A precipitating role for truncated alpha-synuclein and the proteasome in alpha-synuclein aggregation: implications for pathogenesis of Parkinson disease. J Biol Chem. 2005 Jun 17;280(24):22670-8. doi: 10.1074/jbc.M501508200. Epub 2005 Apr 19. PMID: 15840579.
- Levitan K, Chereau D, Cohen SI, Knowles TP, Dobson CM, Fink AL, Anderson JP, Goldstein JM, Millhauser GL. Conserved C-terminal charge exerts a profound influence on the aggregation rate of α-synuclein. J Mol Biol. 2011 Aug 12;411(2):329-33. doi: 10.1016/j.jmb.2011.05.046. Epub 2011 Jun 12. PMID: 21689664; PMCID: PMC3143250.
- van der Wateren IM, Knowles TPJ, Buell AK, Dobson CM, Galvagnion C. C-terminal truncation of α-synuclein promotes amyloid fibril amplification at physiological pH. Chem Sci. 2018 May 24;9(25):5506-5516. doi: 10.1039/c8sc01109e. PMID: 30061982; PMCID: PMC6048717.
- Sorrentino ZA, Vijayaraghavan N, Gorion KM, Riffe CJ, Strang KH, Caldwell J, Giasson BI. Physiological C-terminal truncation of α-synuclein potentiates the prion-like formation of pathological inclusions. J Biol Chem. 2018 Dec 7;293(49):18914-18932. doi: 10.1074/jbc.RA118.005603. Epub 2018 Oct 16. PMID: 30327435; PMCID: PMC6295729.