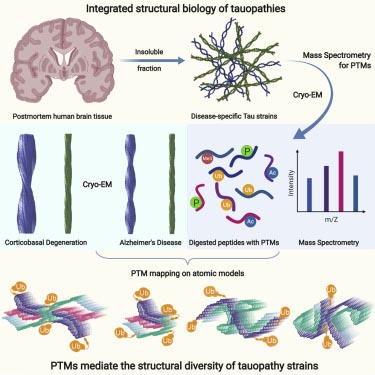
クライオ電子顕微鏡法(cryo-electron microscopy, cryo-EM)でのフィラメント構造解析については、このブログでも何回かとりあげました。
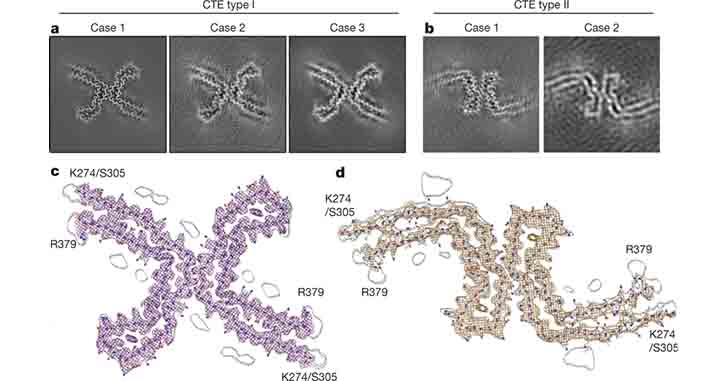
慢性外傷性脳症(Chronic traumatic encephalopathy, CTE)は、何回も頭部に衝撃を受けた人等に起こる、脳内の神経変性性タウタウオパチーである。 CTEでは、過リン酸化したタウが、脳皮質の浅 …
タウオパチーとして分類される疾患(Alzhiemer's disease, AD; Pick's disease, PiD; CBD; Progressive supranuclear palsy, PSP; Chron …
Cryo-EMで前方側頭葉変性症(FLTD), アルツハイマー病(AD), 慢性外傷性脳症(CTE), 大脳皮質基底核変性症(CBD)のタウを次々と解析している、イギリス・MRC Laboratory of Molecu …
神経変性疾患で大きなトピックとなっているタンパク凝集体の実験について。 リコンビナントのタウやα-シヌクレイン (α-synuclein, α-syn) の凝集体は、実際の患者さん脳内のタンパク凝集体と構造が異なることが …
主に、イギリス・MRC分子生物学研究所の Dr. Goedert、Dr. Scheres らの研究グループからの報告が多く、ここ数年の間にタウオパチーやシヌクレイノパチーのフィラメント構造を次々と解明してきました。
今回彼らは、今までの研究の集大成として(かどうかはわかりませんが)、
「Cryo-EMによるタウフィラメントの構造解析の結果を元にタウオパチーを再分類する」
事を提唱しました [1]。

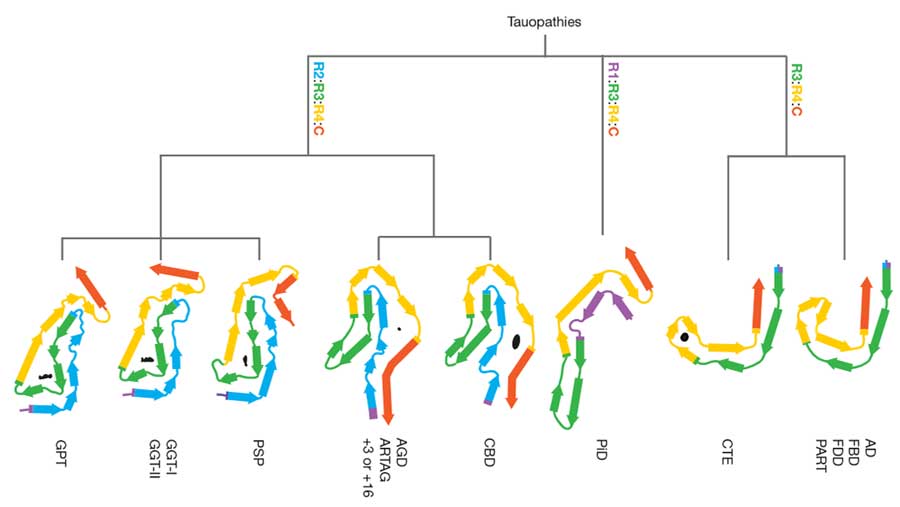
タウフィラメントの構造でタウオパチーを分類する
彼らは、これまで報告してきた結果
- アルツハイマー病(Alzheimer's disease, AD)[2]
- ピック病(Pick's disease, PiD) [3]
- 慢性外傷性脳症(chronic traumatic encephalopathy, CTE)[4]
- 原発性年齢関連タウオパチー(primary age-related tauopathy, PART [6]
に加え、新たに
- Familial British dementia (FBD)
- familial Danish dementia (FDD)
- 嗜銀顆粒性認知症(Argyrophilic Grain Dementia, AGD)
- 加齢関連タウアストログリオパチー(aging-related tau astrogliopathy, ARTAG)
- 進行性核上性麻痺(Progressive supranuclear palsy, PSP)
- 球状グリア性タウオパチー(globular glial tauopathy, GGT)
をCryo-EMで解析しました。
抽出は、いつものようにサルコシルで処理してフィラメントコアが観察しやすいようにしました。
Cryo-EMによるタウフィラメントの解析結果
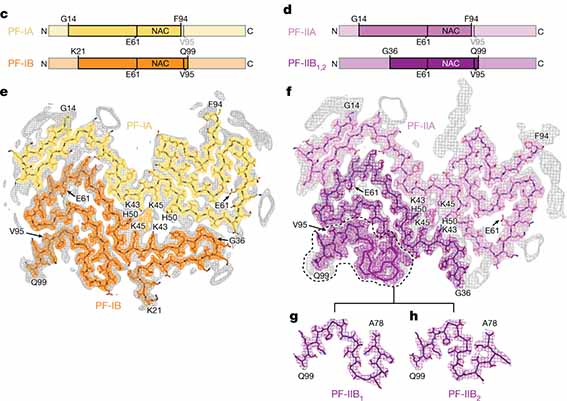
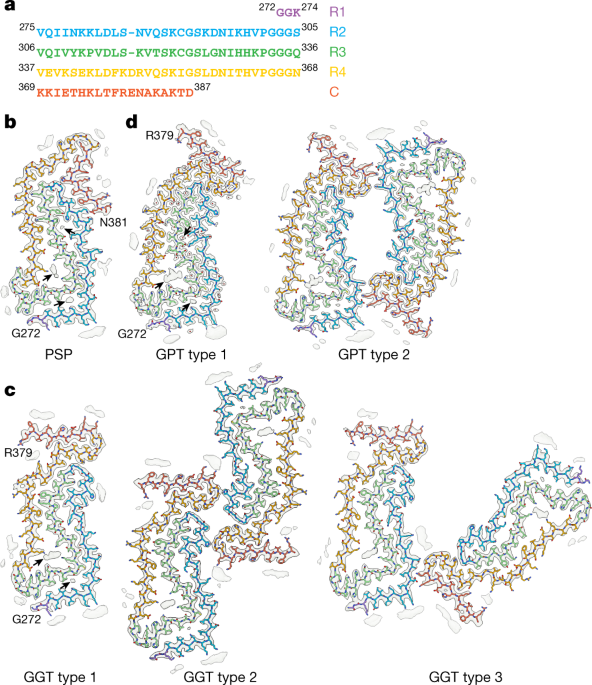
PSPとGGTはタウフィラメントの構造が似ている
PSPとGGTはともにタウの微小管結合領域(microtubule binding domain, MTBD)を構成するR1-R4のうち、R2,R3,R4でフィラメントコアを形成しており、
R3とR4の折り曲がり部分には高電子密度の陰性荷電分子(anionic molecule)と思われる物質を含んでいました。
AGDとARTAGはタウフィラメントの構造がCBDと似ている
AGDとARTAGは、PSP, GGTと同じ4リピートタウオパチーですが、
タウフィラメントの構造は、PSP/GGT とは少し違って、R3の一部とR4がR2と対面するような折りたたみ構造になっていて、
R2とR4の間に小さな高電子密度領域がありました。
これはどちらかというと、以前報告したCBDの構造 [5] と似ていました。
PiDは唯一の3Rタウオパチー
これは以前方向した内容 [2] ですが、
PiDは3Rタウオパチーで、R1, R3, R4が対面したフィラメント構造になっています。
CTEはADと似ているけどちょっと違う
こちらも以前報告した内容 [4] ですが、
CTEのタウフィラメント構造はADと非常によく似ていていて、R3とR4が対面するようなフィラメント構造になっています。
けれどもADと違って、R4の折りたたみ部位に高電子密度の anionic molecule を含んでいます。
AD, PART, FBD, FDD はタウフィラメントの構造が同じ
PARTのタウフィラメントはADのそれと同じ、という事は以前報告していましたが [6]、
今回新たに追加したFBDとFDDも、タウフィラメントの構造はADと同じ、R3とR4が対面した構造をしていました。
タウフィラメント構造でタウオパチーを分類
以上の結果から、彼らは下記のようなタウオパチー分類を提唱しました。
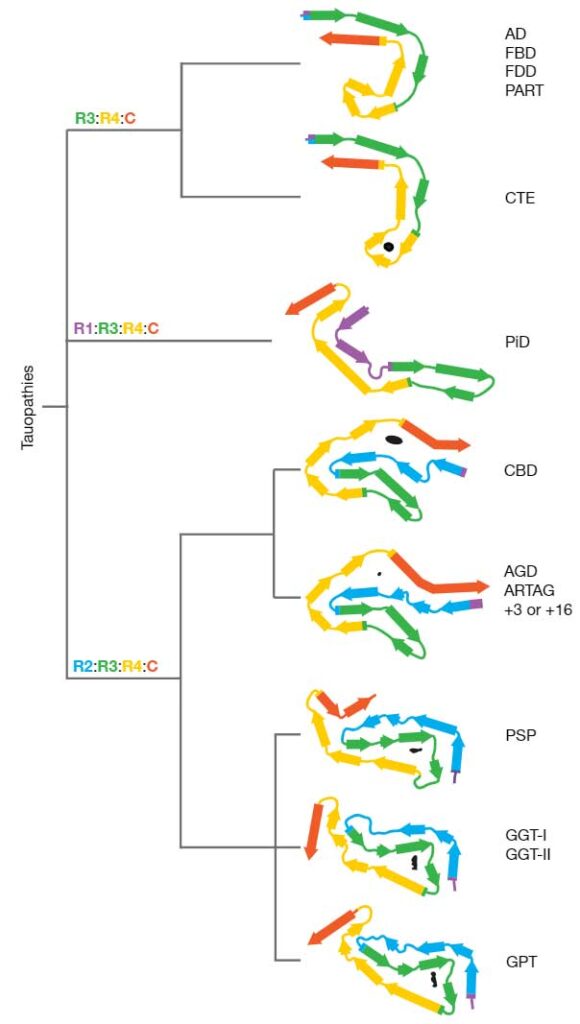
Cryo-electron microscopy structures of tau filaments from progressive supranuclear palsy and other tauopathies reveal new filament conformations, and suggest that tauopathies can be classified on several different levels according to their filament folds.
My View
今まで、神経変性疾患の原因がわからなかった時代にはそれぞれの症候で疾患名がつけられ、
やがてタウ、シヌクレイン、TDP-43などの病理蛋白が同定されてタウオパチー、シヌクレイノパチー、TDP-43プロテイノパチーなどの分類が生まれ、
更に一部の疾患は病名が変更になったり一つの病名に統合されたりしました(e.g. 多系統萎縮症(Multiple system atrophy, MSA)など)。
今回はさらに技術が進み、タウフィラメントの構造によってタウオパチーを分類する、という事が提唱され……なんとゆーか、この分野のここ数十年での変遷って凄いなーと思います。
病理病態のメカニズムを考える上で、原因蛋白の構造を理解するって凄く重要だと思うので、ここ数年のこれらの解析報告は、分野内での研究をぐっと推し進めてくれているんじゃないかと思います。
自分ではこんな解析はできませんが、自分の研究に関係するヒントもこれらの論文の中にたくさん詰め込まれているので、とてもありがたいです。
References
- Shi Y, Zhang W, Yang Y, Murzin AG, Falcon B, Kotecha A, van Beers M, Tarutani A, Kametani F, Garringer HJ, Vidal R, Hallinan GI, Lashley T, Saito Y, Murayama S, Yoshida M, Tanaka H, Kakita A, Ikeuchi T, Robinson AC, Mann DMA, Kovacs GG, Revesz T, Ghetti B, Hasegawa M, Goedert M, Scheres SHW. Structure-based classification of tauopathies. Nature. 2021 Oct;598(7880):359-363. doi: 10.1038/s41586-021-03911-7. Epub 2021 Sep 29. PMID: 34588692; PMCID: PMC7611841.
- Fitzpatrick AWP, Falcon B, He S, Murzin AG, Murshudov G, Garringer HJ, Crowther RA, Ghetti B, Goedert M, Scheres SHW. Cryo-EM structures of tau filaments from Alzheimer's disease. Nature. 2017 Jul 13;547(7662):185-190. doi: 10.1038/nature23002. Epub 2017 Jul 5. PMID: 28678775; PMCID: PMC5552202.
- Falcon B, Zhang W, Murzin AG, Murshudov G, Garringer HJ, Vidal R, Crowther RA, Ghetti B, Scheres SHW, Goedert M. Structures of filaments from Pick's disease reveal a novel tau protein fold. Nature. 2018 Sep;561(7721):137-140. doi: 10.1038/s41586-018-0454-y. Epub 2018 Aug 29. PMID: 30158706; PMCID: PMC6204212.
- Falcon B, Zivanov J, Zhang W, Murzin AG, Garringer HJ, Vidal R, Crowther RA, Newell KL, Ghetti B, Goedert M, Scheres SHW. Novel tau filament fold in chronic traumatic encephalopathy encloses hydrophobic molecules. Nature. 2019 Apr;568(7752):420-423. doi: 10.1038/s41586-019-1026-5. Epub 2019 Mar 20. PMID: 30894745; PMCID: PMC6472968.
- Zhang W, Tarutani A, Newell KL, Murzin AG, Matsubara T, Falcon B, Vidal R, Garringer HJ, Shi Y, Ikeuchi T, Murayama S, Ghetti B, Hasegawa M, Goedert M, Scheres SHW. Novel tau filament fold in corticobasal degeneration. Nature. 2020 Apr;580(7802):283-287. doi: 10.1038/s41586-020-2043-0. Epub 2020 Feb 12. PMID: 32050258; PMCID: PMC7148158.
- Shi Y, Murzin AG, Falcon B, Epstein A, Machin J, Tempest P, Newell KL, Vidal R, Garringer HJ, Sahara N, Higuchi M, Ghetti B, Jang MK, Scheres SHW, Goedert M. Cryo-EM structures of tau filaments from Alzheimer's disease with PET ligand APN-1607. Acta Neuropathol. 2021 May;141(5):697-708. doi: 10.1007/s00401-021-02294-3. Epub 2021 Mar 16. Erratum in: Acta Neuropathol. 2021 Apr 8;: PMID: 33723967; PMCID: PMC8043864.
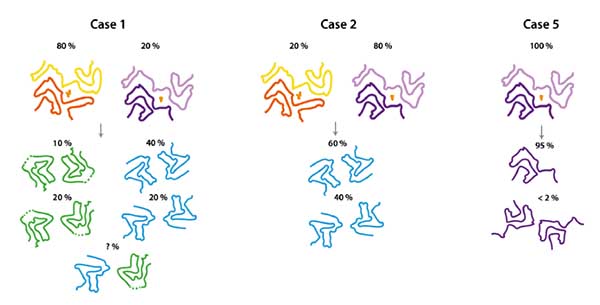


ありがとうございます。これまでのevidenceからすると、病変の拡がり規定するもしくは強く相関することは確からしいですね。自分が興味があるのは、異常タンパク質の蓄積と臨床症状に結構乖離があるという点です。妄想ですが、こうした凝集構造それぞれに対して特定の前駆状態(顆粒状タウとか)やPTMがあって、それらがむしろ毒性を有しているのかな、とか部位や神経回路、細胞に特異的な環境があってそれがタウ凝集体の構造の特異性を規定するのかな、とかいろいろ考えてしまいます。でも、自分でも凝集作る実験やってみたくなってきています!
そうですね。Aβやタウはオリゴマーの方が毒性が強いっていいますし、凝集体形成過程でのスイートスポットみたいな状態が長くつづいた場合に神経障害が強くなるのかもですね。
凝集する蛋白によってもかなり違いますよね。例えばタウとかシヌクレインは派手に病変が広がる割には神経細胞死が少なくて、TDP-43はあんなに小さな凝集体なのに周囲の神経障害が著しかったり。うちのPIは、タウやシヌクレインはTDPに比べて毒性が低いから、神経障害が強く出る前に病変がわさっと広がるんだ、とよく言っています。
神経回路や細胞の環境が凝集体構造に影響するというのも、とても興味深いです。例えば最初に青斑核にできるタウ病理とそこから進んだ嗅内皮質にできるタウ病理では凝集具合がかなり違うので、辺縁系の環境が凝集体形成過程に影響している可能性もあるんじゃないかと思っています。
そこらへん詰められたら面白いなー、と私もよく妄想しています。
勉強不足なのですが、沈着する細胞の場所などをこうした構造の違いは規定するのでしょうか?PSPとCBDとか。PSPはRSでもFTLDでも、ほぼ同じ構造だったということでしょうか?それも不思議な気がします。
そうですね…私は構造の違いが細胞選択性や細胞内局在などの違いに影響すると思っています。
根拠としては、それぞれの疾患(PSPやCBDなど)から抽出したタウをマウスに接種すると原疾患と同じような場所に凝集体を作る(e.g. PMID23690619, PMID29054878) からですが、直接証明されているかと聞かれたら確かにまだできていないですね。
一方で「凝集する細胞の違いがその凝集体の性質を規定する」という論文(e.g. PMID29743672)もありますし、この手のトピックはまだブラックボックスな感じですね。
個人的に非常に興味深い内容だと思います。
PSP等の詳しい構造解析について、ブログの記事では結果をだいぶ端折って書いてしまいました。すみません。
彼らは
・PSP-RS (前頭葉皮質と視床, n=3)
・PSP-CBD (前頭葉皮質, n=1)
・PSP-P (前頭葉皮質, n=1)
・PSP-F (被殻とと側頭葉皮質, n=2)
をそれぞれ解析していて、ほとんど同じ構造だったとしています(PSP-foldと命名)。
ただ、PSP-Fの一例だけ違っていて、PSP-foldとGGT-foldの中間みたいな構造だったそうです(GGT-PSP-tau-fold or GPT-fold と命名)。
ここからは私の推測ですが、
構造が同じだったら同じような病理を作るけれども、脳内のどの部位に最初にシードができてそれがどの神経回路をメインに広がっていくかで解剖学的局在が変わり、それが臨床症状の多様性に影響する、という可能性もあるんじゃないかなーと思っています。
……が、どう思われますか?