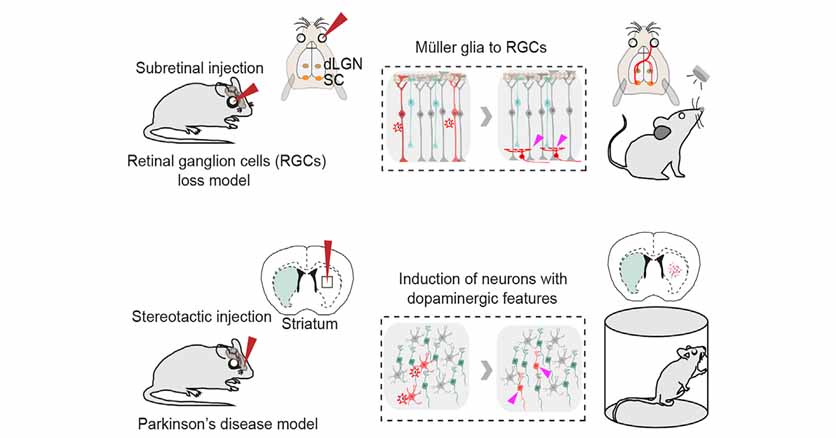
以前このブログで、「グリアに遺伝子改変操作を加えて機能性ニューロンに変化させる」という内容の論文を紹介しました。
脳内のグリア細胞を神経細胞に変化させると、神経変性疾患などで失った神経を補充し、機能改善させる事ができる。 以前、中国の研究グループから、in vitroでpolypyrimidine tract-binding pro …
以前、CRISPR-Rxシステムを使ってpolypyrimidine tract-binding protein 1 (Ptbp1) をノックダウンし、 アストログリアを網膜細胞や線条体のドパミン神経細胞(domamin …
上記2つはマウスのPtbp1をノックダウンしてアストロサイトをニューロンに変える [1, 2] という方法 でしたが、
他にもNeuroD1を過剰発現させてニューロンに変える [3, 4, 5] という方法もあります。
両者とも主に中国からの報告が多く、「最近の中国は凄いな」と思っていました。
今回アメリカ・テキサス大学サウスウェスタンメディカルセンターの Dr. Wang, Dr. Zhang らの研究グループ(こちらも全員中国系ですが)からの報告 [5] は、それらの研究に「まった」をかける内容で、
個人的にはちょっとがっかりでしたが、検証はとても大事な事だと思うので書き留めておきます。

グリアを神経に変えて病気を治す……という論文には間違いがあったらしい
今回彼らが主に検証したのは、NeuroD1↑もしくはPtbp1↓で局所のアストロサイトをニューロンに変換(A to N コンバージョン)させる研究に関してです。
NeuroD1での形質転換マウスを検証:一見それっぽいけど…
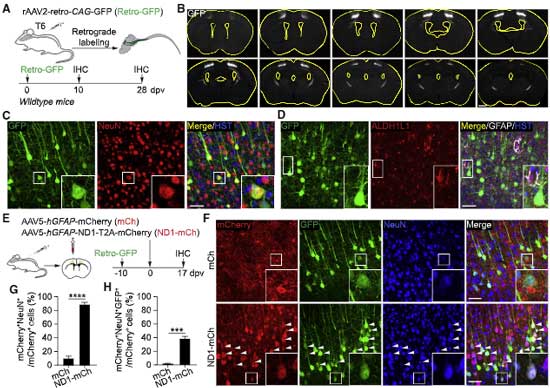
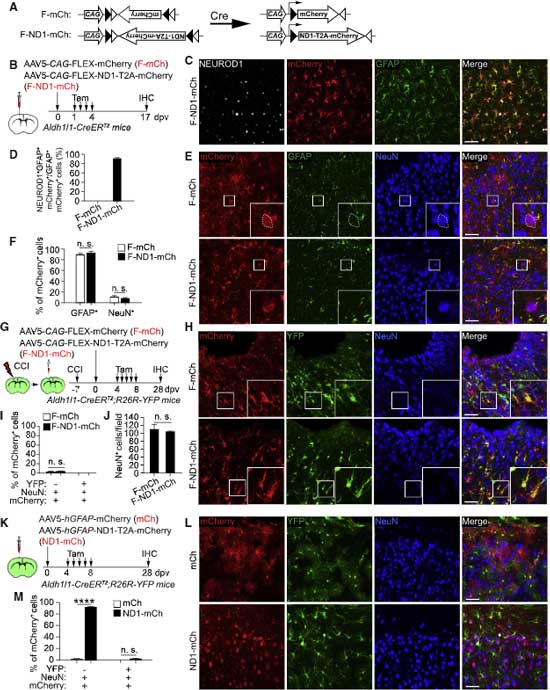
彼らが最初に検証したのは、アデノ随伴ウイルス(Adeno-associated virus, AAV)ベクターを使った in vivo の実験です。
彼らは、検証論文の著者たちが使用したベクターを同じベクター(AAV2, AAV5, AAV8, AAV9, PHP.eB)を使用し、同じプロモーター(681-bp gfaABC1D human GFAP promoter, hGFAP)を使用してアストロサイト特異的に目的の遺伝子を強制発現させました。
- hGFAP-mCherry (mCh)
- hGFAP-NEUROD1-T2A-mCherry (ND1-mCh)
の2つをマウスの新皮質に注入すると、4日後にはGFAP+アストロサイトがたくさんラベリングされていました。
17日後には、ND1-mChを注入したマウスの約80%のmCherry+細胞がニューロンのマーカーであるNeuN陽性となっており、
mCh を注入した方のマウスは約90%がアストロサイトのままでした。
ところが、タイムラプスイメージングで経時的に発現マーカーを追うと、ND1-mChでmCh+NeuN+となったニューロン達は、神経前駆細胞のマーカーである doublecortin (DCX) を発現しませんでした。
つまり、「神経前駆細胞の過程を経ていない」事になります。
レポーター陽性ニューロン達は本当に元アストロサイトなのか検証
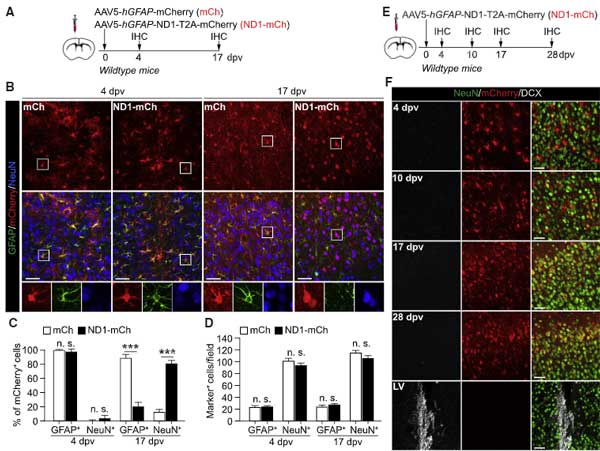
ND1-mCh注入後にmCherry+となったニューロン達は、本当にアストロサイト由来なのか検証するため、彼らは
- タモキシフェン投与でALDH1L1(アストロサイトマーカー)プロモーター下にCreを発現するマウス(Aldh1l1-CreERT2)
- R26R-YFPマウス
を交配して、タモキシフェン投与下でアストロサイト特異的にYFPを蛍光標識するマウスを作製しました。
このマウスに mCh と ND1-mCh をAAVベクターで導入すると、
注入17日後にmCherry+NeuN+となった細胞はYEPで標識されませんでした。
別の蛍光標識(GFP, tdTomato)でも検証しましたが、やはり同じ結果で、
「NeuroD1でコンバージョンしたとされるニューロン達はアストロサイト由来ではないのでは?」
という考えが濃厚となってきました。
脳障害後のA to N コンバージョンにも疑問
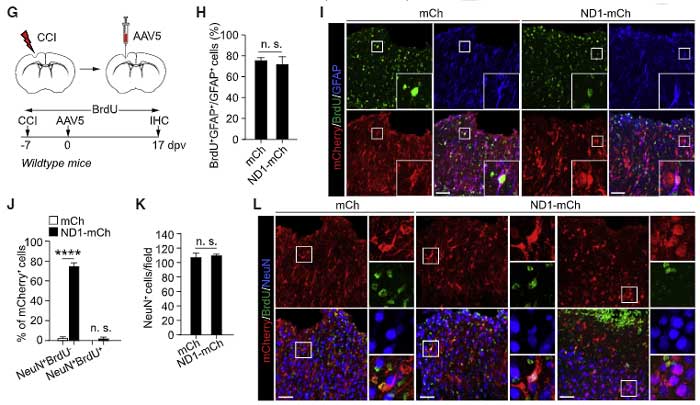
続いて、以前報告があった [6, 7]ような、脳損傷などの病態で活性化アストロサイト(BrdUで増殖中の細胞としてラベリング)がコンバージョンするかどうかも調べました。
ND1-mCh群では、約75%のmCherry+細胞がNeuNを発現したのに対し、mCh群では2.3%程度しか発現せず、この結果は既報と一致しました。
しかしながら、ND1-mCh群でmCherry+となった細胞の約2%くらいしかBrdU+NeuN+にならず、
「ラベリングされた細胞は活性型アストロサイトではなくニューロン」
という可能性がでてきました。
AAVを使った Cre-FLEX システムはアストロサイト以外にも目的遺伝子を発現するみたい
既報 [1, 3] で使用されたシステムはAAVを使ったCre-FLEXシステムでした。
これは、二種類のAAVベクターを使って、片方はアストロサイトをターゲットにするためのhGFAP-Creを乗せ、
もう片方は CAG-FLEX-mCherry (F-mCh) もしくは CAG-FLEX-NEUROD1-T2A-mCherry (F-ND1-mCh) を乗せて、
持続的にアクティブな状態のCAGプロモーター下で、Cre依存的に目的の遺伝子を形質導入する仕組みになっています。
これと同じ方法を使って著者らが検証したところ、なんとNeuN+のニューロンにCreが発現していました。
いくつかのAAVベクター(AAV8, AAV9, AAV5)で検証しましたが、全て同じ結果でした。
これらの結果から、
「既報で使われていた dual AAV-based Cre-FLEX システムを使うとアストロサイト特異的にCreを発現しなくなる」
という可能性が示唆されました。
アストロサイトだけにNEUROD1を発現させると、A to N コンバージョンは再現されない
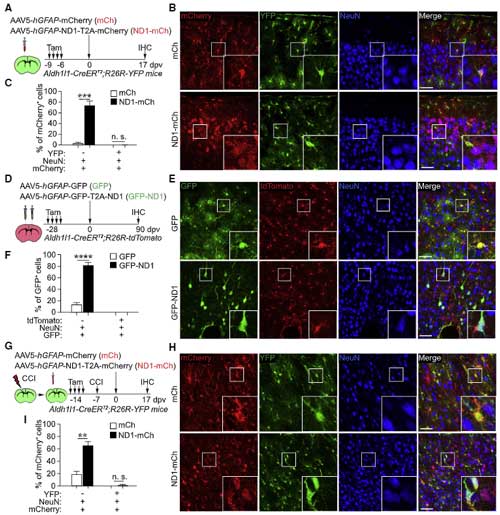
じゃあ、厳密にアストロサイトだけにNEUROD1を発現させたら、A to N コンバージョンはどうなるのか、という疑問が湧くので、
著者らはタモキシフェンでアストロサイトのマーカーAldh1l1プロモーター下にCreを発現するマウス(Aldh1/1-CreERT2マウス)を使って、F-mCh もしくは F-ND1-mCh AAV5 ウイルスを注入して確認しました。
注入17日後に確認すると、mCherry は主に GFAP+アストロサイトに発現(約90-95%)しており、NeuN+ニューロンでの発現は少なく、その量は F-mCh 注入群とほとんど変わりませんでした。
また、外傷による誘導や、Aldh1l1-CreDRT2;R26R-YFPマウスでも検証し、全て A to T コンバージョンは見られませんでした。
……どうやら、
「成熟したアストロサイトに限定してNEUROD1を形質導入した場合、17日後ではニューロンにはならない」
ようです。
「タモキシフェンがリプログラミングの現象を阻害している可能性もあるんじゃ」という意見も出てきそうですが、AAV注入前にタモキシフェンを投与していてmCherry+ニューロンの発現に影響をきたしていないので、その可能性は低そうです。
また、タモキシフェンを後から投与するプロトコールも試しましたが、こちらも影響なしでした。
また既報で「NEUROD1とDLX2をコトランスフェクションしたら A to N コンバージョンが起こる [1]」とあるのでそれも検証しましたが、だいたい上記と同じ結果になりました。
NEUROD1で誘導、と言われたレポーター陽性ニューロンは、元々そこにいたニューロン達だった
これまで、「NEUROD1導入後にレポーターが陽性になっているニューロンは、アストロサイト由来ではない」という事を検証してきましたが、
「じゃあ、レポーター陽性ニューロンって、結局何由来なの?」という事について、検証していきました。
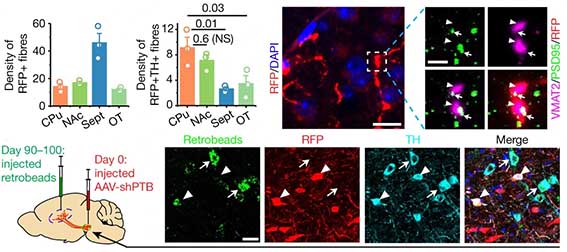
彼らは、投射ニューロンの軸索を逆行性に進むrAAV2-レトロウイルスにGFPを組み込んだベクター(rAAV2-retro-CAG-GFP, Retro-GFP)を脊髄に注入して、その脳脊髄の神経回路を逆行性にGFPで蛍光標識したマウスを作製し、
そのマウスの蛍光標識ニューロンの近くに mCh と ND1-mCh を注入して検証しました。
すると、ND1-mCh 注入後の多くの mCherry陽性細胞は、GFP陽性で、
「NEUROD1でコンバージョンされたニューロンというのは、元々そこにいたニューロン達だった」
という事が判明しました。

AAVに組み込んだ遺伝子によって細胞選択性が変わる?
アストロサイト特異的にNEUROD1とトレーサーを発現させようとしたのに、ニューロンでもトレーサーが発現するなんて……なんでこんな事が起こるのでしょうか?
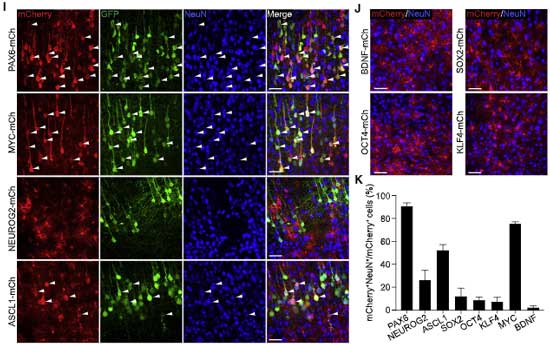
その原因について検証するため、著者らはNEUROD1以外の遺伝子でも同様の実験をしてみました。
使用した導入遺伝子は、下記8つです。
- PAX6
- NEUROG2
- ASCL2
- SOX2
- OCT4
- KLF4
- MYC
- BDNF
このうち、
- PAX6(約90%)
- MYC(約75%)
- ASCL1(約50%)
- NEUROG2(約25%)
で mCherry陽性ニューロンを認めました。
そしてこれらの mCherry陽性細胞のほとんどが、前もって蛍光標識しておいたGFPを発現していました。
SOX2, OCT4, KLF4, BDNF ではこのような現象は起こりませんでした。
以上の結果から、
「特定の遺伝子をAAVベクターで発現させると、遺伝子発現細胞の特異性が変わる」
という可能性が考えられました。
PTBD1ノックダウン実験ではそもそも再現性がとれなかった
以上、NEUROD1↑で細胞選択性が損なわれ、
「アストロサイトからニューロンに変換した、とされたトレーサー陽性ニューロンは、元々そこにいたニューロン達だった」
という結果が得られました。
では、他の系で示されていた A to N コンバージョンはどうなのか、という事を検証するため、著者らは PTBD1ノックダウンマウスについても検証しました。
ところが、NEUROD1の時と違い、PTBD1ノックダウンではニューロンがトレーサーを発現せず、
「そもそも再現性がとれない」
という結果になりました。
In vivo cell fate conversions have emerged as potential regeneration-based therapeutics for injury and disease. Recent studies reported that ectopic expression or knockdown of certain factors can convert resident astrocytes into functional neurons with high efficiency, region specificity, and precis …
My View
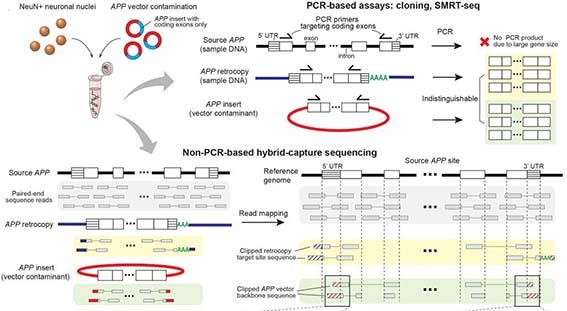
以前、APPのトランスポゾン様な動きを報告した論文で、原因はベクターのコンタミだったのではないか、という事を検証した論文でも思いましたが、
以前、孤発性アルツハイマー病(Alzheimer's disease, AD)で、 アミロイド前駆体蛋白質(Amyloid precursor protein, APP)が、転写後にゲノム遺伝子に挿入されるという現象が多 …
「他人の実験結果を検証するのって、かなり大変だよなー」と思います。
よっぽど確証がないと迂闊なことは言えないし、これでもかって実験して検証する必要がありますね。
しかも出た結果は未来を切り開くという事にはならないし……
でも、誰かがやらなければ、多くの研究者が時間とお金を無駄に費やす事になるので、みんなのためには大変重要な研究だと思います。
PTBD1の方は再現性が得られなかったようですが、NEUROD1の方は、
「結果は再現できたけど、その解釈が間違っているかもしれない。」
という内容でした。
どこでこの現象に気づいたのかわかりませんが、論文中では、タイムラプスで前駆細胞の段階を経ていない事からスタートしており、
「同じ現象でも違う角度から見て初めて見えてくるものがある」
という事を示してくれるいい例だと思いました。
今回は vivo の実験で A to N コンバージョンがメインでしたが、vitro の実験結果はどうなんでしょうか?
細胞株はモノクロだし、以前アストロサイトの初代培養をしていた時は、ニューロンのコンタミはほとんど考えられなかった(逆は普通にありますが)ので、vitro の結果は本当だけど vivo では再現できないってことかな?
あと、ミクログリアなど、他の細胞をニューロンにコンバージョンする報告についてはどうなのか、とか、他にも色々検証が必要……かもしれません。
References
- Wu Z, Parry M, Hou XY, Liu MH, Wang H, Cain R, Pei ZF, Chen YC, Guo ZY, Abhijeet S, Chen G. Gene therapy conversion of striatal astrocytes into GABAergic neurons in mouse models of Huntington's disease. Nat Commun. 2020 Feb 27;11(1):1105. doi: 10.1038/s41467-020-14855-3. PMID: 32107381; PMCID: PMC7046613.
- Zhou H, Su J, Hu X, Zhou C, Li H, Chen Z, Xiao Q, Wang B, Wu W, Sun Y, Zhou Y, Tang C, Liu F, Wang L, Feng C, Liu M, Li S, Zhang Y, Xu H, Yao H, Shi L, Yang H. Glia-to-Neuron Conversion by CRISPR-CasRx Alleviates Symptoms of Neurological Disease in Mice. Cell. 2020 Apr 30;181(3):590-603.e16. doi: 10.1016/j.cell.2020.03.024. Epub 2020 Apr 8. PMID: 32272060.
- Chen YC, Ma NX, Pei ZF, Wu Z, Do-Monte FH, Keefe S, Yellin E, Chen MS, Yin JC, Lee G, Minier-Toribio A, Hu Y, Bai YT, Lee K, Quirk GJ, Chen G. A NeuroD1 AAV-Based Gene Therapy for Functional Brain Repair after Ischemic Injury through In Vivo Astrocyte-to-Neuron Conversion. Mol Ther. 2020 Jan 8;28(1):217-234. doi: 10.1016/j.ymthe.2019.09.003. Epub 2019 Sep 6. PMID: 31551137; PMCID: PMC6952185.
- Wu Z, Parry M, Hou XY, Liu MH, Wang H, Cain R, Pei ZF, Chen YC, Guo ZY, Abhijeet S, Chen G. Gene therapy conversion of striatal astrocytes into GABAergic neurons in mouse models of Huntington's disease. Nat Commun. 2020 Feb 27;11(1):1105. doi: 10.1038/s41467-020-14855-3. PMID: 32107381; PMCID: PMC7046613.
- Liu MH, Li W, Zheng JJ, Xu YG, He Q, Chen G. Differential neuronal reprogramming induced by NeuroD1 from astrocytes in grey matter versus white matter. Neural Regen Res. 2020 Feb;15(2):342-351. doi: 10.4103/1673-5374.265185. PMID: 31552908; PMCID: PMC6905344.
- Wang LL, Serrano C, Zhong X, Ma S, Zou Y, Zhang CL. Revisiting astrocyte to neuron conversion with lineage tracing in vivo. Cell. 2021 Oct 14;184(21):5465-5481.e16. doi: 10.1016/j.cell.2021.09.005. Epub 2021 Sep 27. PMID: 34582787.
- Grande A, Sumiyoshi K, López-Juárez A, Howard J, Sakthivel B, Aronow B, Campbell K, Nakafuku M. Environmental impact on direct neuronal reprogramming in vivo in the adult brain. Nat Commun. 2013;4:2373. doi: 10.1038/ncomms3373. PMID: 23974433; PMCID: PMC3786770.
- Heinrich C, Bergami M, Gascón S, Lepier A, Viganò F, Dimou L, Sutor B, Berninger B, Götz M. Sox2-mediated conversion of NG2 glia into induced neurons in the injured adult cerebral cortex. Stem Cell Reports. 2014 Dec 9;3(6):1000-14. doi: 10.1016/j.stemcr.2014.10.007. Epub 2014 Nov 20. PMID: 25458895; PMCID: PMC4264057.