オートファジーは、ノーベル賞を受賞された大隅先生らが酵母で多くの関連遺伝子を同定され、
最近では、発生と分化、がんや神経変性疾患、廊下、免疫応答、抗原提示、細胞死、病原体の排除など、実に多くの機構に関与している事がわかっています [1] 。
現在は30を超えるATG遺伝子が見いだされており、
そのうち、オートファゴソームの形成に必須の遺伝子は18個(atg1-atg10, atg12,-atg14, atg16-atg18, atg29, atg31) あるそうです [2]。
そのうちの一つ、atg16は、マウスでは酵母にはないWDドメインを有しており、水嶋先生、吉森先生らによって、Atg16Lと命名されました [3]。
atg16/Atg16Lともに、Atg15-Atg12共有結合体と結合し、オートファゴソーム膜形成に必須の蛋白となっています [4]。
今回、アメリカ・St.Jude Children's Research病院のGreenらの研究グループは、
Atg16のWDドメインを欠損させたマウス(Atg16LΔWD)を解析し、この部分の欠損で、アルツハイマー病(Alzheimer's disease, AD)病理が生じる事を報告しました [5]。
Noncanonical functions of autophagy proteins have been implicated in neurodegenerative conditions, including Alzheimer’s disease (AD). The WD domain of the autophagy protein Atg16L is dispensable for canonical autophagy but required for its noncanonical functions. Two-year-old mice lacking this domain presented with robust β-amyloid (Aβ) pathology, tau hyperphosphorylation, reactive microgliosis, pervasive neurodegeneration, and severe behavioral and memory deficiencies, consistent with human disease. Mechanistically, we found this WD domain was required for the recycling of Aβ receptors in primary microglia. Pharmacologic suppression of neuroinflammation reversed established memory impairment and markers of disease pathology in this novel AD model.
オートファジー関連蛋白欠損(Atg16LΔWD)でAD病理現る
2ヶ月齢のAtg16LΔWDマウスを解析したところ、
- 海馬での可溶性Aβの増加
- リン酸化タウの増加
- ミクログリアのAβクリアランスの低下
- ミクログリオーシスの増加
- 神経細胞死
- シナプス可塑性の障害
- 認知機能障害
が生じていた。
著者らは、
Atg16LΔWD
↓
炎症↑
↓
神経障害
↓
認知機能低下
のメカニズムを考え、 Atg16LΔWDでも炎症を抑制すると神経障害を抑えられるのではないかと考えた。
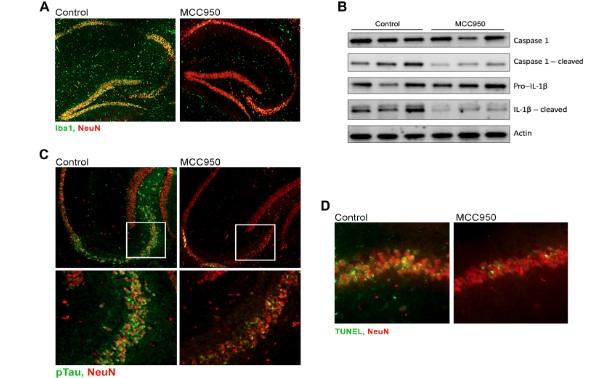
そこで、Atg16LΔWDマウスにインフラマソーム阻害剤のMCC950を投与したところ、 ミクログリオーシスに減少とともに、タウリン酸化の減少と神経障害の改善、認知機能障害の改善を認めた。
Aβ蓄積は変化がなかった。
最後に、アルツハイマー病(Alzheimer's disease, AD)の患者さん脳内でオートファジー関連蛋白を調べたところ、 ATG16、Rubicon、FIP200、ATG15のタンパク量が減少していた。
以上の結果は、Atg16LΔWDによってAD病理と認知機能低下が生じる事を示すとともに、 炎症抑制によってこの現象がレスキューできることを示唆していた。
ADではオートファジー関連蛋白が減少していた事から、 実際のADでも炎症抑制が治療ターゲットとなり得ると考えられた。
My View
Atg16Lのノックアウトでは、異常な炎症性免疫応答を生じるようですが [6]、今回は、WDリピートドメインを欠損させたマウスの解析。
このWDリピートドメイン内の遺伝子変異はクローン病と関連があるようです [7 , 8]。
以下、考察いろいろ。
Atg16LΔWD → Aβ/タウ病理
著者らは、まずAtg16LΔWDの脳内でAβ蓄積やタウリン酸化等のAD病理が増悪していると示しています。
APP遺伝子変異やヒトAPP遺伝子ノックインマウス等以外でAβの蓄積をきたしたというのは、今まで聞いた事がありませんでした。
初めてじゃないでしょうか?
それだと面白いのですが、細胞外Aβとしているイメージが全然プラークっぽくないことと、WBで不溶性Aβの増加がなさそうなのがちょっと気になるところ。
…神経細胞内の可溶性Aβはオートファジーで処理されるけれど、細胞外の不溶性Aβは別(グリア系)という事でいいのかな?
あと、p-タウのWBのバンドが全てシングルバンドなのも 「なぜ?」とちょっと不思議に思いました。
Atg16LΔWD → 炎症/細胞障害/認知機能障害
論文では、Aβとタウ病理を示した後、炎症/細胞障害/認知機能障害へと続き、両者の関連性を主張しているのですが、
オートファジー関連蛋白を欠損させたら色々異常がでるはずなので、AD病理との直接的な関連付けは難しいかもしれません。
AD患者さんでの検証
最後にAD患者さんの脳内でオートファジー関連蛋白が減少している、と示していますが、
これは、NixonやCuervoらの研究グループが、
「ヒトAD脳 [9] やADマウスモデル [10]ではオートファゴソームが増えていて、ライソソームクリアランスの障害が問題だ」
と報告している事と反対の事を示しているように思います。
全体的に
…と、色々気になるところはありますが、ADの治療候補を挙げ、効果を示せているのは何より。
また、オートファジー機能の改善じゃなくて、その下流と彼らが考えている炎症にターゲットをもってきたのも面白いと思いました。
私だったら、神経細胞内のタウ凝集体が主にオートファジー系で処理される [11] 事から、
オートファジー↑ → タウ病理改善 → 神経障害改善
の経路を考えてしまいますが…今回のような切り口もアリだな。
このまま研究が進んで、ぜひヒトへの臨床応用まで持っていってほしいです。
それにうまくいけば、
多分ADだけじゃなくて、
他の神経変性疾患や全身疾患にも効果がありそうな気がするし…
References
- Mizushima, N. & Komatsu, M.: Autophagy: renovation of cells and tissues. Cell, 147, 728-741 (2011)
- Mizushima N, Yoshimori T, Ohsumi Y. The role of Atg proteins in autophagosome formation. Annu Rev Cell Dev Biol. 2011;27:107-132. doi: 10.1146/annurev-cellbio-092910-154005
- Mizushima N, Kuma A, Kobayashi Y, et al. Mouse Apg16L, a novel WD-repeat protein, targets to the autophagic isolation membrane with the Apg12-Apg5 conjugate. J Cell Sci. 2003;116(Pt 9):1679-1688. doi: 10.1242/jcs.00381
- Fujita N, Itoh T, Omori H, Fukuda M, Noda T, Yoshimori T. The Atg16L complex specifies the site of LC3 lipidation for membrane biogenesis in autophagy. Mol Biol Cell. 2008;19(5):2092-2100. doi: 10.1091/mbc.e07-12-1257
- Heckmann BL, Teubner BJW, Boada-Romero E, et al. Noncanonical function of an autophagy protein prevents spontaneous Alzheimer's disease. Sci Adv. 2020;6(33):eabb9036. Published 2020 Aug 14. doi: 10.1126/sciadv.abb9036
- Saitoh T, Fujita N, Jang MH, et al. Loss of the autophagy protein Atg16L1 enhances endotoxin-induced IL-1beta production. Nature. 2008;456(7219):264-268. doi: 10.1038/nature07383
- Hampe J, Franke A, Rosenstiel P, et al. A genome-wide association scan of nonsynonymous SNPs identifies a susceptibility variant for Crohn disease in ATG16L1. Nat Genet. 2007;39(2):207-211. doi: 10.1038/ng1954
- Rioux JD, Xavier RJ, Taylor KD, et al. Genome-wide association study identifies new susceptibility loci for Crohn disease and implicates autophagy in disease pathogenesis. Nat Genet. 2007;39(5):596-604. doi: 10.1038/ng2032
- Nixon RA, Wegiel J, Kumar A, et al. Extensive involvement of autophagy in Alzheimer disease: an immuno-electron microscopy study. J Neuropathol Exp Neurol. 2005;64(2):113-122. doi: 10.1093/jnen/64.2.113
- Yang DS, Stavrides P, Mohan PS, et al. Therapeutic effects of remediating autophagy failure in a mouse model of Alzheimer disease by enhancing lysosomal proteolysis. Autophagy. 2011;7(7):788-789. doi: 10.4161/auto.7.7.15596
- Guo JL, Buist A, Soares A, et al. The Dynamics and Turnover of Tau Aggregates in Cultured Cells: INSIGHTS INTO THERAPIES FOR TAUOPATHIES. J Biol Chem. 2016;291(25):13175-13193. doi: 10.1074/jbc.M115.712083